长链非编码RNA OPA相互作用蛋白5反向转录序列1靶向调控微RNA-128-3p对结直肠癌细胞增殖、侵袭和转移的影响
郑留昌,崔发财,郑培明,赵伟锋
作者单位:郑州大学人民医院,a检验科,b肿瘤内科,河南 郑州 450003
恶性肿瘤一直是全球范围内导致人类死亡的主要原因,2022年中国新发肿瘤病人482万,新增肿瘤死亡病人321万,其中结直肠癌(colorectal cancer,CRC)的发病率和病死率已升至第2 位和第5 位,且相比以往有逐年增高趋势,这严重危害了国人的生命健康[1]。结直肠由于其特殊的解剖学特点,癌细胞可以通过淋巴、血液、腹膜或邻近组织器官浸润等多种形式进行播散和转移,研究报道约20%的CRC 病人在诊断时已发生转移,约50%的最初局部病变病人将发展为转移,而转移和复发是影响结直肠癌病人远期预后的重要因素[2-3],因此阐明结直肠癌发生、发展、侵袭转移的分子机制和筛选有效的分子靶标将极大帮助结直肠癌的诊断和治疗。研究表明长链非编码RNA(lncRNA)在染色质结构与表观遗传重构、mRNA剪切和翻译、蛋白质定位和活化等过程中发挥重要作用[4],其异常表达与肿瘤的发生发展密切相关[5]。OPA 相互作用蛋白5 反向转录序列1(OIP5-AS1)是新发现的一种定位于染色体15q15.1 的非编码RNA,在非小细胞肺癌[6]、宫颈癌[7]、食管癌[8]等肿瘤组织中表达上调并参与调控肿瘤细胞增殖、侵袭和转移过程, 被认为作为致癌基因发挥作用。miR-128-3p 被证实在结直肠癌中发挥抑癌基因功能,其表达下调与结直肠癌EMT 进程[9]和肿瘤化疗耐药性相关[10]。本课题组前期通过ENCORI 软件分析发现lncRNA OIP5-AS1 与miR-128-3p 间存在靶向结合位点,由于目前lncRNA OIP5-AS1 在结直肠癌中的表达情况及其影响结直肠癌进展的机制尚未有研究报道,因此本研究旨在分析lncRNA OIP5-AS1在结直肠癌中的表达及其靶向调控miR-128-3p 对结直肠癌细胞增殖、侵袭和转移的影响,为阐明结直肠癌发生发展的分子机制提供有价值的理论基础。
1 资料和方法
1.1 一般资料根据样本量计算公式:N=Z2×[P×(1-P)]/E2,将置信区间Z 设定为1.96,概率值P设为90%,允许误差设定在10%以内,得出本研究所需样本量最少为 35例。选取2017年1月至2018年12月在郑州大学人民医院住院并进行手术治疗的38 例结直肠病人作为研究对象,收集病人经手术切除的癌组织及癌旁组织(距癌组织边缘 >2 cm)样本并冻存于液氮罐中。结直肠癌病人纳入标准[11]:(1)病人术前未接受其他任何形式的抗肿瘤治疗;(2)所有病人均为首次诊断结直肠癌和实施首次手术;(3)所有病人临床资料完整且术后组织病理由2 位病理科医师共同诊断为结直肠癌;(4)病人没有精神性疾病。排除标准:(1)病人既往或现在伴发其他类型肿瘤;(2)病人有严重器质性疾病;(3)病人患有溃疡性结肠炎、急性或慢性胃肠道炎症以及自身免疫性疾病。38 例结直肠癌病人中,男性23 例,女性15 例;年龄范围为39~76 岁,年龄(57.8±6.9)岁;病理组织学分级Ⅰ~Ⅱ级25 例,Ⅲ~Ⅳ级13 例;参考美国肿瘤联合委员会(AJCC)第8 版结直肠癌TNM 分期:Ⅰ期7 例,Ⅱ期13 例,Ⅲ期18 例;无淋巴结转移20 例,有淋巴结转移18 例。所有病人或其近亲属均签署知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 细胞与试剂LoVo 细胞和HT-29 细胞购自上海慧颖生物科技有限公司,SW620、SW480 和FHC细胞保存在郑州大学人民医院中心实验室。0.25%胰酶、新生小牛血清(NBCS)、RPMI1640 系列培养基、LipofectamineTM3000及双萤光素酶报告基因检测试剂盒均为赛默飞公司旗下产品;RNA-easy Isolation 试剂、通用反转录试剂盒(M-MLV)、高特异性染料法定量PCR 检测试剂盒(AceQ®qPCR SYBR Green Master Mix)购自诺唯赞生物科技公司;BCA蛋白浓度测定试剂盒,兔抗人单克隆抗体[细胞周期蛋白D1(Cyclin D1)、波形蛋白(Vimentin)、N-钙黏蛋白(N-cadherin)、E-钙黏蛋白(E-cadherin)蛋白、E2F1 和3-磷酸甘油醛脱氢酶(GAPDH)],山羊抗兔二抗(HPR 标记)均购自武汉菲恩生物科技公司;miR-128-3p 模拟物(miR-128-3p mimic)、miR-128-3p抑制物(miR-128-3p inhibitor)、OIP5-AS1 小干扰RNA(si-OIP5-AS1)及相关阴性对照均由上海禾午生物科技有限公司设计合成。
1.3 细胞培养和转染37 ℃,5%二氧化碳条件下用RPMI1640 培养基(含10%FBS 和100 g/L 链霉素)培养实验细胞。调整细胞浓度为1×109个/升,6孔板铺板,当细胞融合度达到70%左右时,按照LipofectamineTM3000 转染试剂盒说明书转染细胞,并在48 h 后检测转染效率。根据转染物和实验目的将SW620 细胞分为si-OIP5-AS1 组、si-NC 组、 miR-128-3p mimic 组、mimic-NC 组、miR-128-3p inhibitor+ si-OIP5-AS1组和inhibitor-NC+ si-OIP5-AS1 组。
1.4 实时荧光定量PCR(qPCR)检测采用RNAeasy Isolation 试剂提取CRC 组织及细胞的总RNA,M-MLV 逆转录酶将总RNA 生成cDNA,采用AceQ®qPCR SYBR Green Master 试剂盒在ABI 7500 荧光PCR 仪上进行扩增,条件为: 95 ℃ 预变性10 min 后继续变性20 s,56 ℃退火25 s,71 ℃延伸 20 s,扩增循环46 次。采用2-ΔΔCt法计算LncRNA OIP5-AS1 和miR-128-3p 的相对表达量。LncRNA OIP5-AS1 和miR-128-3p启动子序列信息见表1。

表1 实时荧光定量PCR的引物序列
1.5 克隆形成实验将处于对数增长期的各实验组细胞以1×103个/孔接种至6孔板并连续培养14 d,中途每隔3 d 进行培养基更换并观察细胞形态。培养结束后用PBS 清洗、多聚甲醛固定并进行结晶紫染色,继续PBS 洗涤3 次,晾干后在显微镜下观察并用数码相机拍照,一个克隆点超过50个细胞被称为克隆细胞。实验重复3次。
1.6 CCK-8实验调整各实验组细胞浓度为3×108个/升,96 孔板每孔加入100 μL 细胞悬液,细胞贴壁后继续培养24、48和72 h,然后向每孔中添加10 μL CCK-8试剂继续培养1 h,用酶标仪测定450 nm处的吸光度值[D(λ)450 nm]。实验重复3次。
1.7 划痕愈合实验各实验组细胞以5×105个/孔接种于6孔板中,当细胞融合率达100%时,用10 μL移液器枪头在培养孔底部正中垂直划一条直线,空白组作为对照,继续孵育48 h 后,测量划痕宽度并计算愈合率。划痕愈合率(%)=(0 h 划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。实验重复3次。
1.8 Transwell 实验参考使用说明书将Matrigel胶预先包被于transwell 小室上室,将各实验组细胞用无血清RPMI 1640 培养基调整浓度为2×107/L,取100 μL 加入上室,下室培养基中额外加入10%NBCS,放入二氧化碳培养箱培养48 h。PBS 清洗下室2 次,风干后直接用0.1%结晶紫染色,在倒置显微镜下随机计数5个高倍视野,计数侵袭细胞数,计算平均值。实验重复3次。
1.9 双萤光素酶报告实验采用ENCORI 软件(http://starbase.sysu.edu.cn/index.php)预测LncRNA OIP5-AS1 和miR-128-3p 间的靶向结合位点,并设计合成野生型和突变型报告基因质粒(OIP5-AS1-WT和OIP5-AS1-MUT)。当细胞融合度达80%时,将报告基因质粒、miR-128-3p mimic 和内参phRL-TK(转染量40∶1)共转染细胞,48 h 后,采用双萤光素酶报告基因系统检测荧光活性。
1.10 蛋白质印迹法收集各实验组细胞用裂解液提取总蛋白,绘制BCA 标准曲线测定蛋白浓度。制备SDS-PAGE 电泳胶,进行蛋白上样、分离和转膜,TBST 封闭后,将PVDF 膜与E-cadherin 一抗(1∶1 000)、N-cadherin(1∶1 000)一抗和Vimentin(1∶800)一抗、cyclin D1(1∶600)一抗和E2F1(1∶800)一抗和GAPDH 一抗(1∶2 000)放置冷藏冰箱孵育过夜,TBST 漂洗后,加入山羊抗兔二抗(1∶2 000)继续孵育1.5 h,用ECL试剂使PVDF膜显影,采用image J进行条带分析。
1.11 统计学方法应用SPSS 17.0 和Graphpad prism 6.0 软件进行统计学分析,计量资料以±s表示,多组间均数差异的比较采用单因素方差分析,组内两两比较采用LSD-t检验,两组间比较采用独立样本t检验。采用pearson 检验分析LncRNA OIP5-AS1 和miR-128-3p 表达的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA OIP5-AS1在结直肠癌组织和细胞中高表达LncRNA OIP5-AS1在结直肠癌组织中的相对表达水平显著高于癌旁组织,其在结直肠癌细胞株(SW480、SW620、HT-29 和LoVo)中的相对表达水平显著高于FHC 细胞,见表2,表3。上述结果表明lncRNA OIP5-AS1 异常表达可能参与结直肠癌的发生发展过程。另外,由于lncRNA OIP5-AS1 在SW620 细胞中有着更高的表达水平,被用于后续实验研究。
表2 LncRNA OIP5-AS1和miR-128-3p在结直肠癌组织中的表达情况/± s
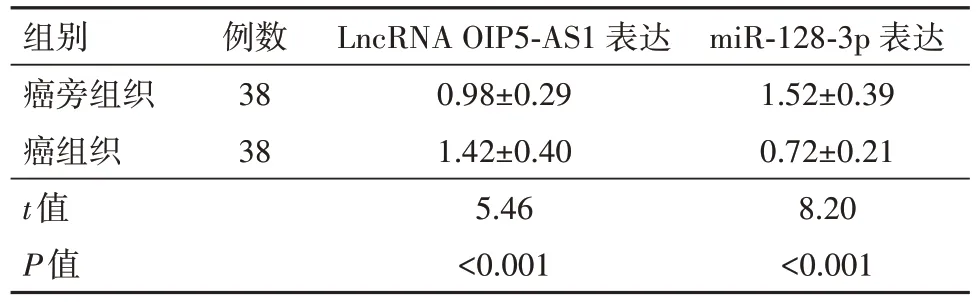
表2 LncRNA OIP5-AS1和miR-128-3p在结直肠癌组织中的表达情况/± s
注:lncRNA OIP5-AS1 为长链非编码RNA OPA 相互作用蛋白5反向转录序列1,miR-128-3p为微RNA-128-3p。
miR-128-3p 表达1.52±0.39 0.72±0.21 8.20<0.001组别癌旁组织癌组织t值P值例数38 38 LncRNA OIP5-AS1 表达0.98±0.29 1.42±0.40 5.46<0.001
表3 LncRNA OIP5-AS1和miR-128-3p在结直肠癌细胞中的表达情况/± s
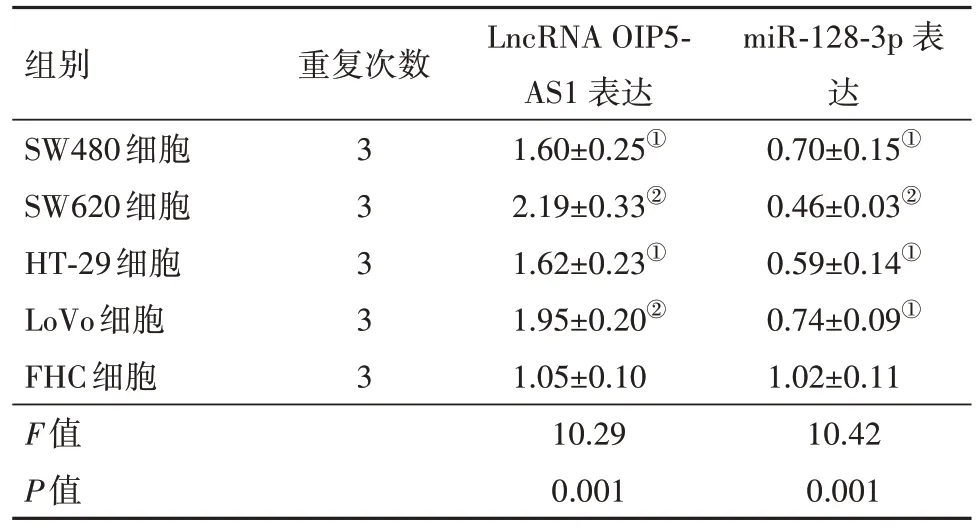
表3 LncRNA OIP5-AS1和miR-128-3p在结直肠癌细胞中的表达情况/± s
注:lncRNA OIP5-AS1 为长链非编码RNA OPA 相互作用蛋白5反向转录序列1,miR-128-3p为微RNA-128-3p。①与FHC细胞比较,P<0.05。② 与FHC细胞比较,P<0.01。
miR-128-3p 表达0.70±0.15①0.46±0.03②0.59±0.14①0.74±0.09①1.02±0.11 10.42 0.001组别SW480细胞SW620细胞HT-29细胞LoVo细胞FHC细胞F值P值重复次数3 3 3 3 3 LncRNA OIP5-AS1 表达1.60±0.25①2.19±0.33②1.62±0.23①1.95±0.20②1.05±0.10 10.29 0.001
2.2 miR-128-3p 在结直肠癌组织和细胞中低表达miR-128-3p 在结直肠癌组织中的相对表达水平显著低于癌旁组织,其在结直肠癌细胞株(SW480、SW620、HT-29 和LoVo)中的相对表达水平显著低于FHC 细胞。上述结果表明,miR-128-3p 的异常表达也与结直肠癌的进展过程有关。见表2,3。
2.3 LncRNA OIP5-AS1表达下调抑制结直肠癌细胞的增殖、侵袭和转移转染si-OIP5-AS1可有效抑制SW620 细胞中LncRNA OIP5-AS1 的表达,si-OIP5-AS1 组的细胞增殖活性、克隆细胞数、细胞侵袭数、划痕愈合率及E2F1、cyclin D1、vimentin 和Ncadherin 蛋白表达均显著低于si-NC 组(均P<0.05),E-cadherin 蛋白表达显著高于si-NC 组(P<0.05),见表4,5。
表4 lncRNA OIP5-AS1表达下调后SW620细胞增殖能力和细胞周期相关蛋白的变化/± s
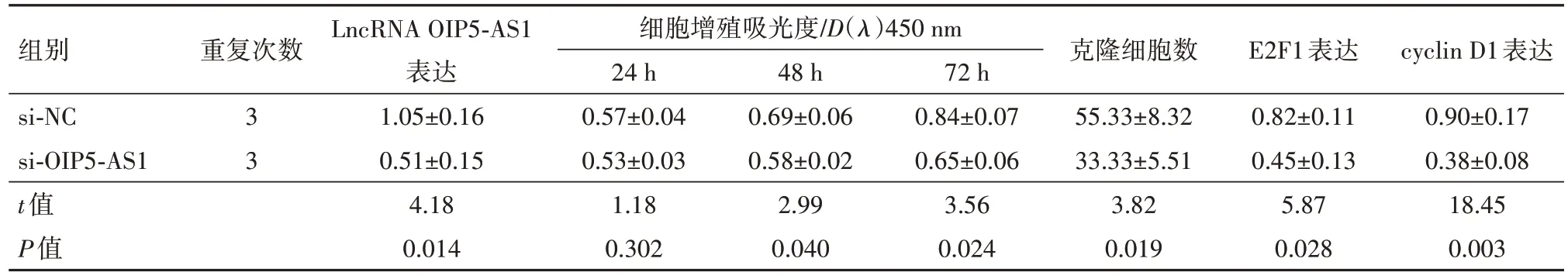
表4 lncRNA OIP5-AS1表达下调后SW620细胞增殖能力和细胞周期相关蛋白的变化/± s
注:lncRNA OIP5-AS1为长链非编码RNA OPA相互作用蛋白5反向转录序列1,Cyclin D1为细胞周期蛋白D1。
组别si-NC si-OIP5-AS1 t值P值LncRNA OIP5-AS1表达1.05±0.16 0.51±0.15 4.18 0.014细胞增殖吸光度/D(λ)450 nm 24 h 0.57±0.04 0.53±0.03 1.18 0.302 cyclin D1表达0.90±0.17 0.38±0.08 18.45 0.003重复次数3 3 48 h 0.69±0.06 0.58±0.02 2.99 0.040 72 h 0.84±0.07 0.65±0.06 3.56 0.024克隆细胞数55.33±8.32 33.33±5.51 3.82 0.019 E2F1表达0.82±0.11 0.45±0.13 5.87 0.028
表5 lncRNA OIP5-AS1表达下调后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
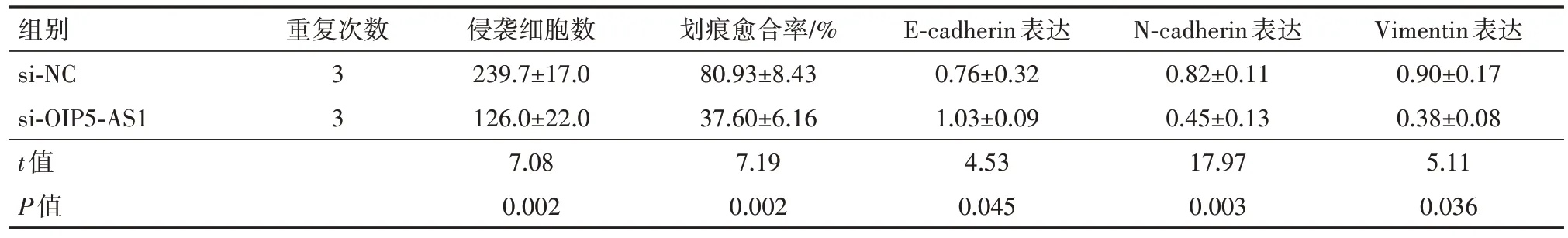
表5 lncRNA OIP5-AS1表达下调后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
注:lncRNA OIP5-AS1 为长链非编码RNA OPA 相互作用蛋白5 反向转录序列1,E-cadherin 为E-钙黏蛋白,N-cadherin 为N-钙黏蛋白,Vimentin为波形蛋白。
Vimentin表达0.90±0.17 0.38±0.08 5.11 0.036组别si-NC si-OIP5-AS1 t值P值重复次数3 3侵袭细胞数239.7±17.0 126.0±22.0 7.08 0.002划痕愈合率/%80.93±8.43 37.60±6.16 7.19 0.002 E-cadherin表达0.76±0.32 1.03±0.09 4.53 0.045 N-cadherin表达0.82±0.11 0.45±0.13 17.97 0.003
2.4 miR-128-3p 表达上调抑制结直肠癌细胞的增殖、侵袭和转移转染miR-128-3p mimic 可显著上调结SW620 细胞中miR-128-3p 的表达,miR-128-3p mimic 组的细胞活性、克隆细胞数、细胞侵袭数、划痕愈合率及E2F1、cyclin D1、vimentin 和N-cadherin蛋白表达均显著低于mimic-NC 组(均P<0.05),Ecadherin 蛋白表达显著高于mimic-NC 组(P<0.05),见表6,7。
表6 miR-128-3p表达上调后SW620细胞增殖能力和细胞周期相关蛋白的变化/± s
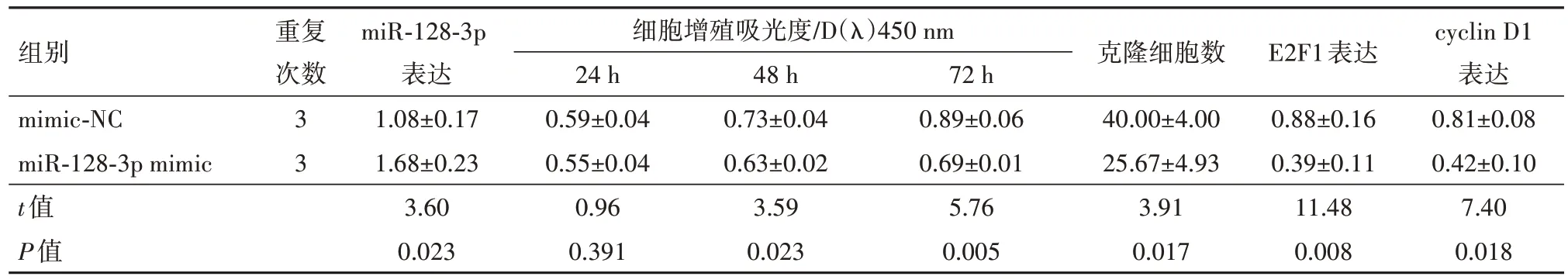
表6 miR-128-3p表达上调后SW620细胞增殖能力和细胞周期相关蛋白的变化/± s
注:miR-128-3p为微RNA-128-3p,Cyclin D1为细胞周期蛋白D1。
组别mimic-NC miR-128-3p mimic t值P值细胞增殖吸光度/D(λ)450 nm 24 h 0.59±0.04 0.55±0.04 0.96 0.391 cyclin D1表达0.81±0.08 0.42±0.10 7.40 0.018重复次数3 3 miR-128-3p表达1.08±0.17 1.68±0.23 3.60 0.023 48 h 0.73±0.04 0.63±0.02 3.59 0.023 72 h 0.89±0.06 0.69±0.01 5.76 0.005克隆细胞数40.00±4.00 25.67±4.93 3.91 0.017 E2F1表达0.88±0.16 0.39±0.11 11.48 0.008
表7 miR-128-3p表达上调后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
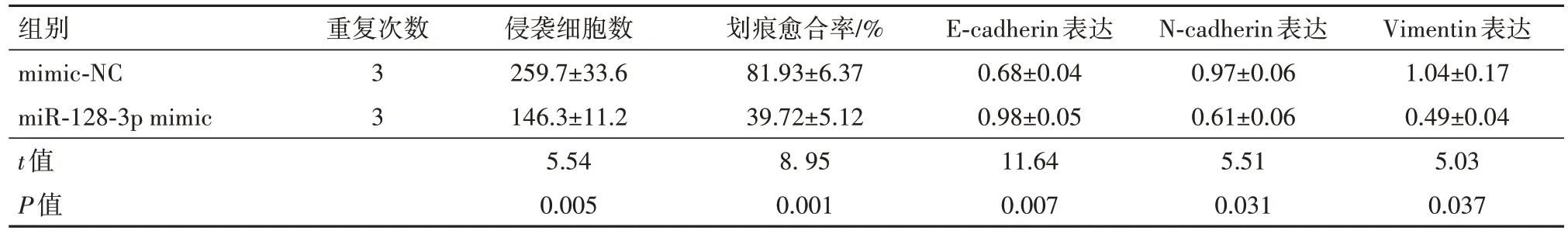
表7 miR-128-3p表达上调后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
注:miR-128-3p为微RNA-128-3p,E-cadherin为E-钙黏蛋白,N-cadherin为N-钙黏蛋白,Vimentin为波形蛋白。
组别mimic-NC miR-128-3p mimic t值P值Vimentin表达1.04±0.17 0.49±0.04 5.03 0.037重复次数3 3侵袭细胞数259.7±33.6 146.3±11.2 5.54 0.005划痕愈合率/%81.93±6.37 39.72±5.12 8. 95 0.001 E-cadherin表达0.68±0.04 0.98±0.05 11.64 0.007 N-cadherin表达0.97±0.06 0.61±0.06 5.51 0.031
2.5 LncRNA OIP5-AS1 靶向调控miR-128-3p 的表达Pearson 相关性检验显示miR-128-3p 和LncRNA OIP5-AS1在结直肠癌组织中的表达呈负相关(r=-0.31,P=0.005),提示LncRNA OIP5-AS1 和miR-128-3p 在结直肠癌的发生发展机制中可能存在靶向调节关系。LncRNA OIP5-AS1 和miR-128-3p 间的靶向结合位点,见图1。
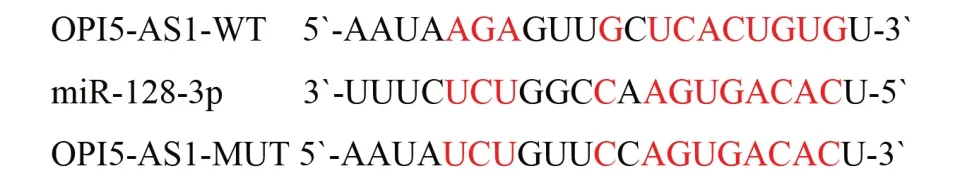
图1 miR-128-3p和LncRNA OIP5-AS1间靶向结合位点
将OIP5-AS1-WT 质粒或OIP5-AS1-MUT 质粒与miR-128-3p mimic 共转染SW620 细胞,前者荧光活性较阴性对照组显著降低(0.72±0.08 比1.08±0.17,t=6.28,P=0.024),后者较对照组无明显改变(t=0.74,P=0.538)。
2.6 下调miR-128-3p逆转LncRNA OIP5-AS1敲除对结直肠癌SW620细胞增殖、侵袭和转移影响将miR-128-3p inhibitor及阴性对照inhibitor-NC 分别与si-OIP5-AS1 共转染SW620 细胞后,si-OIP5-AS1+miR-128-3p inhibitor 组miR-128-3p 表达水平显著低于si-OIP5-AS1+inhibitor-NC 组,但两组间lncRNA OIP5-AS1 表达水平差异无统计学意义,表明转染miR-128-3p inhibitor 可下调miR-128-3p 表达水平,但不会对lncRNA OIP5-AS1 表达造成影响。si-OIP5-AS1+ miR-128-3p inhibitor 组的细胞活性、克隆细胞数、细胞侵袭数、划痕愈合率及E2F1、cyclin D1、vimentin 和N-cadherin 蛋白表达均显著高于si-OIP5-AS1+inhibitor-NC 组(均P<0.05),Ecadherin 蛋白表达显著低于si-OIP5-AS1+inhibitor-NC组(P<0.05),见表8,9。
表8 共转染miR-128-3p inhibitor和si-OIP5-AS1后SW620细胞增殖能力和细胞周期相关蛋白变化/± s
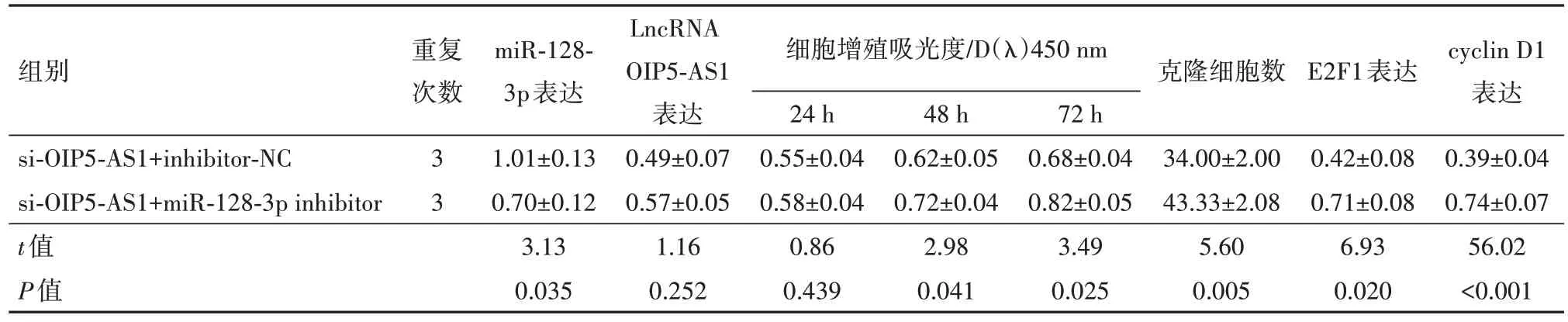
表8 共转染miR-128-3p inhibitor和si-OIP5-AS1后SW620细胞增殖能力和细胞周期相关蛋白变化/± s
注:lncRNA OIP5-AS1 为长链非编码RNA OPA 相互作用蛋白5 反向转录序列1,miR-128-3p 为微RNA-128-3p,Cyclin D1 为细胞周期蛋白D1。
组别重复次数克隆细胞数LncRNA OIP5-AS1表达0.49±0.07 0.57±0.05 1.16 0.252 E2F1表达细胞增殖吸光度/D(λ)450 nm 24 h 0.55±0.04 0.58±0.04 0.86 0.439 miR-128-3p表达1.01±0.13 0.70±0.12 3.13 0.035 cyclin D1表达0.39±0.04 0.74±0.07 56.02<0.001 si-OIP5-AS1+inhibitor-NC si-OIP5-AS1+miR-128-3p inhibitor t值P值3 3 48 h 0.62±0.05 0.72±0.04 2.98 0.041 72 h 0.68±0.04 0.82±0.05 3.49 0.025 34.00±2.00 43.33±2.08 5.60 0.005 0.42±0.08 0.71±0.08 6.93 0.020
表9 共转染miR-128-3p inhibitor和si-OIP5-AS1后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
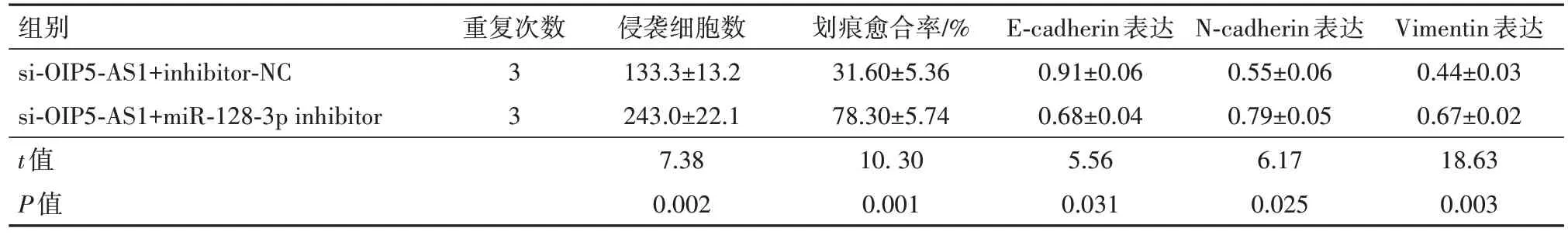
表9 共转染miR-128-3p inhibitor和si-OIP5-AS1后SW620细胞侵袭迁移能力和EMT相关蛋白变化/± s
注:lncRNA OIP5-AS1 为长链非编码RNA OPA 相互作用蛋白5 反向转录序列1,miR-128-3p 为微RNA-128-3p,E-cadherin 为E-钙黏蛋白,N-cadherin为N-钙黏蛋白,Vimentin为波形蛋白。
Vimentin表达0.44±0.03 0.67±0.02 18.63 0.003组别si-OIP5-AS1+inhibitor-NC si-OIP5-AS1+miR-128-3p inhibitor t值P值重复次数3 3侵袭细胞数133.3±13.2 243.0±22.1 7.38 0.002划痕愈合率/%31.60±5.36 78.30±5.74 10. 30 0.001 E-cadherin表达0.91±0.06 0.68±0.04 5.56 0.031 N-cadherin表达0.55±0.06 0.79±0.05 6.17 0.025
3 讨论
LncRNA 是非编码RNA 的主要成员,它本身不具备蛋白编码功能,但能在基因表达调节方面发挥关键作用,参与细胞代谢、生长、分化和凋亡等多种生物途径的调控[12]。近年来研究表明,lncRNA 表达失调与CRC 的发展进程密切相关,这为CRC 诊断、治疗及预后评估相关生物标志物的筛选提供了新的研究思路。 例如,Song 等[13]发现LncRNA MCM3AP-AS1 在结直肠癌病人组织、细胞及外周血中的表达均有显著升高,它与病人的临床病理分期和预后相关,并在预测结直肠癌复发方面具有较好的灵敏度和特异度;Kuang 等[14]报道lncRNAs AC156455.1 和AC104532.2 可作为结直肠癌诊断和预后的生物标志物,并有可能成为免疫治疗的设计靶点;此外,Zhang 等[15]筛选并建立了一组N6 腺苷甲基化(m6A)相关lncRNA,在预测结直肠癌病人的无病生存期方面有一定应用价值。OIP5-AS1 是一种新发现的lncRNA,研究显示其在卵巢癌[16]中异常高表达,敲降其表达可导致整合素α6(ITGA6)表达降低,进而抑制卵巢癌细胞的侵袭和迁移,促进细胞凋亡。LncRNA OIP5-AS1在胰腺癌中也处于异常高表达状态,其通过调控叉头框蛋白M1(FOXM1)/Wnt/β-catenin 信号通路影响胰腺癌细胞的增殖、侵袭和转移[17]。此外,研究报道lncRNA OIP5-AS1 高表达与非小细胞肺癌[18]化疗耐药相关,并是影响肺腺癌[19]病人预后的独立风险因素。本研究首次发现OIP5-AS1 在结直肠癌组织和结直肠癌细胞中的表达水平显著升高,通过转染小干扰RNA 抑制OIP5-AS1 表达后,结直肠癌SW620 细胞的克隆数量、增殖活性、侵袭细胞数及划痕愈合率均较对照组显著降低,表明OIP5-AS1在结直肠癌的进展过程中发挥癌基因作用。cyclin D1 和E2F1 是细胞周期调控关键蛋白,它们的异常表达会导致细胞周期调控功能紊乱,细胞增殖失控,从而导致癌症发生。本研究中,沉默OIP5-AS1 表达后,SW620 细胞中cyclin D1 和E2F1 表达水平相应降低,表明lncRNA OIP5-AS1 通过调控细胞周期蛋白影响结直肠癌细胞增殖。上皮间充质转化(EMT)在肿瘤细胞转移、干细胞特性获得及免疫逃逸方面均发挥重要作用,E-cadherin、Vimentin 和N-cadherin 是其特征性标志物。本研究中,沉默OIP5-AS1 表达后,SW620 细胞中E-cadherin 表达升高,Vimentin 和N-cadherin 表达降低,EMT进程被逆转,表明lncRNA OIP5-AS1通过调控EMT 进程影响结直肠癌细胞的侵袭和迁移过程。
miR-128-3p 能抑制人体多种恶性肿瘤细胞的增殖和侵袭,被认为是一种具有广泛抑癌作用的微RNA,如华科雷等[20]发现miR-128-3p 在胃癌组织中低表达,其通过靶向CLDN18 抑制胃癌细胞的侵袭和迁移能力;Shi 等[21]发现miR-128-3p 在肝癌组织中低表达,其通过靶向CDC6 抑制肝癌细胞的增殖和转移。本研究结果显示,miR-128-3p 在结直肠癌组织和细胞中低表达,这与相关研究结果一致,提示其在结直肠癌的进展过程中也发挥抑癌基因作用。转染miR-128-3p 模拟物上调其表达后,cyclin D1、E2F1、Vimentin 和N-cadherin 的表达较对照组显著降低, E-cadherin 表达显著升高, SW620 细胞的增殖、侵袭和迁移能力得到有效抑制,表明miR-128-3p 也可通过调控细胞周期蛋白及EMT 蛋白表达影响结直肠癌的增殖及迁移过程。此外,本研究还发现lncRNA OIP5-AS1和miR-128-3p在结直肠癌组织中的表达呈负相关,提示两者间相互作用是影响结直肠癌发生发展的重要机制。研究[22]表明,LncRNA 作为竞争性内源RNA(ceRNA),能发挥“miRNA 分子海绵”的作用,吸附和抑制miRNA 表达,提高miRNA 靶基因的表达,是肿瘤侵袭转移机制中一个新的研究方向。例如,lncRNA PVT1 靶向调控miR-128-3p 的表达促进乳腺癌的增殖和转移[23],lncRNA HCP5 靶向调控miR-128-3p 的表达促进鼻咽癌的进展[24],LINC00467 靶向调控miR-128-3p 的表达促进结直肠癌的血管生成和肿瘤转移[25]。本研究结果表明lncRNA OIP5-AS1和miR-128-3p间存在靶向结合位点,双萤光素酶报告实验证实lncRNA OIP5-AS1 靶向调控miR-128-3p 表达,在沉默OIP5-AS1 表达的同时抑制miR-128-3p 的表达,SW620 细胞中cyclin D1、E2F1、Vimentin 和N-cadherin 表达升高, E-cadherin 表达降低,沉默OIP5-AS1 表达对结直肠癌细胞增殖、侵袭和迁移的抑制作用被逆转。上述结果表明,lncRNA OIP5-AS1 对miR-128-3p 的靶向调控可能是其参与结直肠癌进展过程的重要途径。
综上所述,lncRNA OIP5-AS1 在结直肠癌中异常高表达,沉默OIP5-AS1可抑制结直肠癌细胞的增殖、侵袭和迁移能力,这可能与它对miR-128-3p 的靶向调控有关。

