藏红花素抑制音猬因子信号通路对结直肠癌细胞恶性生物学行为的影响
高晶晶,孙志涛,姜辉,张宝玉,肖伟,周国庆,宋东旭,张亚玲,马红艳
作者单位:沧州市人民医院,a胃肠外科,b肛肠外科,c神经外科,d病理科,河北 沧州 061000
结直肠癌是世界范围内常见的癌症之一,也是癌症患者死亡的第二大原因。虽然早期筛查、手术切除、辅助化疗、放疗、靶向治疗等治疗方案降低了结直肠癌的发病率和死亡率。但部分病人治疗效果不甚理想,甚至存在高复发率、高转移率以及高耐药率等不良情况[1-2]。因此,迫切需要探索新的治疗策略。许多研究试图通过将已批准的药物与天然化合物结合来改善治疗,并建立以天然化合物为基础的治疗方案[3]。藏红花素是研究最多的天然化合物之一,其为藏红花的主要活性成分,是一种水溶性类胡萝卜素。研究表明藏红花素具有多种生物活性,包括抗炎、抗氧化和抗抑郁等[4-5]。在最近的几年中,藏红花素也被发现具有抗癌活性,可抑制包括结直肠癌在内的多种恶性肿瘤的进展[6-7]。但关于藏红花素的抗癌作用机制目前仍不十分清楚。音猬因子(sonic hedgehog,Shh)信号通路是Hedgehog 信号通路之一,参与细胞分化、增殖、凋亡等生命过程,该通路的异常激活是促进结直肠癌在内的多种恶性肿瘤发生、发展的重要因素[8]。基于上述内容,2021年1月至2022年7月进行本研究,旨在通过体外培养人结直肠癌细胞SW620,观察藏红花素对SW620 细胞恶性生物学行为的影响,并探究抑制Shh信号通路作为其药理机制的可能性。
1 材料与方法
1.1 细胞株和主要试剂、仪器ATCC 来源人结肠癌细胞SW620(上海晶抗生物工程公司,货号JKCS0045);藏红花素(上海玉博生物科技公司,货号ES-0329);Shh 通路激活剂Purmorphamine(MedChemExpress 公司,货号HY-15108);Leibovitz's L-15 培养基(江苏凯基生物公司,货号KGM41300);Annexin V-FITC/PI 试剂盒(北京百奥莱博科技公司,货号HR0399);0.1%结晶紫染液(北京Solarbio 公司,货号G1063);CCK-8 试剂、RIPA 裂解液、BCA 试剂盒(上海碧云天生物公司,货号C0038、P0013B、P0012);兔源一抗anti-Shh、anti-平滑蛋白(Smoothened,Smo)、anti-神经胶质瘤相关癌基因-1(Gliomaassociated oncogene-1,Gli-1)(Abcam 公司,货号ab53281、ab235183、ab134906);兔源一抗anti-GAPDH、山羊抗兔二抗(沈阳万类生物公司,货号WL01114、WLA023)。HERAcell 240i 二氧化碳细胞培养箱(美国Thermo Fisher Scientific 公司);iMark680 多功能酶标仪(美国Bio-Rad 公司);IX73倒置荧光显微镜(日本Olympus公司)。
1.2 细胞培养SW620 细胞采用添加10%FBS 的Leibovitz's L-15培养基,培养于37 ℃、无二氧化碳的培养箱中,选用对数生长期细胞进行实验。
1.3 CCK-8 实验、克隆形成实验检测SW620 细胞增殖情况CCK-8 实验:将SW620 细胞以5×103个/孔接种至96孔板,待贴壁后添加不同剂量藏红花素(5、10、20、40、60、80 mg/L)处理细胞24 h;另用浓度为10、20、40 mg/L 的藏红花素处理细胞,作为藏红花素L/M/H 组[9]、40 mg/L 藏红花素+1 μmol/L Purmorphamine[10](藏红花素H+Shh通路激活剂组)、Shh通路激活剂组(1 μmol/L Purmorphamine),另设置正常培养的对照(Control)组,继续培养24 h。而后每孔加入10 μL CCK-8 试剂,继续孵育2 h,通过Multiskan SkyHigh 酶标仪测定450 nm 波长处的吸光度(OD)。细胞活力与OD450成正比。
克隆形成实验:将SW620 细胞以1×103个/孔接种至6 孔板,待贴壁后分组处理同上,继续培养24 h。而后每孔加入4%多聚甲醛固定20 min,弃固定液后加入0.1%结晶紫染色10 min,于显微镜下计数≥50个细胞的克隆形成数。
1.4 划痕愈合实验检测SW620 细胞迁移能力将
SW620 细胞以5×104个/孔接种至24 孔板,待贴壁后弃去培养基,用100 μL 枪头于孔中间竖着划一条直线,PBS 清洗去除划下的细胞,添加培养基(分组处理同1.3)继续培养24 h,于显微镜下拍照,经Image J软件计算划痕面积愈合率。
1.5 Transwell 实验检测SW620 细胞侵袭能力将SW620 细胞用不含FBS 的培养基重悬(1×105个/mL),取100 μL 接种至预先包被Matrigel 的Transwell 小室中,24 孔板中加入600 μL 含10%FBS 的培养基,孵育24 h,而后取出Transwell 小室,经4%多聚甲醛固定30 min,用棉签拭去上表面的细胞,PBS清洗、晾干后经0.1%结晶紫染色10 min,于显微镜下计数侵袭细胞数量。
1.6 Flow Cytometry 检测SW620 细胞凋亡情况将SW620 细胞以5×104个/孔接种至24 孔板,待贴壁后分组处理同1.3,继续培养24 h后收集细胞。计数后转移至流式管中(2×105个/100 μL),每管加入5μL Annexin V-FITC 和5 μL PI,4 ℃孵育15 min,借助BD FACSCanto Ⅱ流式细胞仪检测细胞凋亡情况。
1.7 蛋白质印迹法检测SW620 细胞中Shh 信号通路相关蛋白表达SW620细胞接种及处理同“1.6”,向收集的细胞中加入RIPA裂解液提取总蛋白,BCA法测定浓度,2×loading buffer 定量后进行热变性处理,利用凝胶电泳分离蛋白,随后转膜、封闭,4 ℃孵育兔源一抗anti-Shh、anti-Smo、anti-Gli-1、anti-GAPDH(过夜),次日室温孵育山羊抗兔二抗2 h,滴加ECL 发光液后置于GelSMART 凝胶成像仪中拍照,经Image J软件进行灰度分析。
1.8 统计学方法采用SPSS 25.0 进行分析。计量资料以±s表示,两组比较采用独立样本t检验,多组间比较行One-way ANOVA 检验,进一步两两比较行SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 激活Shh 通路对SW620 细胞增殖、凋亡、迁移和侵袭的影响与对照组相比,Shh 通路激活剂组SW620 细胞活力升高(t=3.65,P=0.011),克隆形成数(t=2.66,P=0.038)、划痕面积愈合率(t=3.77,P=0.009)、侵袭数(t=2.72,P=0.035)、Shh(t=3.32,P=0.016)、Smo(t=3.01,P=0.022)、Gli-1 蛋白表达(t=4.74,P=0.003)增加,细胞凋亡率减少(t=9.54,P<0.001)。见图1,表1。
表1 激活Shh通路对SW620细胞殖、迁移、侵袭、凋亡和Shh通路相关蛋白表达的影响/± s
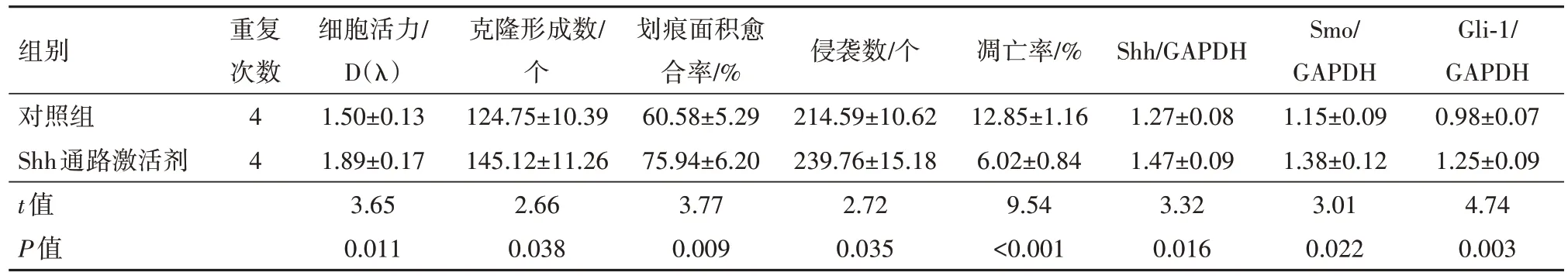
表1 激活Shh通路对SW620细胞殖、迁移、侵袭、凋亡和Shh通路相关蛋白表达的影响/± s
注:Shh为音猬因子,Smo为平滑蛋白,GAPDH为甘油醛-3-磷酸脱氢酶。
组别对照组Shh通路激活剂t值P值Gli-1/GAPDH 0.98±0.07 1.25±0.09 4.74 0.003重复次数4 4细胞活力/D(λ)1.50±0.13 1.89±0.17 3.65 0.011克隆形成数/个124.75±10.39 145.12±11.26 2.66 0.038划痕面积愈合率/%60.58±5.29 75.94±6.20 3.77 0.009侵袭数/个214.59±10.62 239.76±15.18 2.72 0.035凋亡率/%12.85±1.16 6.02±0.84 9.54<0.001 Shh/GAPDH 1.27±0.08 1.47±0.09 3.32 0.016 Smo/GAPDH 1.15±0.09 1.38±0.12 3.01 0.022
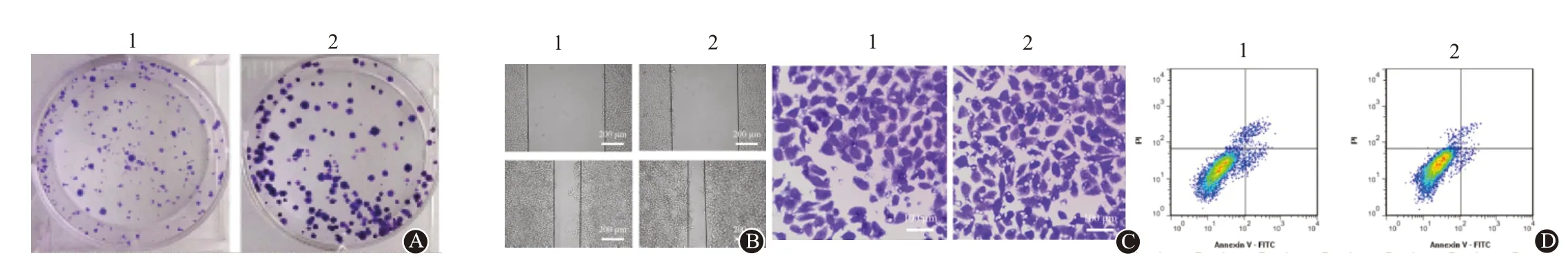
图1 激活Shh通路对SW620细胞增殖、迁移、侵袭、凋亡和Shh通路相关蛋白表达的影响:A为细胞克隆形成实验;B为细胞迁移能力(划痕愈合实验);C为细胞侵袭能力(Transwell实验);D为细胞凋亡(流式细胞术)
2.2 藏红花素对SW620 细胞的细胞毒性作用CCK-8结果显示,使用10、20、40、60、80 mg/L的藏红花素分别处理SW620 细胞24 h 后,藏红花素以剂量依赖性方式降低SW620细胞活力,见表2。经计算,藏红花素对SW620 细胞的IC50值接近40 mg/L,因此,选用10、20、40 mg/L 的藏红花素处理细胞进行后续实验。
表2 藏红花素对SW620细胞的细胞毒性作用/± s

表2 藏红花素对SW620细胞的细胞毒性作用/± s
注:①与0 mg/L藏红花素相比,P<0.05。
藏红花素浓度0 mg/L 5 mg/L 10 mg/L 20 mg/L 40 mg/L 60 mg/L 80 mg/L F值P值细胞活力/%100.00±0.00 97.24±6.10 80.93±6.57①62.62±6.04①51.45±5.33①40.28±5.19①27.90±3.25①121.73<0.001重复次数4 4 4 4 4 4 4
2.3 藏红花素对SW620 细胞增殖能力的影响与对照组相比,藏红花素L 组、藏红花素M 组、藏红花素H 组SW620 细胞活力下降,克隆形成数减少(P<0.05);与藏红花素H 组相比,藏红花素H+Shh 通路激活剂组SW620 细胞活力升高,克隆形成数增加(P<0.05)。见图2,表3。
表3 各组SW620细胞增殖情况/± s
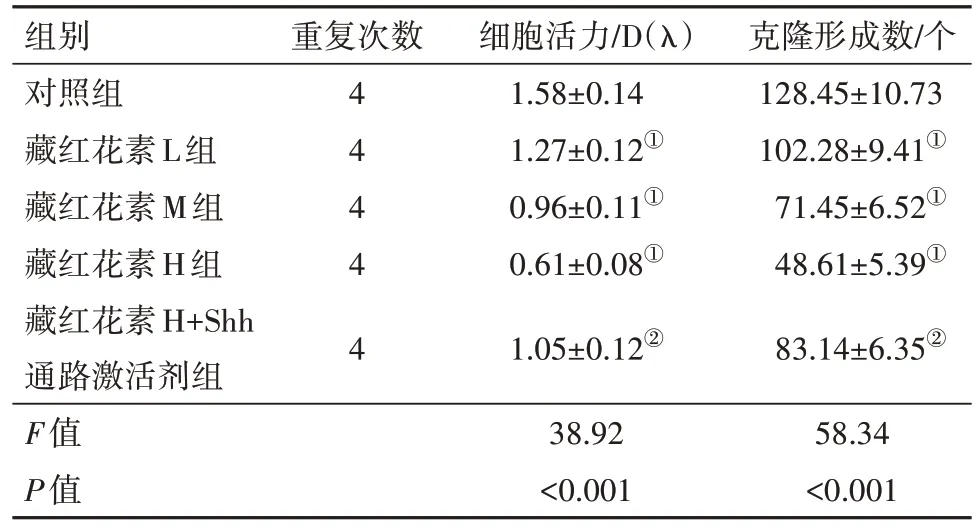
表3 各组SW620细胞增殖情况/± s
注:①与对照组相比,P<0.05。②与藏红花素H组相比,P<0.05。
组别对照组藏红花素L组藏红花素M组藏红花素H组藏红花素H+Shh通路激活剂组F值P值重复次数4 4 4 4 4细胞活力/D(λ)1.58±0.14 1.27±0.12①0.96±0.11①0.61±0.08①1.05±0.12②克隆形成数/个128.45±10.73 102.28±9.41①71.45±6.52①48.61±5.39①83.14±6.35②58.34<0.001 38.92<0.001

图2 克隆形成实验检测SW620细胞增殖:A为对照组;B为藏红花素L组;C为藏红花素M组;D为藏红花素H组;E为藏红花素H+Shh通路激活剂组
2.4 藏红花素对SW620 细胞迁移、侵袭能力的影响与对照组相比,藏红花素L 组、藏红花素M 组、藏红花素H 组SW620 细胞划痕面积愈合率、侵袭数减少(P<0.05);与藏红花素H 组相比,藏红花素H+Shh 通路激活剂组SW620 细胞划痕面积愈合率、侵袭数增加(P<0.05)。见图3,4;表4。
表4 各组SW620细胞迁移、侵袭情况/± s
注:①与对照组相比,P<0.05。②与藏红花素H组相比,P<0.05。
组别对照组藏红花素L组藏红花素M组藏红花素H组藏红花素H+Shh通路激活剂组F值P值重复次数4 4 4 4 4划痕面积愈合率/%61.37±5.12 49.26±5.48①37.19±4.63①27.62±3.25①40.59±3.92②侵袭数/个218.73±13.28 174.52±11.36①133.68±10.15①75.94±8.29①146.25±11.24②91.88<0.001 31.49<0.001

图3 划痕愈合实验检测SW620细胞迁移能力(×100)
2.5 藏红花素对SW620 细胞凋亡的影响与对照组相比,藏红花素L 组、藏红花素M 组、藏红花素H组SW620 细胞凋亡率增加(P<0.05);与藏红花素H组相比,藏红花素H+Shh 通路激活剂组SW620 细胞凋亡率减少(P<0.05)。见图5,表5。
表5 各组SW620细胞凋亡情况/± s

表5 各组SW620细胞凋亡情况/± s
注:①与对照组相比,P<0.05。②与藏红花素H组相比,P<0.05。
组别对照组藏红花素L组藏红花素M组藏红花素H组藏红花素H+Shh通路激活剂组F值P值凋亡率/%13.56±1.22 20.49±1.53①31.62±1.85①45.39±2.17①27.43±1.61②199.38<0.001重复次数4 4 4 4 4

图5 流式细胞仪检测SW620细胞凋亡:A为对照组;B为藏红花素L组;C为藏红花素M组;D为藏红花素H组;E为藏红花素H+Shh通路激活剂组
2.6 藏红花素对SW620 细胞中Shh 信号通路相关蛋白表达的影响与对照组相比,藏红花素L组、藏红花素M组、藏红花素H组SW620细胞中Shh、Smo、Gli-1 蛋白表达减少(P<0.05);与藏红花素H 组相比,藏红花素H+Shh 通路激活剂组SW620 细胞中Shh、Smo、Gli-1 蛋白表达增加(P<0.05)。见图6,表6。
表6 各组SW620细胞中Shh信号通路相关蛋白表达情况/± s
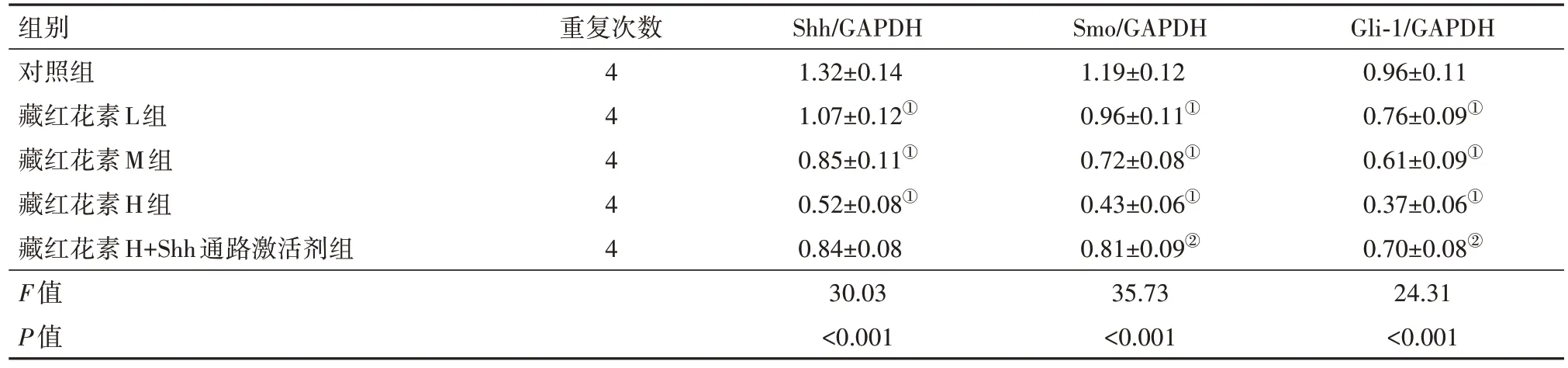
表6 各组SW620细胞中Shh信号通路相关蛋白表达情况/± s
注:Shh为音猬因子,Smo为平滑蛋白,Gli-1为神经胶质瘤相关癌基因-1,GAPDH为甘油醛-3-磷酸脱氢酶。①与对照组相比,P<0.05。②与藏红花素H组相比,P<0.05。
组别对照组藏红花素L组藏红花素M组藏红花素H组藏红花素H+Shh通路激活剂组F值P值Gli-1/GAPDH 0.96±0.11 0.76±0.09①0.61±0.09①0.37±0.06①0.70±0.08②24.31<0.001重复次数4 4 4 4 4 Shh/GAPDH 1.32±0.14 1.07±0.12①0.85±0.11①0.52±0.08①0.84±0.08 30.03<0.001 Smo/GAPDH 1.19±0.12 0.96±0.11①0.72±0.08①0.43±0.06①0.81±0.09②35.73<0.001

图6 蛋白质印迹法检测SW620细胞中Shh信号通路相关蛋白表达
3 讨论
目前,手术与化疗相结合是结直肠癌的主要治疗方法,但结直肠癌病人接受该治疗方法后复发率仍在50%左右[11-12]。此外,传统细胞毒性化疗药物在杀灭肿瘤细胞的同时,对正常细胞也会产生严重不良反应[13]。因此,有必要开发新型抑制结直肠癌进展的药物。
天然化合物因其副作用小、成本低的优势而成为肿瘤治疗领域的热点[14-15]。藏红花素为有前景的天然产物之一,近年来其抗癌活性受到广泛关注,可抑制胃癌、宫颈癌和结直肠癌等诸多癌症的恶性进展[16-18]。Teng 等[19]报道,藏红花素能明显抑制ApcMinC/Gpt 结直肠癌小鼠的肿瘤生长,改善结肠组织的病理改变,同时体外功能实验表明藏红花素可诱导结直肠癌细胞周期阻滞,提高细胞凋亡率。Güllü 等[20]报道藏红花素不仅可抑制结直肠癌细胞增殖,还可抑制其迁移。在本研究中,我们观察到SW620 细胞经不同剂量藏红花素处理后,细胞活力下降,克隆形成数、划痕面积愈合率、侵袭数均减少,凋亡率增加,且存在剂量-效应关系,表明藏红花素能够抑制SW620 细胞增殖、迁移和侵袭,促进其凋亡,与既往研究一致。
Shh 信号通路是调控肿瘤细胞恶性生物学行为的重要通路,激活Shh 信号通路可促进结肠癌细胞上皮间质转化,抑制Shh 信号通路可抑制结肠癌细胞的增殖、转移和侵袭[21-22]。Shh信号通路由Shh、碎片蛋白(Patched,Ptch)、Smo 和Gli 等蛋白构成,Gli为该通路的下游转录因子,当Shh 信号通路处于静息状态时,Ptch 与Smo结合以抑制Smo的活性,从而抑制Gli 激活;当Shh 信号激活时,Shh 与Ptch 结合,改变Ptch 的空间构象,解除Ptch 对Smo 的抑制作用,使Smo得到解离,进而激活Gli,调控肿瘤细胞生长、转移、凋亡和新血管形成[23-24]。Purmorphamine为Shh 信号通路的特异性激活剂,其可直接结合并激活该通路中的Smo 蛋白,进而激活下游靶基因转录[25]。在本研究中,使用Purmorphamine 激活Shh 通路后,SW620 细胞的增殖、迁移和侵袭能力均升高,细胞凋亡率降低,表明激活Shh 信号通路可促进SW620 细胞恶性表型。为了探究藏红花素抑制SW620细胞恶性生物学行为是否与抑制Shh信号通路有关,我们首先检测了经不同剂量藏红花素处理后SW620 细胞中Shh 信号通路相关蛋白表达变化,结果发现,Shh、Smo、Gli-1 蛋白表达均减少,且经40 mg/L 藏红花素处理后减少更明显。鉴于40 mg/L 的藏红花素对结肠癌的抑制作用优于10、20 mg/L 藏红花素,所以选择此浓度进行机制探讨。我们在40 mg/L 藏红花素处理的基础上增加Shh 通路激活剂Purmorphamine处理,结果发现,SW620细胞增殖、迁移、侵袭能力增强,凋亡率减少。这两部分结果共同表明藏红花素抑制SW620 细胞恶性生物学行为与抑制Shh信号通路有关。
综上所述,藏红花素可抑制SW620 细胞增殖、迁移和侵袭,促进其凋亡,可能与抑制Shh信号通路有关。本研究可望为藏红花素的抗结直肠癌应用提供一定的理论依据。在本研究所选剂量内,藏红花素的抗癌活性存在剂量依赖性,后续会增加藏红花素的干预剂量探究藏红花素的毒性以及更高的剂量是否活性更强。此外,在未来的研究中会构建裸鼠移植瘤模型进一步验证藏红花素的作用机制。

