类固醇受体辅活化子-3对严重烧伤小鼠肠黏膜屏障功能损伤的影响
杨宇,易庆军,李军,张永洪,文婷婷
作者单位:电子科技大学医学院附属绵阳医院、绵阳市中心医院,a麻醉科,b儿科,四川 绵阳 621000
重度烧伤不仅会对皮肤和皮下软组织造成大面积损伤,还会因缺血、缺氧、炎症等对多个器官造成损害,而肠道是烧伤后最易受到损伤的器官之一[1]。严重烧伤后,全身血液灌注重新分布,肠道缺血缺氧,肠黏膜上皮屏障破坏,肠道细菌易位,内毒素进入血液,可导致肠道内毒素血症,甚至败血症和多器官功能障碍[2-3]。因此,保护肠黏膜屏障功能可能是提高严重烧伤后存活率的有效方法。
类固醇受体辅活化子-3(steroid receptor coactivator-3, SRC-3)是一种转录共激活因子,SRC-3在肠道稳态中具有重要作用。据报道,SRC-3 可通过募集中性粒细胞来增强宿主对肠道细菌的防御[4];并且SRC-3 可能与严重烧伤后T 淋巴细胞免疫功能抑制有关[5]。此外,SRC-3 可以通过抑制炎症和促进结肠杯状细胞分化和成熟,改善溃疡性结肠炎[6]。然而,SRC-3 在严重烧伤后肠黏膜屏障功能损伤中的生物学作用仍未可知。黏液分泌不足和黏液成分变化引起的肠道黏液层损伤是引起肠道损伤的始发因素之一[7]。黏液由杯状细胞分泌,可起到阻滞剂的作用,防止细菌、毒素与肠上皮接触[8]。因此,本研究2022 年1—4 月从肠道黏液合成和分泌的角度探讨SRC-3在严重烧伤后肠黏膜屏障功能损伤中的作用。
1 材料与方法
1.1 动物SPF级雌性SRC-3基因敲除(SRC-3-/-)小鼠和野生型(SRC-3+/+)小鼠各36 只,10~12 周龄,体质量范围为18~23 g,由美国贝勒医学院分子和细胞生物学实验室提供。在实验开始前将动物在温度22~25 ℃、湿度60%~65%、12 h 光/暗循环的无病原体环境中适应1周。所有的实验方案均符合动物护理和一般动物实验伦理学原则。
1.2 主要试剂及仪器荧光素异硫氰酸酯-葡聚糖(FITC-dextran)(60842-46-8)购自美国MedChemExpress公司;小鼠内毒素(endotoxin, ET)(ml002005)、二胺氧化酶(diamine oxidase, DAO)(ml002199)、白细胞介素6(interleukin 6, IL-6)(ml063159)、肿瘤坏死因子 α(tumor necrosis factor α, TNF- α)(ml002095)ELISA 检测试剂盒购自上海酶联生物科技有限公司;苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒(G1120)、阿尔新蓝-过碘酸-希夫(Alcian Blue Periodic acid Schiff, AB-PAS)染色试剂盒(G1285)购自北京Solarbio 公司;兔抗小鼠黏蛋白2(mucin2, Muc2)抗体(ab272692)、IL-6 抗体(ab208113)、TNF-α 抗体(ab183218)购自英国Abcam 公司;SRC-3(#2126)购自美国Cell Signaling Technology公司。iMark680多功能酶标仪(美国Bio-Rad公司);BX53光学显微镜(日本Olympus公司)。
1.3 模型的建立将SRC-3小鼠(n=36)作为实验-/-组,SRC-3+/+小鼠(n=36)作为对照组。所有小鼠均采用40 mg/kg 戊巴比妥钠腹腔注射麻醉,然后使用电动推剪去除背毛。对照组和实验组小鼠剃毛并固定相当于体表总面积(total body surface area,TBSA)30%的面积后,将其置于100 ℃水中8 s 诱导建立30% TBSA Ⅲ度烧伤模型[9]。烧伤后,立即腹腔注射林格氏液(50 mL/kg)进行复苏,皮下注射丁丙诺啡(1 mg/kg)镇痛。
1.4 指标检测
1.4.1FITC-dextran 灌胃检测肠道通透性 在烧伤后第1、3、5 天时,每组采用随机数字表法选择6 只小鼠,以440 mg/kg 的剂量灌胃FITC-dextran。4 h后,取血,静置30 min 后离心分离血清。通过荧光分光光度法(激发:480 nm,发射:520 nm)测量血清中的荧光强度。然后根据标准曲线计算血清FITCdextran浓度,评估肠道通透性。
1.4.2ELISA 法检测血清TNF-α、IL-6 水平和血浆DAO 活性以及ET 水平 在烧伤后的不同时间点,每组采用随机数字表法选择6 只小鼠,取血并分离血清,通过ELISA测量血清TNF-α和IL-6水平;取部分血样放入普通的肝素抗凝管中,静置后离心,分离血浆,检测血浆中DAO 活性;另取部分血样放入无热原的ET测定专用管中,静置后离心,分离血浆,检测血浆中ET水平。
1.4.3HE 和AB-PAS 染色评估肠黏膜损伤和杯状细胞黏液分泌情况 取血后,从小鼠身上采集回肠组织样本(长5 cm)并固定在中性福尔马林溶液(pH 7.4)中。然后石蜡包埋、制备连续切片(5 μm厚)。然后将切片脱蜡并用HE 或AB-PAS 染色试剂盒染色。在光学显微镜下观察并拍照。HE 染色观察肠黏膜损伤,评分标准如下[7]:绒毛正常,0 分;绒毛顶部存在囊性空间,毛细血管充血,1 分;绒毛顶端上皮下间质增大,中度内皮水肿,2 分;固有层明显水肿,上皮细胞变性坏死,绒毛尖端脱落,3 分;上皮细胞层变性、坏死、脱落、部分绒毛脱落、裸固有层、毛细血管扩张、充血,4 分;绒毛脱落、固有层崩解、出血、溃烂,5 分。AB-PAS 染色评估杯状细胞黏液分泌情况(可反映杯状细胞分化成熟情况),计数染成蓝色和紫红色阳性杯状细胞(AB+/PAS+细胞)。AB 将酸性黏多糖染成蓝色,PAS将中性黏多糖染成紫红色。
1.4.4免疫组织化学(immunohistochemistry, IHC)染色检测Muc2 的表达 取肠组织石蜡切片,经过脱蜡、水化、抗原修复后,与3%过氧化氢(H2O2)一起孵育以灭活内源性过氧化物酶活性。切片在室温下用3%牛血清白蛋白(BSA)封闭1 h,在4 ℃下与一抗Muc2(1∶100)孵育过夜。随后,将切片用PBS 洗涤,并在室温下与二抗(山羊抗兔,1∶100)孵育1 h。DAB 显色,苏木精复染细胞核,光学显微镜下观察肠组织Muc2 阳性表达,每张切片采用随机数字表法选择3个视野,用Image Pro Plus 6.0计算平均光密度(mean optical density, MOD)。
1.4.5蛋白质印迹法检测肠黏膜中SRC-3、Muc2、IL-6 和TNF-α 蛋白表达 用含有蛋白酶抑制剂的RIPA 裂解缓冲液从肠黏膜中提取总蛋白。通过SDS-PAGE 凝胶分离等量的蛋白质提取物,并转移到聚偏二氟乙烯(PVDF)膜。将膜用5%脱脂牛奶封闭后,在4 ℃下与一抗SRC-3(1∶1 000)、Muc2(1∶1 000)、IL-6(1∶1 000)、TNF-α(1∶1 000)和GAPDH(1∶5 000)孵育过夜。然后,与相应的二抗(1∶5 000)一起孵育1 h。增强化学发光底物(ECL)显色,用Image J软件分析条带灰度值,并以GAPDH 为内参蛋白,计算目的蛋白的相对表达。
1.5 统计学方法采用GraphPad Prism 8.0 软件进行统计分析,计量资料以xˉ±s表示。两组数据比较采用独立样本t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 SRC-3 在烧伤小鼠中的表达变化与未烧伤SRC-3+/+小鼠相比,在烧伤后第1、3、5 天,从SRC-3+/+小鼠肠黏膜组织裂解物中检测到SRC-3蛋白表达呈降低趋势;在SRC-3-/-小鼠的肠黏膜中未检测到SRC-3蛋白。见图1。
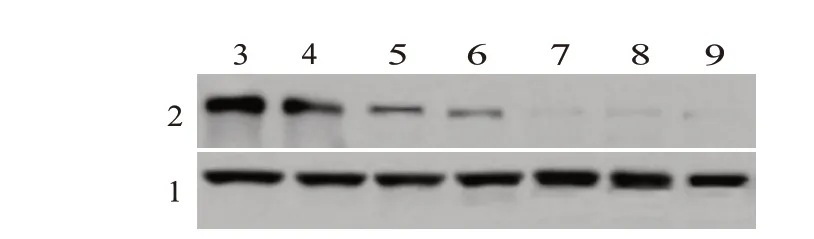
图1 烧伤小鼠肠黏膜中SRC-3蛋白表达
2.2 SRC-3 缺失对烧伤小鼠肠道通透性的影响在烧伤后第1、3、5 天时,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠血清FITC-dextran 浓度显著升高(P<0.05)。见表1。
表1 两组小鼠血清荧光素异硫氰酸酯-葡聚糖(FITC-dextran)浓度比较/± s

表1 两组小鼠血清荧光素异硫氰酸酯-葡聚糖(FITC-dextran)浓度比较/± s
组别对照组实验组t值P值鼠数6 6 FITC-dextran(μg/L)第1天685.14±79.36 1 156.21±107.65 8.63<0.001第3天743.72±82.29 1 425.81±115.36 11.79<0.001第5天824.35±85.44 1 613.27±120.94 13.05<0.001
2.3 SRC-3 缺失对烧伤小鼠血浆DAO 活性和ET水平的影响在烧伤后第1、3、5 天时,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠血浆DAO活性和ET水平显著升高(P<0.05)。见表2。
表2 两组小鼠血浆二胺氧化酶(DAO)活性和内毒素(ET)水平比较/± s
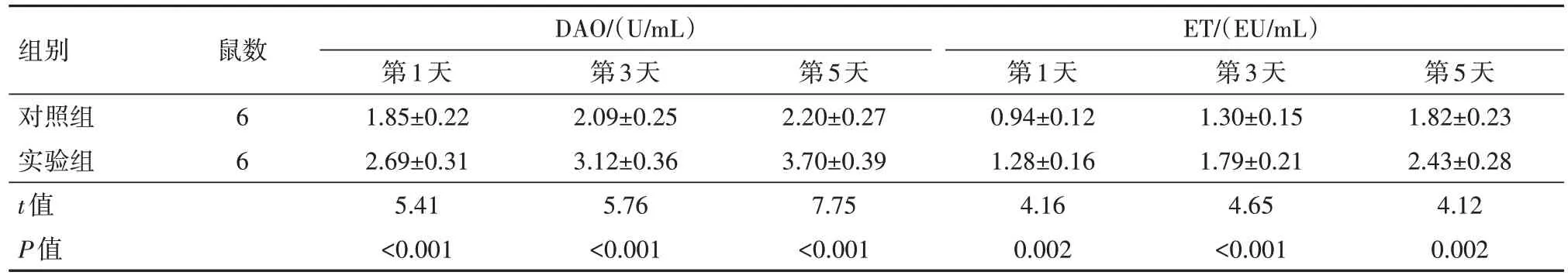
表2 两组小鼠血浆二胺氧化酶(DAO)活性和内毒素(ET)水平比较/± s
组别对照组实验组t值P值鼠数DAO/(U/mL)ET/(EU/mL)6 6第1天1.85±0.22 2.69±0.31 5.41<0.001第3天2.09±0.25 3.12±0.36 5.76<0.001第5天2.20±0.27 3.70±0.39 7.75<0.001第1天0.94±0.12 1.28±0.16 4.16 0.002第3天1.30±0.15 1.79±0.21 4.65<0.001第5天1.82±0.23 2.43±0.28 4.12 0.002
2.4 SRC-3 缺失对烧伤小鼠肠黏膜形态学的影响HE 染色结果显示,对照组SRC-3+/+小鼠在烧伤后第3、5 天肠黏膜出现明显损伤,主要表现为绒毛肿胀、黏膜充血水肿、毛细血管充血、炎症细胞浸润。与对照组相比,实验组SRC-3-/-小鼠在烧伤后第1、3、5天肠黏膜病理损伤程度加重,烧伤后第1天肠黏膜水肿、毛细血管充血、绒毛缩短,烧伤后第3、5天绒毛破裂、坏死、脱落、炎症细胞浸润、黏膜下充血、水肿、固有层剥落、绒毛紊乱萎缩,甚至形成浅表溃疡,肠黏膜损伤评分显著升高(P<0.05)。见图2,表3。
表3 两组小鼠肠黏膜损伤评分比较/± s
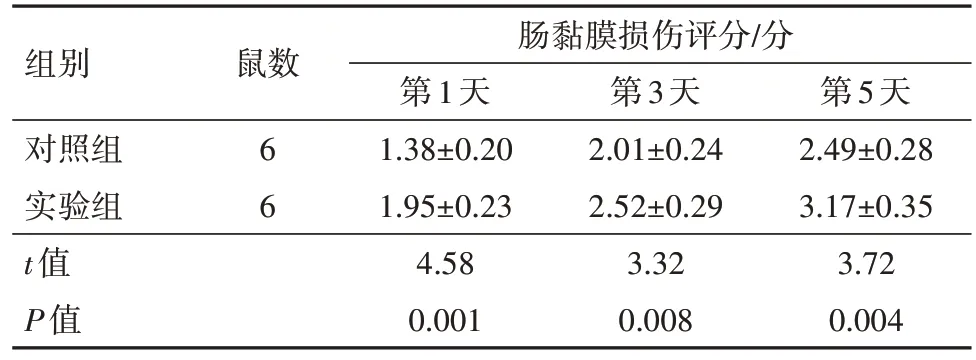
表3 两组小鼠肠黏膜损伤评分比较/± s
组别对照组实验组t值P值鼠数6 6肠黏膜损伤评分/分第1天1.38±0.20 1.95±0.23 4.58 0.001第3天2.01±0.24 2.52±0.29 3.32 0.008第5天2.49±0.28 3.17±0.35 3.72 0.004
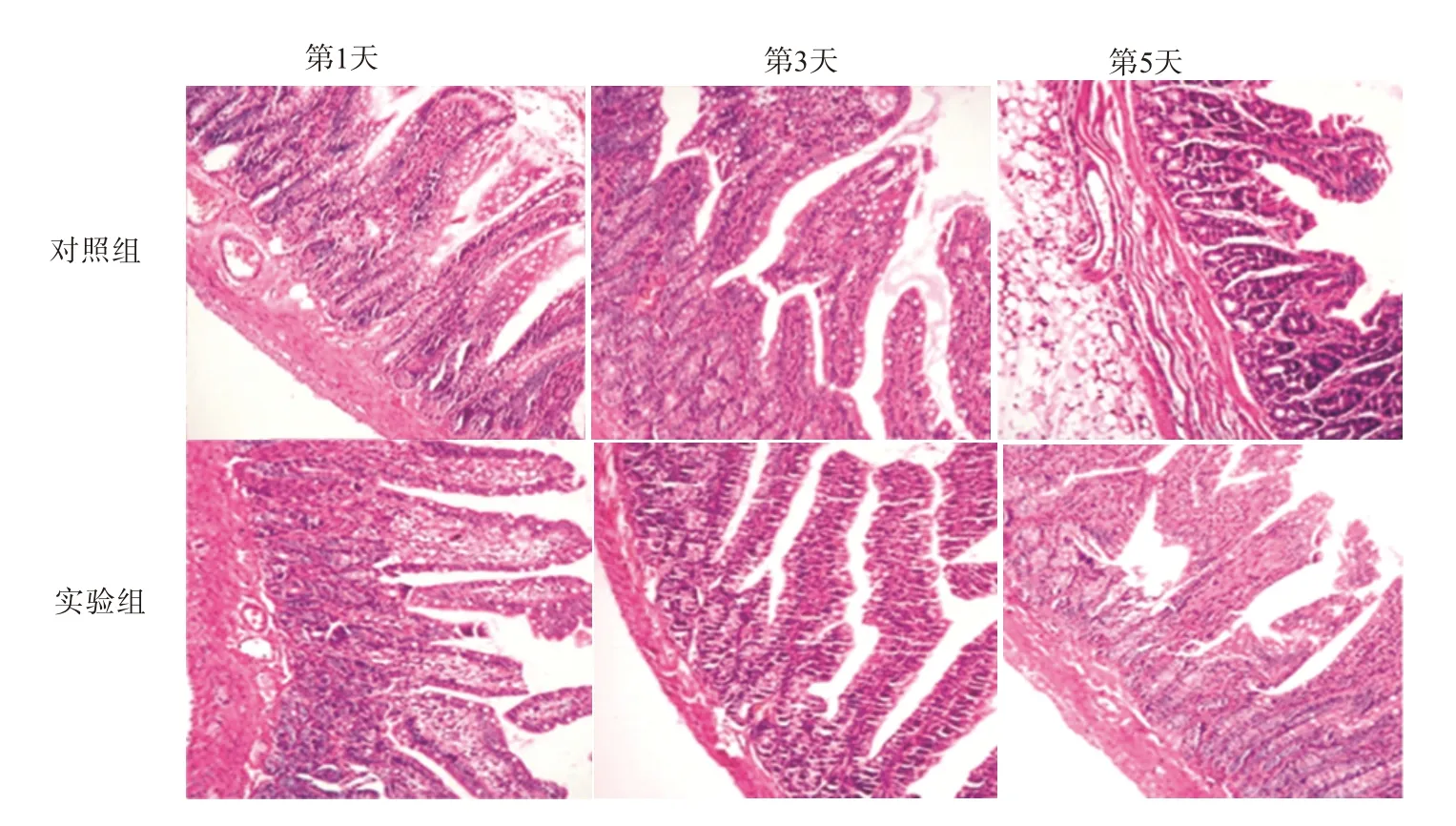
图2 两组小鼠肠黏膜形态学变化(HE染色×100)
2.5 SRC-3 缺失对烧伤小鼠肠杯状细胞分化成熟的影响AB-PAS 染色结果显示,在烧伤后第1、3、5天,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠肠组织中AB+杯状细胞的丰度明显降低,PAS+杯状细胞数量显著增加(P<0.05)。见图3,表4。
表4 两组小鼠肠杯状细胞数量比较/± s
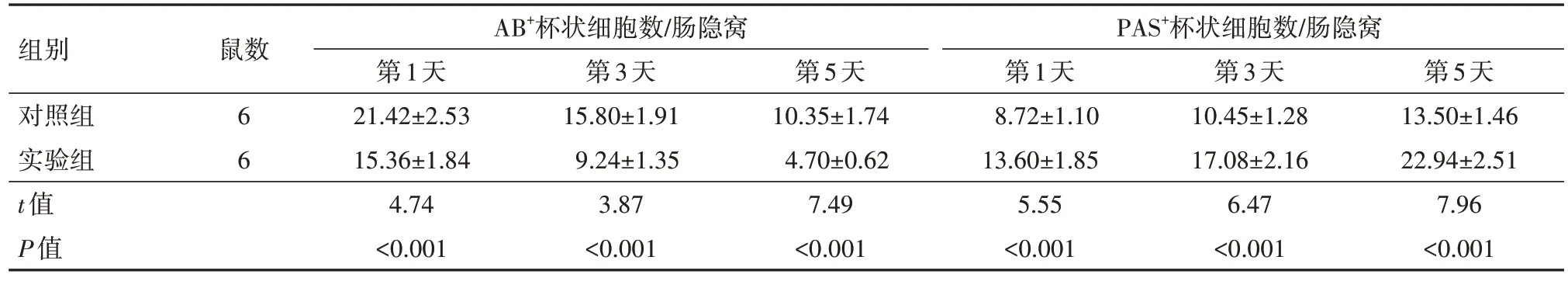
表4 两组小鼠肠杯状细胞数量比较/± s
组别对照组实验组t值P值鼠数AB+杯状细胞数/肠隐窝PAS+杯状细胞数/肠隐窝第3天15.80±1.91 9.24±1.35 3.87<0.001第1天21.42±2.53 15.36±1.84 4.74<0.001第5天10.35±1.74 4.70±0.62 7.49<0.001 6 6第1天8.72±1.10 13.60±1.85 5.55<0.001第3天10.45±1.28 17.08±2.16 6.47<0.001第5天13.50±1.46 22.94±2.51 7.96<0.001
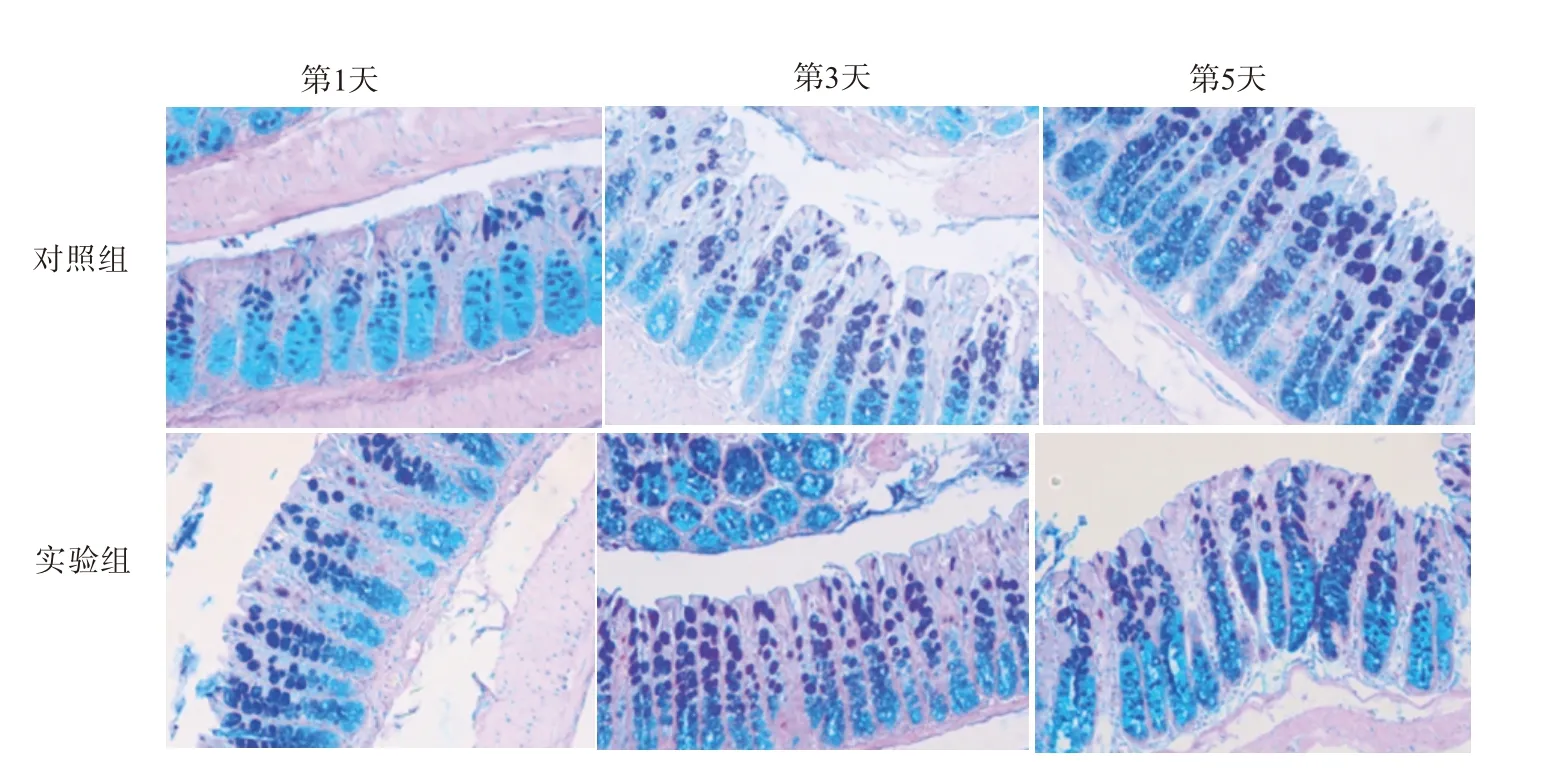
图3 两组小鼠肠杯状细胞分化成熟情况(AB-PAS染色×100)
2.6 SRC-3缺失对烧伤小鼠肠黏膜中Muc2表达的影响IHC 染色结果显示,在烧伤后第1、3、5 天,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠肠黏膜中Muc2 表达水平显著降低(P<0.05)。见图4,表5。
表5 两组小鼠肠黏膜中黏蛋白2(Muc2)表达水平比较/± s
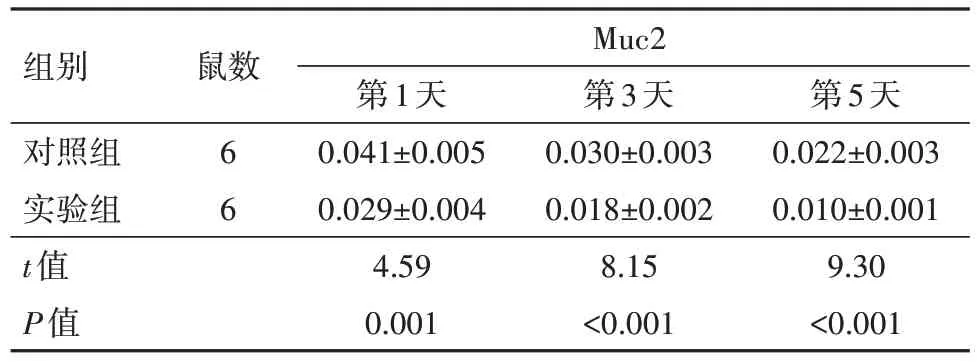
表5 两组小鼠肠黏膜中黏蛋白2(Muc2)表达水平比较/± s
组别对照组实验组t值P值鼠数Muc2 6 6第1天0.041±0.005 0.029±0.004 4.59 0.001第3天0.030±0.003 0.018±0.002 8.15<0.001第5天0.022±0.003 0.010±0.001 9.30<0.001
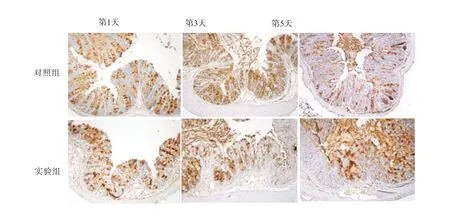
图4 两组小鼠肠黏膜中Muc2阳性表达情况(IHC染色×100)
2.7 SRC-3 缺失对烧伤小鼠血清IL-6 和TNF-α水平的影响在烧伤后第1、3、5 天,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠血清IL-6、TNF-α水平显著升高(P<0.05)。见表6。
表6 两组小鼠血清白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)比较/(ng/L,± s)
表6 两组小鼠血清白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)比较/(ng/L,± s)
组别对照组实验组t值P值鼠数IL-6 TNF-α第3天27.25±4.31 89.40±10.68 13.22<0.001第1天20.38±2.76 45.36±5.42 10.06<0.001第5天40.74±5.20 126.30±14.19 13.87<0.001 6 6第1天26.45±3.51 39.12±4.82 5.20<0.001第3天32.26±4.73 50.75±5.64 6.15<0.001第5天41.18±5.06 72.23±7.40 8.48<0.001
2.8 SRC-3 缺失对烧伤小鼠肠黏膜中Muc2、IL-6和TNF-α蛋白表达的影响在烧伤后第1、3、5 天,与对照组(SRC-3+/+小鼠)相比,实验组SRC-3-/-小鼠肠黏膜中Muc2 蛋白水平显著降低,IL-6、TNF-α 蛋白水平显著升高(P<0.05)。见图5、表7。
表7 两组小鼠肠黏膜中黏蛋白2(Muc2)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)蛋白水平比较/± s
表7 两组小鼠肠黏膜中黏蛋白2(Muc2)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)蛋白水平比较/± s
组别对照组实验组t值P值鼠数Muc2 IL-6/(ng/L)TNF-α/(ng/L)第1天0.65±0.08 0.46±0.06 4.65<0.001第3天0.47±0.06 0.28±0.04 6.45<0.001第5天0.35±0.05 0.16±0.03 7.98<0.001第1天0.30±0.04 0.48±0.06 6.11<0.001第3天0.41±0.05 0.60±0.08 4.93<0.001 6 6第5天0.50±0.07 0.79±0.09 6.23<0.001第1天0.25±0.03 0.40±0.06 5.48<0.001第3天0.32±0.05 0.71±0.08 10.13<0.001第5天0.41±0.06 0.83±0.10 8.82<0.001
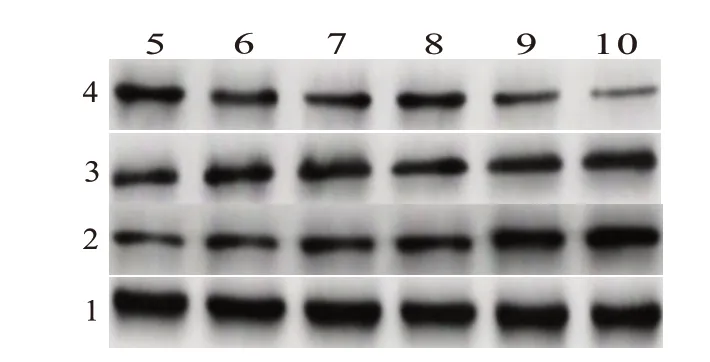
图5 两组小鼠肠黏膜中Muc2、IL-6和TNF-α蛋白表达
3 讨论
肠道对缺血、缺氧和炎症非常敏感,严重烧伤会降低肠道血液灌注,导致肠黏膜结构和功能受损,使肠道屏障功能减弱,进而引发严重的全身炎症反应,从而导致多器官损伤[1]。肠道屏障包括黏液层的化学屏障、上皮细胞层的机械屏障和固有层的免疫屏障[10]。肠黏膜是负责食物消化吸收的主要部位,其屏障功能也是维持机体环境稳态的核心要素。肠黏膜的完整性是反映肠屏障功能的重要指标[11]。SRC-3 是一种多功能蛋白,在调节细菌脂多糖诱导的炎症[12]和肠道稳态[4,6]中起重要作用。已有研究证实,敲除SRC-3 基因可能在严重烧伤后增加机体对病原微生物的易感性[4]。在本研究中,为了确定SRC-3 在烧伤中的功能,检查了不同烧伤阶段小鼠肠黏膜中SRC-3的表达。笔者发现与未烧伤SRC-3+/+小鼠相比,在烧伤后第1、3、5 天,SRC-3+/+小鼠肠黏膜中SRC-3 蛋白表达逐渐降低;而在SRC-3-/-小鼠的肠黏膜中未检测到SRC-3 蛋白。此外,与SRC-3+/+小鼠相比,SRC-3-/-小鼠在烧伤后观察到更严重的肠黏膜屏障功能障碍,并产生更多的促炎细胞因子(IL-6、TNF-α)。因此,SRC-3 对烧伤诱导的肠黏膜屏障功能可能具有重要保护作用。
烧伤后肠道屏障功能受损可促使细菌和毒素易位,这种易位可引发肠道感染和高肠道代谢,导致预后不良[13]。ET、DAO 是肠道损伤的敏感指标,肠道损伤后血浆ET 水平、DAO 活性显著升高[14]。在本研究中,在烧伤后第1 天至第5 天,SRC-3-/-小鼠的肠道通透性明显高于SRC-3+/+小鼠,同时血浆ET水平、DAO 活性均明显升高。用HE 染色测定肠黏膜损伤进一步证实了此结果,烧伤后SRC-3-/-小鼠肠黏膜充血水肿,黏膜剥脱、溃烂程度较SRC-3+/+小鼠加重。表明严重烧伤后SRC-3的缺失使肠组织结构受到明显影响,加重了肠道屏障功能损伤。
肠黏液屏障是肠道屏障系统的重要组成部分,由肠黏液组成。肠黏液由杯状细胞分泌,在维持肠黏膜结构和功能中的作用越来越受到重视[15]。未成熟的杯状细胞主要分泌中性黏液,随着不断分化,唾液酸含量不断增加,酸性黏液含量是杯状细胞成熟的重要指标[7]。本研究发现,烧伤后SRC-3-/-小鼠酸性黏液的分泌较SRC-3+/+小鼠显著减少,中性黏液的分泌增加。Muc2 免疫组化染色和蛋白免疫印迹结果显示,肠道黏液的核心成分黏蛋白Muc2在SRC-3-/-小鼠中的表达水平显著低于SRC-3+/+小鼠。肠黏液层由大约30种核心蛋白组成,包括黏蛋白、抗菌肽和分泌的免疫球蛋白A。其中,由肠杯状细胞在上皮细胞层合成的Muc2 是最重要的成分[16]。Muc2 的表达和分泌不足,则Muc2 黏液屏障的内层会逐渐变薄并变得可穿透。这时,肠道细菌可以侵入黏液层,与肠上皮细胞层接触,诱发肠道炎症甚至癌变[17-18]。IL-6、TNF-α 作为促炎递质,在烧伤中广泛释放,已被报道与烧伤患者肠道屏障功能损伤有关[19]。Chen 等[6]的研究显示,在溃疡性结肠炎小鼠中,SRC-3 的缺失减少了Muc2 阳性结肠杯状细胞数量,同时促炎细胞因子的产生增加。在本研究中可观察到烧伤后SRC-3-/-小鼠血清和肠黏膜中IL-6、TNF-α 水平较SRC-3+/+小鼠显著升高,与以往的研究结果一致。表明SRC-3的缺失严重损害了杯状细胞的分化和成熟,可能是烧伤诱发肠黏膜屏障功能障碍的病因之一。提示,SRC-3 可以减少烧伤对杯状细胞的损伤,促进杯状细胞的分化和成熟。
综上所述,SRC-3 缺失可以在严重烧伤后损害杯状细胞的分化成熟,减少肠黏液的合成与分泌,加重肠黏膜屏障功能障碍。本研究表明SRC-3可能是肠黏膜屏障功能的主要调节因子,在保护宿主免受细菌感染方面发挥着重要作用。因此,如何在烧伤后维持SRC-3 的表达进而保护肠黏膜屏障功能,是未来研究的重点。此外,SRC-3 如何调控杯状细胞的分化成熟以及SRC-3基因的缺失是否会影响创伤小鼠的自愈能力仍有待探索。

