转录因子Stp1、Stp2在白念珠菌致病中的作用及其对SAP2的调控机制
虞岱瑶 冯文莉
(山西医科大学第二临床医学院皮肤性病科,太原 030001)
白念珠菌(Candidaalbicans)是人类最常见的真菌病原体之一[1],通常寄生于个体的皮肤和/或黏膜表面,免疫功能正常的机体很少出现念珠菌播散性疾病,但恶性肿瘤、器官移植、医疗器械植入和广谱抗生素的长期使用等,可增加真菌感染的易感性和发病率[2],如导致念珠菌血症,严重危害人们的健康[3]。目前,念珠菌病的治疗主要依靠抗真菌药物,但随着抗菌药物的广泛使用和白念珠菌生存环境的改变,白念珠菌的发病率和耐药性逐年增加,已成为临床治疗的一大难题[4]。 因此,探索白念珠菌的致病机制,寻找新的抗真菌药物靶点刻不容缓。本文旨在阐述和概括对转录因子Stp1和Stp2在白念珠菌致病机制中的研究进展,以便为白念珠菌的治疗提供新的理论基础和药物靶点。
1 概 述
1.1 Stp1
Stp1是一种非活性前体,是正确利用肽所必需的,在细胞外氨基酸存在的情况下被蛋白水解激活,但它对于氨基酸的分解代谢没有影响。Stp1控制非常有限的一组基因,包括多胺转运蛋白基因(OPT1、DUR35)、铁还原酶基因(CFL2)、金属蛋白酶基因(APE2)和核苷转运蛋白基因(NUP32)[5-6]。
在酵母细胞中转录因子Stp1参与调控氮源代谢,包括调控SPS氨基酸感应通路和雷帕霉素(rapamycin,RAPA)结合蛋白TOR通路,并且Stp1的水平同时会影响到这两条通路。在SPS氨基酸感应通路中,Stp1被SPS复合物[6]激活,这是一种由Ssy1、Ssy5和Ptr3组成的跨膜氨基酸传感器,通过对氨基末端结构域的蛋白水解切割导致转位[7]。由于白念珠菌具有Gln3和Gat1的同源物,因此和酿酒酵母一样,STP1的氮调节取决于GATA 因子Gln3和Gat1,它们对作为其氮源的硫酸铵的存在十分敏感,是在各种氮源上最佳生长所必需的。
胞外蛋白质分解代谢所需的编码蛋白基因的表达可被白念珠菌中经过加工的Stp1激活,包括分泌型天冬氨酸蛋白酶SAP2,这些酶可能通过降解组织屏障、促进黏附、消化宿主蛋白以供给营养以及破坏免疫球蛋白和补体蛋白等宿主防御系统,使真菌进入宿主致病,其中是最重要的毒力因子[8]。STP1同SAP2一样,均受到氮分解代谢物抑制的调节,SAP2的氮分解代谢抑制是通过调节STP1的表达来介导的,最终造成白念珠菌的毒力致病[9]。此外,Stp1可在氮源的诱导下发生自噬,造成的SAP2高表达,促进白念珠菌生物膜的形成,参与调控对宿主的致病。
1.2 Stp2
转录因子Stp2能激活氨基酸渗透酶基因(AAP)的表达,当氨基酸以低浓度存在时,Stp2是唯一被加工的因子,是环境碱化和菌丝生长所必需的。Stp2具有更广泛的调节子,部分依赖于Ssy1氨基酸传感器(氨基酸摄取和分解代谢),部分依赖于Ssy1(与丝状生长相关的基因,包括调控因子UME6和SFL2)[5-6]。
在白念珠菌中,Stp2是氨基酸作为碳源的利用和分解代谢以及由此产生的氨排出所必需的,SPS系统调节Stp2负调控域的蛋白水解切割,Stp2的Ssy5依赖性处理发生在SPS传感器信号传导的较低水平,缺失氨基末端核排斥结构域的STP2基因可以抑制SPS突变体的生长和pH中和缺陷[10]。
此外,Stp2对白念珠菌生物膜的形成很重要,它有助于黏附和诱导形态发生,并介导成熟生物膜中的营养适应和细胞寿命。在生物膜发育的过程中,Stp2调节黏附和胚管形成,对生物膜的启动至关重要[11]。STP2的缺失使得由饥饿诱导的菌丝形态转变更快,同时还增加了RAPA敏感性,因此Stp2是黏附非生物表面所必需的[12]。
1.3 Sap2
白念珠菌能分泌多种水解酶,包括能消化细胞外蛋白的分泌型天冬氨酸蛋白酶(Saps)。Saps由10个相关基因家族(SAP1-SAP10)编码。SAP活性产物主要是寡肽,它被一个由8个成员组成的基因家族(OPT1-OPT8)编码的寡肽转运体家族(Opts)转运到细胞中,SAP基因根据生长条件受到差异性调节,并且在优质氮源和高浓度氨基酸存在的情况下被抑制[13]。Saps在促进致病性生长方面有多种作用,Saps催化的宿主细胞膜蛋白水解促进黏附和组织侵袭,它还参与中和宿主防御系统的细胞和分子,从而使白念珠菌细胞能够避免或抵抗宿主攻击[14]。
其中,Sap2是关键毒力因子,在酸性条件下高度表达,可通过降解黏膜表面的大分子蛋白为自身生长提供营养,同时增加白念珠菌黏附和侵入宿主的能力。当前,Sap2已被广泛研究,缺乏这种蛋白质的念珠菌细胞表现出感染哺乳动物宿主的能力降低。它是在蛋白质作为唯一氮源的情况下在体外培养时最丰富的分泌蛋白质,使用蛋白酶抑制剂胃酶抑素A的研究表明[15],在白念珠菌中的表达也通过正反馈机制调节,Sap2的整体结构符合以胃蛋白酶为代表的经典天冬氨酸蛋白酶折叠。
此外,Sap2具有广泛的底物特异性,它可以切割的蛋白质种类繁多,这种广泛的底物特异性在念珠菌的发病机制中起到了重要的作用,Sap2会降解许多人类蛋白质,包括黏蛋白、细胞外基质蛋白、许多免疫系统分子、内皮细胞蛋白以及凝血因子,这不仅可以为生长提供必需的氮,而且还可以通过去除宿主屏障来增强对宿主组织的附着、定植和渗透,大大增强了白念珠菌的致病能力[16-17]。
2 与Stp1相关的表达调控
2.1 SPS氨基酸感应通路调控Stp1与Stp2
酿酒酵母能够通过质膜中的传感器评估胞外营养物的可用性,这些营养吸收系统的诱导表达需要一个质膜定位的传感器复合物,称为SPS传感器。该系统由SSY1、PTR3和SSY5三种基因产物组成。Ssy1是一种氨基酸转运蛋白同源物,可感知细胞外环境中的氨基酸,但不具有转运活性[18];Ptr3是一种外周膜相关蛋白,它介导酪蛋白激酶 I (CKI)与Ssy5(糜蛋白酶样丝氨酸内切蛋白酶)的相互作用[19],这种内切蛋白酶在抑制结构域中过度磷酸化,催化具有活性片段的蛋白水解释放;Ssy5切割两个转录因子Stp1和Stp2的核排斥域,促进它们移位到细胞核[20]。
SPS传感器作为配体激活的外部氨基酸受体,控制两个转录因子Stp1和Stp2的核定位。Stp1和Stp2以严格依赖SPS传感器的方式进行,Stp1和Stp2的全长形式由于其N端末端调节域中存在细胞质保留信号而定位于胞浆,这些保留信号可以有效阻止未处理的全长形式进入细胞核。在细胞外氨基酸充足时,Stp1通过内蛋白溶解去除N端细胞质保留基序激活,其由Ssy5的蛋白水解活性介导,使其进入细胞核并激活AAP的转录[9]。而这些转录因子与氨基酸控制基因启动子中不同的上游激活序列 (UASaa) 结合,Stp1在细胞核诱导Sap和寡肽转运蛋白OPT1和OPT3的表达,加工后的Stp1与蛋白质利用所需基因的启动子(如SAP2、OPT1)中的UASaa1结合,而加工后的Stp2与UASaa2结合,诱导AAP的表达。此外,SPS传感器正确诱导Stp1和Stp2所需的另一个成分是完整的内质网(endoplasmic reticulum,ER)膜成分Shr3。Shr3是SPS传感途径的最上游成分,它是Aaps和Ssy1正确定位到白念珠菌细胞质膜所必需的,缺少SHR3的突变体既不能感知也不能摄取氨基酸[21]。
2.2 Stp1调控TOR通路
Stp1是SPS氨基酸传感途径的关键效应因子,它的降解受酵母中RAPA活性的控制。SPS传感器系统负责传感细胞外氨基酸,而TOR途径主要参与传感细胞内氨基酸[22]。TOR靶信号通路在真核细胞的生长调控中起着至关重要的作用,胞外环境中的氮源可以激活TOR信号通路,TOR激酶编码磷脂酰肌醇激酶相关激酶家族,并作为反映真核细胞生长的关键调节剂[23]。与其他真核生物一样,酵母细胞中含有两种TOR复合物,称为TOR复合物1(TORC1)和TOR复合物2(TORC2),TORC1介导营养信号传导,并对RAPA敏感[24]。而TORC2调节细胞代谢,包括脂肪生成和葡萄糖转运,对RAPA不敏感[25]。因此,Stp1的降解至少受到两种不同机制的调节:TORC1非依赖性泛素蛋白酶体途径和TORC1依赖性Rrd1-Sit4途径[26]。RAPA与酵母FKBP12同系物Fpr1形成复合物,并且这种RAPA-Fpr1复合物抑制TORC1活性,RAPA通过诱导氮分解代谢物抑制基因的转录[27]来灭活TORC1。胞外氨基酸是激活TOR信号通路的重要营养素,并且被SPS传感器所感知,来自SPS传感器的氨基酸信号被传递到细胞内部,并调节参与氮吸收的许多基因的转录[28]。Andreasson等[29]的实验表明Stp1的处理与TORC1的活性无关,仅取决于细胞外氨基酸的存在。当TOR途径失活时,只有局限于细胞核中经过加工的Stp1容易降解。此外,由于RAPA处理或当氮素受到限制时,泛素-蛋白酶体途径会参与维持在正常条件下Stp1的稳态水平[30]。
Stp1依赖性氨基酸摄取与RAPA敏感的TOR信号通路密切相关。细胞外氨基酸是激活TOR途径的重要营养线索,并且Stp1通过介导从质膜到细胞核的氨基酸信号传导以摄取细胞外氨基酸,提示Stp1与TOR途径之间存在联系。Shin等[26]的实验表明,Stp1的表达水平影响细胞对RAPA敏感性,Stp1的过表达导致RAPA产生耐药性,而TORC1的失活导致Stp1以PP2A样磷酸酶Sit4依赖性方式降解[31]。Sit4是一种在酵母中发现的PP2A样磷酸酶,它除了负调控TOR途径外,在正常细胞生长中也有重要作用。Rrd1是哺乳动物磷酸酪氨酸磷酸酶激活剂(PTPA)的酵母同源物,是Sit4的激活剂。而PP2A(蛋白质磷酸酶2A型)是由TOR途径感知的细胞内氨基酸信号传导的主要效应子[32],对Stp1的降解起重要作用。Stp1是一种磷酸化蛋白,正常条件下,在所有野生型细胞中Rrd1和Sit4都是磷酸化状态。Rrd1-Sit4参与了RAPA处理过程中Stp1的去磷酸化,这可能是TORC1失活促进Stp1降解的先决条件[33-34]。
2.3 Stp1参与调控自噬
自噬是真核生物降解细胞物质的主要途径,通过在溶酶体或液泡室内的降解,促进真核生物大分子和细胞器的整体降解。在酿酒酵母的氮饥饿期间,自噬对于它的存活以及完成芽孢形成的分化过程至关重要[35]。研究表明,自噬在白念珠菌中保守存在[36],且影响白念珠菌的毒力[37]。在应激刺激或者氮饥饿等营养缺陷的状态下,Stp1诱导白念珠菌自噬。白念珠菌在处于内质网应激和氧化应激的条件下,可以通过增强自噬以减缓应激反应和增强菌体存活能力[38-39]。因此,自噬与白念珠菌的致病性和适应性息息相关。
在白念珠菌细胞中,液泡水解酶氨肽酶I (API)和α-甘露糖苷酶(AMS)通过CVT(cytoplasm-to-vacuole targeting)途径从细胞质传递到液泡。CVT途径和自噬途径在很大程度上依赖于相同的细胞机制,许多在自噬方面有缺陷的突变体也被阻断在CVT途径中[40]。在白念珠菌中,自噬主要是依靠氮饥饿应答[41],除此之外,还可以通过RAPA直接抑制保守的TORC1,诱导自噬[42]。研究表明[43],RAPA不能有效诱导STP1敲除菌株中自噬相关基因的表达,当Stp1转录因子缺失时,表现出对RAPA耐受,STP1敲除菌株发生自噬缺陷,自噬小体不能与液泡进行融合,说明转录因子Stp1可能通过调控CVT途径诱导细胞自噬。
与RAPA诱导自噬不同的是,在氮饥饿诱导的自噬中,TORC1没有直接被抑制,因为RAPA是TORC1的直接抑制剂。但相同的是,转录因子Stp1的缺失,都使自噬发生缺陷,从而增强了菌体在饥饿条件下的存活能力。因此无论是通过RAPA直接抑制TORC1发生自噬还是通过氮饥饿间接抑制TORC1发生自噬,都需要转录因子Stp1的参与[43]。
3 Stp1的氮源依赖性毒力以及与Sap2的关系
3.1 氮源的利用
在致病性白念珠菌中,氮源的利用率可以调节白念珠菌毒力表型,包括丝状生长和蛋白酶的分泌。铵渗透酶Mep2是一种胞质膜蛋白,介导优选氮源铵的摄取。它的表达由GATA转录因子Gat1和Gln3调节。在有限氮源的条件下,Mep2诱导从酵母到丝状生长的转换[44]。这些中枢调节因子也控制着Sap2的表达,当蛋白质是唯一可用的氮源时,该蛋白酶被诱导。在这些条件下,Gat1和Gln3上调STP1的表达,STP1编码一种蛋白水解激活的转录因子,反过来介导Sap2和蛋白质生长所需的几种寡肽转运蛋白的表达。通过这种方式,白念珠菌将不同毒力相关表型的表达整合到控制氮代谢的调节网络中[45]。见图1。
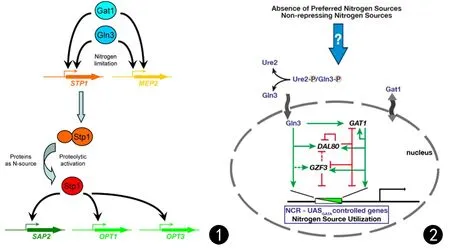
图1 蛋白酶分泌的调节。GATA转录因子Gat1和Gln3控制MEP2和的表达,在限制性氮的条件下,Gat1和Gln3可能通过直接与MEP2启动子结合来诱导MEP2的表达。相反,GATA因子对和OPT1和OPT3的调节是通过STP1的上调间接发生的。当蛋白质是唯一可用的氮源时,Stp1被蛋白水解激活[45] 图2 酵母中氮分解代谢物抑制 (NCR) 的示意图,Gln3和Gat1是NCR的两个阳性GATA效应子,通常在优选的氮富集条件下从细胞核中排除。核排斥认为是通过Gln3与Ure2蛋白之间的磷酸化相互作用而发生的[46]Fig.1 Regulation of protease secretion. Control of MEP2 and expression by the GATA transcription factors Gat1 and Gln3. Under limiting nitrogen conditions, Gat1 and Gln3 induce expression of the ammonium permease MEP2 presumably by directly binding to the MEP2 promoter. In contrast, regulation of the, OPT1 and OPT3 by the GATA factors occurs indirectly, via upregulation of the transcription factor STP1. Stp1 is proteolytically activated when proteins are the only available nitrogen source Fig.2 Schematic diagram of nitrogen catabolite repression (NCR) in yeast. Gln3 and Gat1 are two positive GATA effectors of NCR that are normallyexcluded from the nucleus under preferred nitrogen replete conditions. Nuclear exclusion is thought to occur via the interaction of Gln3 with the phosphorylated version of the Ure2 protein[46]
对氮源的利用控制着白念珠菌的不同表型特征,这些表型特征与白念珠菌的毒力有关,转录因子Gat1和Gln3对基因表达的适当调控对白念珠菌的致病性十分重要。
3.2 氮分解代谢物抑制(nitrogen catabolism repression,NCR)
除了感知细胞外氮源的利用率,酵母细胞还可以衡量内化氮源的质量,并作出适当的反应以调整新陈代谢。氮分解代谢物抑制 (NCR) 是一种超途径,当首选氮源可用时,它通过抑制利用次级氮源所需的基因来控制氮源利用[46]。
蛋白质作为一种替代或次要氮源,即当首选氮源充足,即使在蛋白质存在时,SAP和OPT基因的表达仍受到抑制,这种抑制是由于在高浓度的铵、谷氨酰胺或尿素存在下,导致STP1表达下调所引起的,STP1的强制表达消除了氮分解代谢对表达的抑制,并导致Sap2的分泌和胞外蛋白的降解[47]。因此,通过控制STP1的表达水平,间接调控因子Gat1和Gln3介导的Sap2的氮分解代谢抑制,并允许当蛋白质作为唯一可用的氮源时,Stp1诱导蛋白酶。转录因子Stp1受NCR的控制,在这些条件下不表达,这限制了Stp1依赖性分泌蛋白酶Sap2和寡肽转运蛋白的表达[48]。见图2。
4 结 语
综上所述,对于Stp1在白念珠菌中的研究目前集中于其调控SPS氨基酸感应通路和RAPA结合蛋白TOR通路、参与调控自噬以及毒力致病方面,其中Stp1诱导细胞发生自噬,造成高表达,进而影响细胞生物膜的形成,增强白念珠菌的致病力。在白念珠菌致病的过程中,白念珠菌生物膜以一种屏障形式导致了真菌耐药,白念珠菌生物膜是由细胞外基质(extracellular matrix,ECM)包裹酵母细胞、菌丝细胞和假菌丝细胞组成的致密的网状系统,呈有机的三维结构和广泛的空间不均一性[49],由于组织感染白念珠菌后会形成生物膜,使治疗难度增加,预后更差。但目前有关于Stp1影响生物膜形成的机制以及与Stp2之间的调控关系尚不清楚,因此,从疾病的预后以及治疗方面,今后可从Stp1诱导细胞自噬进而影响生物膜形成方面进行研究,Stp1有望成为白念珠菌感染性疾病治疗的新靶点。综上,转录因子Stp1对于白念珠菌的致病过程是十分重要的,但其具体耐药机制仍需进一步研究,Stp1、Stp2与Sap2和生物膜之间的联系仍待进一步明确。当前,随着白念珠菌的耐药性不断增加,对Stp1新靶点的研究已是目前的当务之急。

