心脏移植术后并发肺毛霉病5例治疗经验分析
梁可可 郭琳 王海彦 王刚 白玉林 杜鹏 蒋翠霞 杨斌 刘云霏
(1.郑州市第七人民医院重症医学科,郑州 450016;2.郑州市第七人民医院心脏移植中心,郑州 450016;3.郑州市第七人民医院检验科,郑州 450016)
毛霉病是一种比较少见的侵袭性真菌病,具有进展迅速、治疗周期长、死亡率高、花费高的特点,常见于合并有影响免疫系统功能疾病的患者中[1-2]。近年来随着实体器官移植的增多,其发病率也有所提高,多中心TRANSNET研究表明[3]在实体器官移植受者中毛霉病一年内发病率约0.07%,但目前国内心脏移植术后毛霉感染报道较少,本文回顾性总结分析于郑州市第七人民医院就诊的5例心脏移植术后合并肺毛霉病的临床资料,探讨诊断的治疗经过,以提高对本病的诊治能力。
1 病例资料
本中心自开展心脏移植以来,共诊断心脏移植术后侵袭性毛霉病5例,随访至2022年10月30日,其中4例死亡,1例存活,5例患者根据术前状态适量使用免疫诱导剂(巴利昔单抗+甲泼尼龙琥珀酸钠),术后均采用他克莫司(TAC)+吗替麦考酚酯(MMF)+甲泼尼龙免疫抑制治疗方案,在考虑诊断为真菌感染时5例患者均使用两性霉素B雾化辅助治疗,调整抗排斥方案:下调他克莫司及激素用量,维持他克莫司血药浓度4~6 ng/mL,并停用吗替麦考酚酯,给予丙种球蛋白增强被动免疫,现将5例患者诊疗过程归纳总结(见表1)。
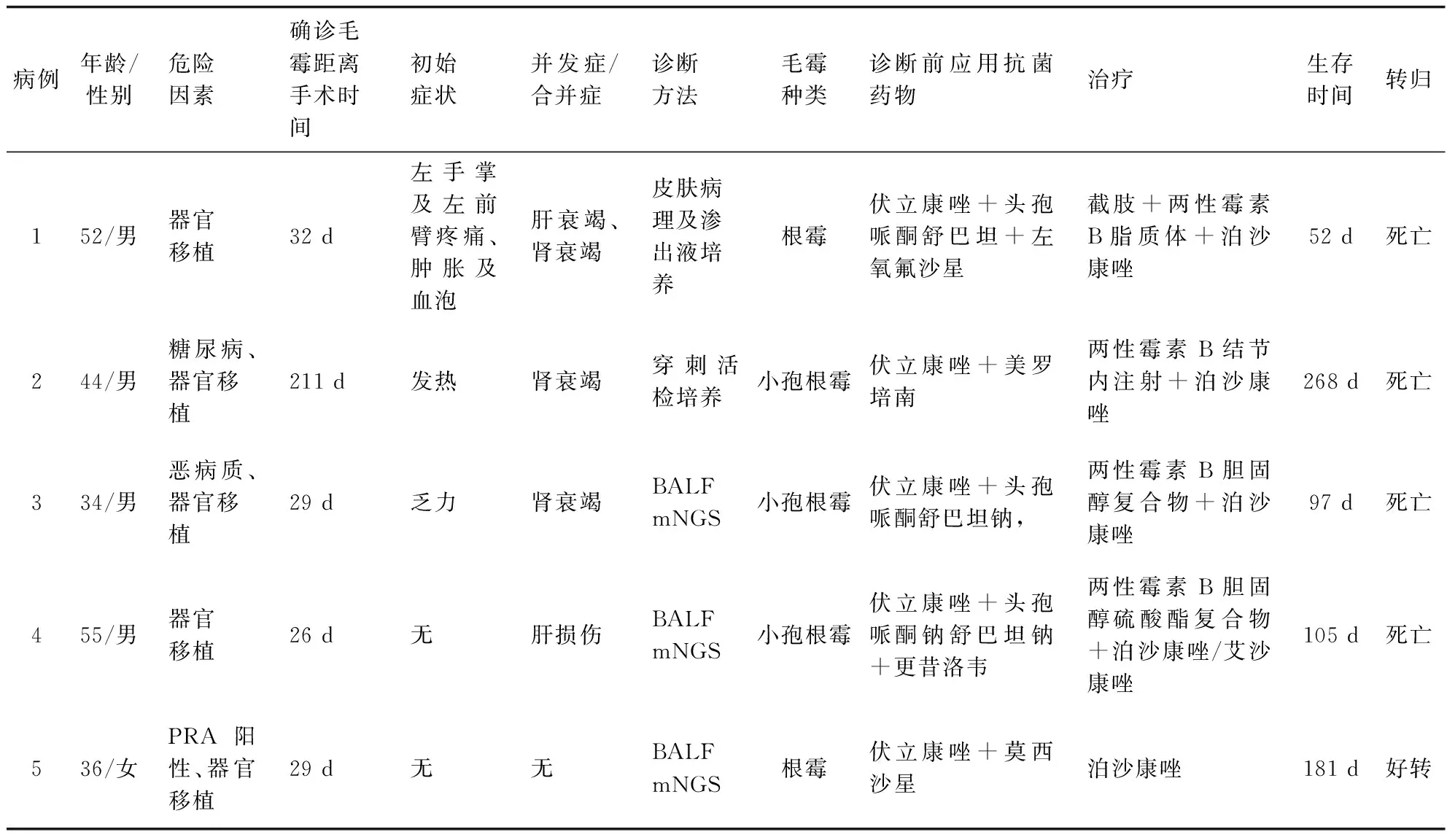
表1 患者临床资料Tab.1 Clinical data of the patients
病例1,男性,52岁,2019年1月16日以“扩张型心肌病、心力衰竭、心功能IV级、慢性肾功能不全”为诊断入院,入院后先后给予气管插管、主动脉内球囊反搏(intra-aotic balloon pump,IABP)辅助循环、连续肾脏替代治疗(continuous renal replacement therapy,CRRT),于2019年2月2日行心脏移植术,分别于术后2 d及4 d拔除气管插管及IABP,术后支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)先后培养出铜绿假单胞菌、白念珠菌,多次调整抗菌方案,术后17 d行胸部电子计算机断层扫描(computed tomography,CT)可见两肺多发斑片结节影(见图1A),后复查胸部CT可见结节逐渐增大,痰培养可见嗜麦芽窄食单胞菌, 抗感染方案调整为伏立康唑注射液+头孢哌酮舒巴坦+左氧氟沙星,术后32 d出现左手掌及左前臂疼痛、肿胀及血疱,取左手掌渗出液培养发现毛霉属生长(见图2),行胸部CT可见右肺结节较前继续增大并有新发结节(见图1B),调整抗真菌药物为两性霉素B脂质体联合泊沙康唑口服混悬液,并于术后35 d给予左前臂截肢手术,取坏死组织行病理检查,提示毛霉感染伴坏死(见图3),术后36 d出现肝肾功能损伤进一步加重,间断床旁血滤及血浆置换,术后52 d最终因重症肺炎,感染性休克死亡。
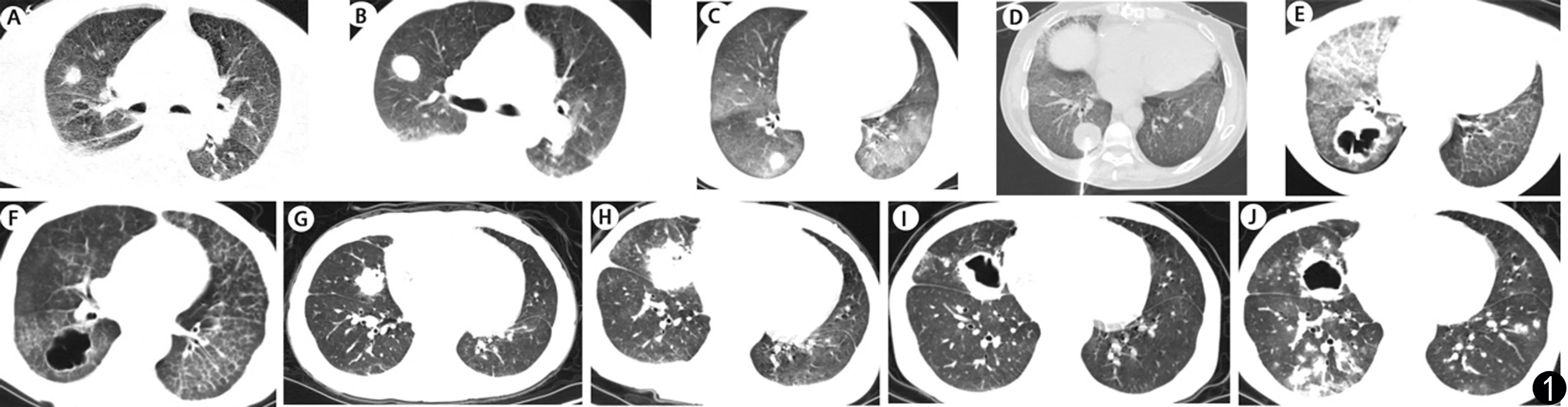
图1 病例1、病例2、病例3肺部CT变化:A.例1右肺可见结节;B.例1右肺结节较前明显增大;C.例2右肺下叶结节;D.例2右肺下叶结节在CT引导下穿刺;E.例2右肺下叶结节空洞形成;F.例2右肺下叶空洞壁较前变薄;G.例3右肺中叶可见结节;H.例3右肺中叶病灶较前增大;I.例3右肺中叶空洞形成;J.例3双肺多发结节,较前增大、增多Fig.1 CT changes in the lungs of case 1, case 2 and case 3:A. Case 1:right lung nodule; B. Case 1: right lung nodule is significantly larger than before; C. Case 2: right lower lobe nodule; D. Case 2: right lower lobe nodule puncture under CT guidance; E. Case 2: right lower lobe nodule cavity formation; F. Case 2: cavity wall in the right lower lobe of the lung becomes thinner than before; G. Case 3: right middle lobe nodule; H. Case 3: the lesion in the middle lobe of the right lung is larger than before; I. Case 3: caverns formed by nodules in the middle lobe of the right lung; J. Case 3: multiple nodules in both lungs, enlarged and increased compared to before
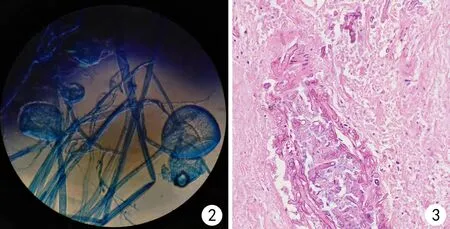
图2 病例1手掌渗出液真菌培养阳性,挑取菌落,棉蓝染色镜捡见孢子囊和匍匐菌丝,孢子囊呈球形、色深,菌丝较宽且无隔(10×40) 图3 左前臂坏死组织HE染色可见真皮下坏死灶内有粗大的毛霉菌丝,菌丝粗大无分隔(10×40)Fig.2 Case 1 showed positive fungal culture in the exudate of the palm. Colonies were selected and cotton blue staining was used to detect spore sacs and creeping hyphae. The spore sacs were spherical, dark colored, and the hyphae were wide and septal(10×40) Fig.3 HE staining of the necrotic tissue of left forearm showed that there were thick mucor hyphae in the necrotic area under the dermis, and the hyphae were thick without separation(10×40)
病例2,男性,44岁,2019年2月26日以“扩张型心肌病、心力衰竭、心功能IV级、心房纤颤、右肾积水、2型糖尿病、乙型病毒性肝炎”为诊断入院,于2019年3月11日行心脏移植术+IABP植入术,分别于术后2 d及4 d拔除气管插管及IABP,术后3 d痰涂片发现革兰阳性球菌、真菌孢子及菌丝,术后7 d右心功能不全尿量差给予间断床旁血滤,术后9 d根据痰培养抗感染方案调整为伏立康唑+更昔洛韦+哌拉西林他唑巴坦钠抗感染治疗,术后34 d行胸部CT可见双肺磨玻璃样改变,右肺下叶结节(见图1C),抗感染方案调整为伏立康唑注射液+美罗培南抗感染治疗,后复查肺部CT右下肺结节增大并出现液气平面,术后74 d复查胸部CT并再次于CT引导下行右肺下叶结节穿刺(见图1D),穿刺组织送病理未发现微生物,后给予伏立康唑联合抗真菌治疗,期间间断复查胸部CT,空洞较前变化不大,术后211 d复查胸部CT并行右肺下叶结节穿刺活检(见图1E),培养检出小孢根霉菌生长,给予两性霉素B结节内注射联合泊沙康唑口服混悬液应用,术后257 d行胸部CT可见双肺间质性改变较前好转,右肺下叶空洞壁较前变薄,体积减小(见图1F),但患者于术后268 d大咯血死亡。
病例3,男性,34岁,2021年12月14日以“心肌致密化不全、心力衰竭、心功能IV级、慢性肾功能不全CKD5期”为诊断入院,入院前曾长期卧床并进行CRRT,计划行心肾联合移植,术前因心衰加重,心源性休克行IABP,气管插管,动静脉体外膜肺氧合(venoarterial extracorporeal membrane oxygenation,VA-ECMO)辅助循环,术前复查BALF及血mNGS(metagenomic next-generation sequencing)均未检出明确病原菌,因患者病情危重暂未匹配到合适肾源于2021年12月25日先行心脏移植术,分别于术后2 d及3 d撤除VA-ECMO、拔除气管插管及IABP,术后间断CRRT,术后4 d痰培养提示白念珠菌,加用两性霉素B雾化治疗,术后8 d行纤维支气管镜可见大量黄黏痰,不易吸引,黏膜充血肿胀,考虑真菌感染可能,调整抗生素为伏立康唑+头孢哌酮舒巴坦钠,同时送检BALF及血液mNGS,血液mNGS中可见阴沟肠杆菌,疑似背景菌中可见小孢根霉,BALF mNGS中可见人类疱疹病毒病毒1型,疑似背景菌中未见根霉属,间断行纤维支气管镜吸痰,术后19 d行胸部CT可见右肺中叶结节(见图1G),继续给予伏立康唑抗真菌药物治疗,术后29 d送检血液mNGS可见巨细胞病毒,疑似背景菌中再次发现小孢根霉,复查胸部CT可见肺部结节较前进展(见图1H),再次送检BALF及血mNGS,并于 BALF mNGS中发现根霉属小孢根霉(相对丰度95.6%,序列数87),调整抗真菌药物为两性霉素B胆固醇硫酸酯复合物+泊沙康唑静脉应用。间断复查胸部CT可见右肺中叶及下叶病灶较前增大,空洞逐渐形成,57 d时可见空洞壁逐渐变薄(见图1I)。因患者肾衰竭,两性霉素B胆固醇硫酸酯复合物不可通过血透析清除,不良反应较大,治疗期间患者出现厌食、皮肤出现皮下出血点,营养状态差,于术后71 d不得不停用两性霉素B胆固醇硫酸酯复合物,调整泊沙康唑注射液为泊沙康唑肠溶片继续治疗,监测血药浓度,术后79 d出现咳嗽、咳血痰,伴周身疼痛,复查胸部CT可见右肺中叶、下叶空洞进一步增大,且双肺可见多发肺结节影,右肺为主,考虑感染播散,调整抗真菌药物为泊沙康唑注射液继续治疗,因症状改善不明显加用两性霉素B胆固醇硫酸酯复合物继续治疗,术后89 d复查胸部CT可见双肺多发软组织结节影,较前增大、增多(见图1J),感染进展迅速,间断咯血痰,术后97 d死亡。
病例4,男性,55岁,2022年2月10日以“扩张型心肌病、心力衰竭、心功能IV级、心律失常、心房纤颤”为诊断入院,术前因心源性休克、室颤行IABP辅助循环、气管插管,2022年3月12日行心脏移植术,术后1 d拔除气管插管及IABP,术后13 d血CMV-DNA定量阳性,肺部CT示双肺多发结节(见图4A),BALF mNGS提示屎肠球菌、黄曲霉及烟曲霉,抗感染方案调整为伏立康唑+头孢哌酮钠舒巴坦钠+更昔洛韦,术后26 d复查肺CT示右肺上叶及左肺上叶结节较前增大,左肺上叶空洞形成(见图4B),因不能排除毛霉感染,调整为两性霉素B胆固醇硫酸酯复合物抗真菌治疗,同时患者出现骨髓抑制,停用更昔洛韦,随后复查BALF mNGS发现根霉属小孢根霉(相对丰度89.2%,序列数272),同时合并有肺炎克雷伯菌(相对丰度5.2%,序列数438)及嗜肺军团菌(相对丰度0.5%%,序列数48)感染,因此抗感染方案调整为两性霉素B胆固醇硫酸酯复合物+泊沙康唑注射液+头孢他啶阿维巴坦+替加环素。治疗过程中出现肝损伤,术后48 d停用头孢他啶阿维巴坦+替加环素,肝功能恢复,后复查肺部CT左肺上叶结节空洞形成,较前减小,空洞壁较前变薄(见图4C),出院后调整口服泊沙康唑肠溶片联合两性霉素B雾化继续治疗,术后89 d复查肺部CT双肺多发结节,较前进展,但无咳嗽、发热等不适,再次入院后调整为口服艾沙康唑片治疗,术后101 d肺部CT可见双肺多发软组织结节影,较前增大、增多(见图4D),术后105 d因呼吸心跳骤停死亡。

图4 病例4、病例5肺部CT变化:A.例4左肺见新发结节;B.例4左肺结节增大并空洞形成;C.例4结节较前减小,空洞壁变薄;D.例4双肺多发结节;E.例5右肺结节形成;F.例5右肺结节变小Fig.4 CT changes in the lungs of case 4 and case5: A. Case 1: new nodules were seen in the left lung; B. Case 4: left pulmonary nodules increased and cavities formed; C. Case 4: the nodules were smaller, and the cavity wall became thinner than before; D. Case 4: multiple nodules in both lungs; E. Case 5: right pulmonary nodule formation; F. Case 5: right pulmonary nodules became smaller
病例5,女性,36岁,2022年4月11日以“扩张型心肌病、难治性心力衰竭、心源性休克、心功能Ⅳ级”为诊断入院,入院后IABP辅助循环,因患者群体反应性抗体(panel reactive antibody, PRA)阳性,应用免疫球蛋白、利妥昔单抗、血浆置换进行脱敏治疗,于2022年5月2日行心脏移植术,分别于术后1 d及2 d拔除气管插管及IABP,术后给予脱敏治疗预防急性排斥,根据病情调整抗感染方案,后使用伏立康唑联合莫西沙星抗感染方案,术后29 d行胸部CT可见左肺下叶炎症较前减小,右肺中叶结节较前新发(见图4E),行BALF mNGS提示根霉+曲霉,给予泊沙康唑静脉应用,病情稳定后院外规律服用泊沙康唑片,术后79 d行胸部CT可见左肺下叶炎症、右肺中叶结节较前减小(见图4F),定期随访。
2 讨 论
真菌孢子可通过吸入、摄入被污染的食物或破损的皮肤进入易感宿主[4],既往研究表明,毛霉的易感因素或潜在疾病包括糖尿病伴或不伴酮症酸中毒、血液系统恶性肿瘤、其他恶性肿瘤、器官移植、中性粒细胞减少症、长期糖皮质激素的使用、创伤、铁超负荷、非法静脉吸毒、新生儿早产和营养不良等[5-8]。近20年来,由于免疫抑制剂使用的增加、真菌诊断水平的提高以及伏立康唑、卡泊芬净等抗真菌药广泛的预防性应用,报道免疫抑制患者感染毛霉的病例逐渐增加[1],但也有研究表明[9],侵袭性毛霉病的增加是由于易感人群的增加,而并非由于之前使用过伏立康唑治疗,本中心5例患者在诊断毛霉感染之前均使用过伏立康唑抗真菌治疗,但均为出现肺部结节考虑为真菌感染之后应用,此外其中有4例患者在肺部CT出现结节前均应用碳青霉烯类和棘白菌素类抗菌药物(见表2),这也可能增加了毛霉感染的发生,因此尽早送相关培养,根据药敏结果应用抗菌药物,尽量避免抗菌药物全覆盖,可能会减少毛霉感染发生的机率。

表2 确诊前应用抗菌药物Tab.2 Application of antimicrobial drugs before diagnosis
由于近年来进入心脏移植等待者名单中心力衰竭患者的增加,行心脏移植时处于危重状态的患者也逐年增加,国内研究发现[10]危重状态心脏移植受者早期(1年内)总体预后不佳,1年内死亡率增高,且因感染死亡的比例高于一般状态患者,移植术后免疫抑制状态也是毛霉感染的主要原因[8],免疫诱导导致的免疫过度抑制也会增加感染的机率,淋巴细胞间接反应患者免疫状态,可用于指导心脏移植受体术中免疫诱导和术后抗排斥治疗方案[11]。本研究中4例患者术前需应用IABP或气管插管等有创操作稳定循环,病情危重,尽管术中均适当减量免疫诱导剂及激素剂量,仍有4例术后第1天淋巴细胞计数<0.5×109/L,且术后5例患者均使用了IABP辅助循环,5例患者胸部CT发现肺部结节时,淋巴细胞计数均<0.5×109/L(见表3),并且我们对5例患者诊断毛霉病后均停用吗替麦考酚酯及减量他克莫司剂量,患者均未发生排斥反应,但目前对危重患者免疫抑制剂的用量尚无统一定论。另外环境因素对毛霉感染同样重要,国外曾报道因心脏移植术前曾从事飓风后清理工作,导致术后感染毛霉的病例[12],本研究中病例1和2发生在2019年春,而病例3、4、5发生在2022年春,各病例在住院和治疗期间无交叉,但发生时间相对较近,这可能与周围环境存在一定关系,春季由于北方暖气的应用有利于空气中真菌孢子的传播,加之毛霉适宜的生长温度为25~55 ℃,因此移植术后隔离病房的环境严格消毒非常重要,看护人员以及查房医生均应严格无菌操作以及加强手卫生。既往报道称实体器官移植(solid organ transplant, SOT)中肾衰竭是毛霉治疗失败的独立危险因素[13-14],2019全球毛霉病的流行学结果显示[15],约58%的伴有肾衰竭的SOT患者感染毛霉,本中心5例患者中3例合并有肾衰竭且治疗失败。

表3 有创操作及淋巴细胞计数Tab.3 Invasive manipulation and lymphocyte count
毛霉病死亡率极高,2005年文献综述报道总死亡率为54%,未接受治疗的患者生存率仅为3%[16],本研究中有4例患者死亡,平均生存时间131 d,中位生存时间101 d,早期诊断毛霉感染是精准治疗及改善预后的关键,早期患者的痰、血及BALF的G实验和或GM试验增高提示真菌感染,但对诊断毛霉缺乏特异性,且影响因素较多,肺部影像学表现往往较早提示真菌感染,尤其肺部结节和晕征的出现,但对毛霉病诊断缺乏特异性,但进展迅速的单发或多发结节往往提示霉菌感染,本研究5例患者中4例表现为进展迅速的单发或多发结节,从确诊毛霉到死亡的平均生存时间56 d,中位生存时间63 d,毛霉病的确诊主要根据组织病理及培养,本中心5例患者术后确诊平均时间为134 d,中位时间29 d,其中有2例经组织病理确诊,例1毛霉播散后出现皮肤感染经病理确诊为毛霉病,例2首次肺部结节穿刺活检未检出毛霉,术后211 d再次行穿刺活检时诊断为毛霉病,已错过最佳治疗时机。由于肺毛霉病的临床表现及影像学表现缺乏特异性,器官移植术后病理组织活检风险较大,真菌培养耗时长,阳性率低[17],随着近年来分子生物技术的发展,宏基因二代测序技术在肺部感染中的应用越来越广泛,既往研究表明[18]在肺部感染中的检出率近89%,高于传统方法检出率,mNGS对于少见及生长缓慢病原菌的确诊时间、精准治疗及改善预后方面具有巨大优势[19]。本中心有3例患者经mNGS辅助诊断为毛霉病,虽然在诊断为肺毛霉病时mNGS序列数不高,但相对丰度较高,且毛霉属于机会致病菌,由于移植术后抗排斥药物的应用,患者免疫力低下,根据影像学检查及临床经验诊断为肺毛霉病。其中例3患者曾在血液mNGS疑似背景菌中发现根霉属,而后在BALF mNGS中发现根霉,提示对毛霉感染高危患者来说NGS背景菌也不容忽视,并且也有报道研究表明血液mNGS有可能从血液样本中检测出侵袭性霉菌感染[20],这些都为早期诊断治疗提供了方向。
欧洲真菌联合会指南[21]中指出:毛霉病的一线治疗包括手术干预及两性霉素B脂质体,泊沙康唑和艾沙康唑被推荐为毛霉病的挽救治疗,报道研究表明[5],接受抗真菌治疗的肺毛霉患者中,生存率为62%,仅接受手术治疗的患者存活率为57%,接受手术+药物治疗的患者生存率可提高到70%,但外科手术切除时机的选择非常关键,本研究中病例1诊断毛霉后给予截肢手术,但病情进展迅速,很快出现大咯血死亡,病例2确诊时间较晚,确诊后给予结节空洞内注射两性霉素B,取得了不错效果,但在没有外科手术切除结节空洞前患者院外出现血管破裂大咯血死亡,病例3、4在确诊毛霉后均给予两性霉素B胆固醇硫酸酯复合物+泊沙康唑+两性霉素B雾化联合治疗,患者肺部结节较前缩小,但是因为两性霉素B的不良反应给予停用和减量,而继续给予泊沙康唑片联合两性霉素B雾化,后病例3、4均出现结节增大以及毛霉肺内播散而未能行手术治疗,尽管病例4后期给予艾沙康唑片进行补救治疗,但仍未取得满意效果。病例5在确诊毛霉后给予泊沙康唑注射液联合两性霉素B雾化,患者肺部结节较前减小,出院后给予泊沙康唑片口服,病情稳定。心脏移植术后毛霉感染危险因素多,碳青霉烯类抗生素应用可能是危险因素之一,病情进展迅速、死亡率高,尽早诊断、规范治疗是改善预后的关键,宏基因二代测序可作为早期诊断方法之一,但仍需关注疑似背景菌群中可能的致病菌,并且治疗期间需密切关注患者自身免疫力,在不发生排斥的前提下尽可能下调抗排斥药物浓度。

