基于虚拟筛选技术对氟康唑细胞毒性的机制评价
李松哲 孙悦 蔡凌云 孙阳
(黑龙江中医药大学基础医学院,哈尔滨 150040)
氟康唑作为一种广谱抗真菌药物[1],在体外对各种真菌酵母菌有效[2]。基于这一特性,氟康唑被认为可以作为防治细胞污染的手段[3],并有观点指出在5%~10%用量时不会对细胞造成明显损害[3-5]。细胞培养过程中的污染现象虽然偶发,但由于感染来源及菌种众多,一旦出现便较为棘手,影响实验进展,尤其对于贵重细胞常采取保守的补救措施。但是,随着研究的进一步深入,有相关文献认为氟康唑可能对细胞具有遗传毒性/致突变的作用[6],不仅如此,根据美国食品药品监督管理局(FDA)的用药指导,氟康唑具有肝毒性风险,且对于肾功能不全的患者,应当减少氟康唑的使用剂量。这意味着氟康唑可能会导致细胞损伤而影响实验的客观性,本文将通过虚拟筛选技术,使用3种细胞株验证氟康唑对细胞活性的影响。
1 材料与方法
1.1 细胞与试剂
人肝癌SMMC-7721细胞购自FuHeng(上海)。人胚肝HHL-5细胞和人胚肾HEK-293细胞购自Otwo Biotech (深圳)。DMEM高糖和1640培养液购自BOSTER。氟康唑氯化钠注射液购自四川科伦药业股份有限公司。细胞增殖及毒性检测试剂盒和Hoechst 33342染色液购自MeilunBio。碘化丙啶(PI)购自Sigma。RNAeasyTMAnimal RNA Isolation Kit with Spin Column和BeyoRTTMIII First Strand cDNA Synthesis Master Mix (5X)购自Beyotime。ChamQ Universal SYBR qPCR Master Mix购自Vazyme。引物合成购自Comate Bioscience Co.,Ltd,引物序列见表1。
1.2 虚拟筛选实验
潜在靶点的收集 根据FDA对氟康唑的用药原则,推测可能损伤的靶点范围,以“hepatotoxicity”“nephrotoxicity”和“cytotoxicity”分别作为关键词,挖掘GeneCards数据库(https://www.genecards.org)(2022年1月下载)涉及毒性损伤的潜在靶点,所搜集的靶点仅保留相关性得分≥30的信息。
构建与分析“毒性靶点”PPI网络 为进一步明晰核心毒性靶点,将3次检索所得的潜在靶点取交集,通过Venn(http://bioinformatics.psb.ugent.be/people)完成hepatotoxicity、nephrotoxicity和cytotoxicity的交集处理,并绘制韦恩图。再将交集靶点提交至STRING数据库[7](https://string-db.org)构建蛋白互作(PPI)网络模型,“Organism”设定为“Homo sapiens”,置信度设为0.4,得到PPI网络。再将此网络导入CytoScape3.70中分析,根据各个节点的“Combined degree”值大小,通过对可视化参数的调整筛选核心潜在蛋白质。
氟康唑与核心靶点蛋白的搜集 通过Zinc15数据库[8]检索氟康唑分子结构,下载mol2文件。根据PPI网络明确潜在的核心靶点,通过RCSB PDB数据库(http://www.rcsb.org/) 下载这些靶基因对应的蛋白晶体结构。
分子对接软件及前期准备 分子对接软件采用autodockTools 1.5.6中的vina模块[9],其中根据vina报道,经vina处理的分子-靶点对接结果中,均方根偏差(root mean square deviation,RMSD)<2的比例高达78%,RMSD<2被认为对接方案可行,故通过vina的分子对接预测可以被认为可行性、准确性较高。根据之前的对接办法[10],将氟康唑小分子和靶点蛋白通过去除水分子,加氢进行预处理,采用半柔性及盲性对接法实行预测,其余参数均采用默认值,得到预测结果,因本次实验最终采取qRT-PCR实验验证,故忽略其生成氢键等可行性前提,结果仅取最小结合能作为参考,且可视化对接结果。
1.3 细胞培养
人肝癌SMMC-7721细胞和人胚肾HEK-293细胞使用含10%胎牛血清与1%青/链霉素的DMEM培养液培养,人胚肝HHL-5细胞使用含10%胎牛血清与1%青/链霉素的1640培养液培养。3种细胞使用25 cm2培养瓶常规培养,待细胞密度长至80%~90%时进行传代处理,将细胞制成细胞悬液分瓶传代,传代后放入恒定37 ℃、5%的CO2培养箱中继续培养。实验取对数生长期细胞。
1.4 细胞毒性实验
分别将3种细胞等量铺于96孔板上,每孔体积100 μL,然后放入细胞培养箱内孵育贴壁12 h。贴壁后对细胞进行加药处理,设置空白组、对照组与给药组,给药组加5%与10%的氟康唑,每组设置3个复孔。之后继续培养24 h,待完成后按每孔10 μL加入CCK-8试剂,暗孵育1~1.5 h,置于酶标仪检测吸光度,酶标仪参数为37 ℃环境,450 nm波长检测,得到数据统计OD值,依据公式计算细胞抑制率。抑制率=[(对照孔吸光度-给药孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100%。
1.5 Hoechst 33342/PI双染实验
配置Hoechst 33342母液为1 mg/mL,PI母液为2 mg/mL。分别制备3种细胞的细胞悬液,每孔细胞配悬液加至1 mL,放入培养箱培育过夜。次日更换培养液并加入5%与10%的氟康唑持续24 h,待完成后弃上清,使用PBS清洗3次,最后每孔加入1 mL的PBS、5 μL的Hoechst 33342和2.5 μL的PI,放入培养箱继续孵育20 min,于荧光显微镜下观察,1 h内完成观察拍照。
1.6 总RNA提取和qRT-PCR检测
设置对照组与给药组,给药组加10%氟康唑。作用24 h后,用离心柱提取对照组和给药组的总RNA。使用BeyoRTTMⅢ First Strand cDNA Synthesis Master Mix (5X)按照说明将 RNA 逆转录为cDNA。采用ChamQ Universal SYBR qPCR Master Mix配置扩增反应体系,PCR扩增40个循环,95 ℃预变性30 s,95 ℃持续15 s,56 ℃处理15 s并在72 ℃下延伸25 s。以GAPDH为内参基因检测目标基因相对表达量。每个样品重复3次,基因的相对表达水平根据2-ΔΔct计算。
1.7 统计学分析
所有统计分析均使用SPSS 26.0软件进行,通过独立样本t检验分析组间差异,以P<0.05为差异具有统计学意义,P<0.01为差异具有极显著统计学意义。
2 结 果
2.1 虚拟筛选实验
潜在靶点的获取 根据相关度筛选后,以“hepatotoxicity”关键词共获靶点633个,以“nephrotoxicity”关键词共获靶点553个,以“cytotoxicity”关键词共获靶点8581个。
“毒性靶点”PPI网络构建 将3个关键词筛选的靶点取交集,并通过Venn网站绘制韦恩图,见图1A。得到毒性共同靶点216个。再将相同靶点提交至STRING数据库分析,输出数值使用CytoScape 3.70进行可视化分析,见图1B。网络毒理学模型共包含节点210个,表示预测的作用靶标,边线3430条,表示蛋白之间的相互作用关系。节点的颜色越深,圆圈越大,代表连接度的值越大。可视化后发现,白细胞介素(IL)-6、抑癌基因(TP53)、肿瘤坏死因子(TNF)、白细胞介素(IL)-1β、血管内皮生长因子A(VEGFA)以及表皮生长因子受体(EGFR)这6个靶标的连接度值最大,表明这6个靶标在本次模型中关联度最强,所以可认为这6个靶标是氟康唑潜在的毒性核心靶标。
对接靶点的收集与结果 根据“combined degree”收集排名前6的核心靶点,将氟康唑与核心靶点逐一对接,结合自由能单位为kcal·mol-1,靶点PDB编号、分辨率及对接结果见表2。依据所得数据分别可视化核心靶点的最优对接数据,利用VMD软件可视化对接构象叠合图,使用蛋白质配体相互作用图谱(protein-ligand interaction profiler, PLIP)对对接结果进行分析[11],核心靶点的对接展示见图2。
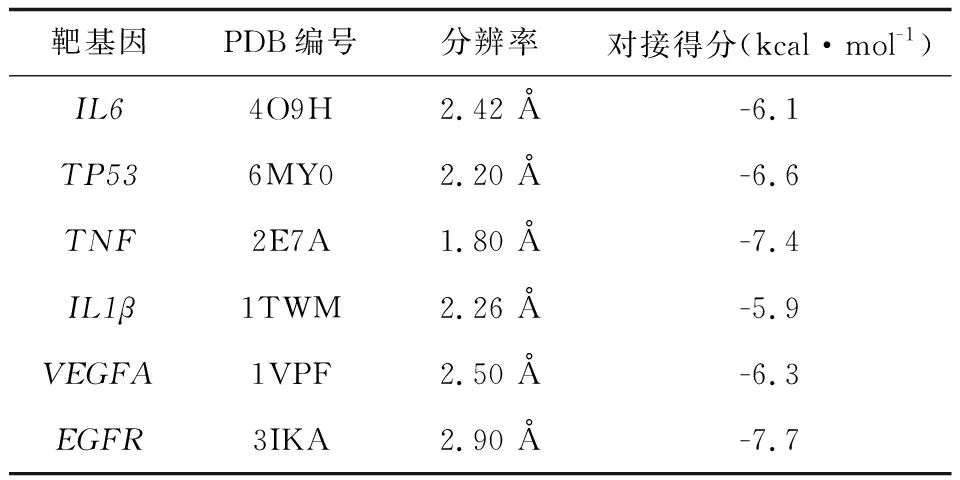
表2 靶蛋白编号及对接结果Tab.2 Target protein numbers and docking results
2.2 细胞毒性实验结果
在5%和10%的药物浓度下对3种细胞进行了CCK8检测,结果见图3A~C,总体来看,氟康唑对SMMC-7721细胞和HHL-5细胞具有抑制作用,抑制率在10%左右,而对HEK-293细胞则表现出促增殖作用。当药物浓度在5%时,对SMMC-771细胞和HEK-293细胞的抑制/增殖无统计学意义(P>0.05),对HHL-5细胞具有显著的统计学意义(P<0.01)。当药物浓度在10%时,对3种细胞的抑制/增殖皆有极显著的统计学意义(P<0.01)。
2.3 Hoechst 33342/PI双染实验结果
荧光染色结果见图4。镜下观察氟康唑在不同浓度下作用细胞24 h后的形态学变化,其中凋亡细胞呈强蓝光,晚期凋亡细胞及坏死细胞呈强红色和强蓝色荧光。由图可见,SMMC-7721细胞与HHL-5细胞在氟康唑作用下不同程度的表现出凋亡/坏死细胞增加,其中,细胞密度随浓度的增加呈递减趋势,而5%浓度下的凋亡细胞高于10%浓度,可能是由于高浓度下能更快诱导细胞凋亡进而被吞噬导致的。而HEK-293细胞的凋亡/坏死细胞略有增多,但总体无明显改变。
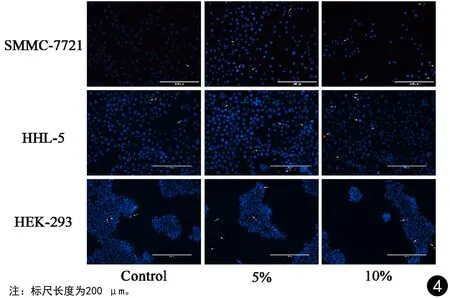
图4 荧光染色结果Fig.4 Fluorescence staining results
2.4 qRT-PCR检测细胞基因mRNA表达
在10%药物浓度下对3种细胞进行了qRT-PCR检测,绘制火山图,见图3D~F。其中灰色代表表达不显著。绿色代表log2 fold change差异显著,log2 fold change为对照组与给药组mRNA相对表达量的差异比较,负值为药物起到抑制表达作用,正值为起到促进表达作用。蓝色代表P值显著。红色代表log2 fold change和P值皆显著。由图可知,通过对潜在核心毒性靶点的qRT-PCR验证,发现10%的氟康唑会导致细胞出现不同程度的mRNA表达改变,这种基因水平上的干预可能对癌细胞更为敏感。在靶点干预上,尤其对IL1-β、IL-6和EGFR有更明显的调控作用。
3 讨 论
虚拟筛选技术是提高药物命中靶点概率的常用方法,能够降低实验成本,更快的筛选药物作用目标[12]。目前,有证据认为10%的氟康唑能够用来防治细胞污染,且不会对细胞造成损害,但该结论缺乏分子层面的实验检测。根据FDA的报道,氟康唑具有肝毒性[13],药代动力学也受肾功能不全的显著影响[14-15],所以,无差别地用来防治细胞污染可能会影响实验的客观性。
本次实验利用虚拟筛选办法,分别对3种细胞使用了5%和10%浓度的氟康唑,结果发现氟康唑在5%的浓度下就已经对人胚肝HHL-5细胞产生了明显的抑制作用(P<0.01),在10%浓度下对人肝癌SMMC-7721细胞、人胚肝HHL-5细胞和人胚肾HEK-293细胞的增殖/抑制具有明显的干预作用(P<0.01),并且会影响mRNA的表达水平。其中氟康唑对SMMC-7721细胞和HHL-5细胞具有抑制作用,抑制率在10%左右,而对HEK-293细胞具有促增殖作用,荧光染色结果也符合细胞活性检测趋势。在对mRNA的检测上,对SMMC-7721细胞的基因调控更加明显,约占67%;而对HHL-5细胞和HEK-293细胞的基因调控较少,各占33%左右。
结果显示氟康唑具有普遍调控作用的核心靶点为IL1-β、IL-6和EGFR。IL1-β由各种类型的细胞分泌产生,能够调节基因表达、细胞因子的产生与免疫反应[16]。IL-6是具有多效性的细胞因子,抗IL-6疗法可减少炎症、肝脏急性期蛋白和贫血,并具有抗血管生成作用[17]。总之IL1-β[18]和IL-6[19]参与多条炎症和癌症通路[20]。Poursheikhani等[21]发现EGFR能够通过MEKK信号转导途径驱动上皮性卵巢癌细胞的化学抗性,进而起到逆转化疗耐药的作用。Moon等[22]发现含有WW结构域的转录调节子1与EGFR信号通路的协同激活能够诱导肝细胞癌和胆管癌。除此之外,EGFR也是非小细胞肺癌[23]、乳腺癌[24]等癌种的经典治疗靶点。由此认为,氟康唑并不适合广泛的应用于治疗细胞污染,尤其对于肿瘤细胞而言,可能会影响实验结果,出现假阳性或假阴性情况,降低实验可重复性。
所以,当出现细胞污染时,应尽量将污染细胞舍弃处理。若要进行除菌操作,可选用低速离心法或增加三抗处理,若要通过氟康唑进行除菌操作,应摸索适合于实验细胞的毒性临界浓度,并比对除菌前后细胞靶点的表达水平,尽量避免影响实验的可重复性。
4 结 论
10%的氟康唑并不适合作为防治细胞污染的安全剂量,对于某些细胞具有一定的抑制作用,并且能够调控某些靶点mRNA水平的表达。

