有机条件下硫酸盐型厌氧氨氧化生物反应机理研究*
杨江伟 袁林江# 王 茹 杨丰丰
(1.西安建筑科技大学环境与市政工程学院,陕西 西安 710055;2.陕西省环境工程重点实验室,陕西 西安 710055;3.西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
许多行业(如化工、食品、制药及造纸)排放的废水中含有高浓度(>1 000 mg/L)的氨氮及硫酸盐[1-2]。氨氮的过量排放会使水体中的藻类和水生植物过度繁殖,导致水体富营养化[3]。水体中硫酸盐的积累会导致有害气体H2S的释放,并使水体变黑发臭,严重危害环境[4]。对此类废水的有效处理迫在眉睫。作为废水脱氮的新兴技术之一,厌氧氨氧化因其高脱氮效能、低污泥产量及不需要外加碳源等优势受到学术界和产业界的密切关注[5],但是氨氮的亚硝化过程限制了其工程应用。而硫酸盐主要通过氧化还原作用被转化为硫单质进行回收利用[6],但是生物脱硫技术工艺复杂,需要供氧及投加有机物,处理费用高。此外,硫化物也会对微生物产生抑制,使得含氨氮与硫酸盐的废水的处理面临较大挑战。
2001年,FDZ POLANCO等[7]在处理甜菜酒糟废水时发现氨氮与硫酸盐可同步去除,处理过程中检测到硫单质及氮气的生成,他们将这个反应称为硫酸盐型厌氧氨氧化(SRAO)反应,这一发现使得废水生物同步脱氮除硫成为可能。虽然SRAO现象已被观测到,且在热力学上是可行的,但是SRAO反应过程至今不明晰,限制因素较为复杂,致使SRAO反应器运行面临极大困难。国内外学者对SRAO反应的发生条件和反应机理认知存在较大分歧。无论在有机还是无机条件下SRAO反应都有启动的先例,RIKMANN等[8]、PRACHAKITTIKUL等[9]认为氨氮与硫酸盐在有机条件下同步转化,而ZHANG等[10]、完颜德卿等[11]的研究表明SRAO在无机条件下亦可发生。毕贞等[12]发现厌氧条件下不会发生SRAO反应;而李祥等[13]将进水进行除氧处理,反应器在厌氧条件下亦可发生SRAO反应。RIKMANN等[14]观察到SRAO过程中氮硫转化比明显高于理论值,碳、氮、硫参与的复杂生物反应至今未能被成功揭示。对SRAO反应认知的欠缺严重阻碍SRAO技术的发展。
为了探究SRAO反应的发生条件、揭示SRAO生物反应机理,本研究采用上流式厌氧污泥床(UASB)反应器,在有机条件下采取除氧措施,通过逐步提高进水基质浓度,建立SRAO反应体系。通过对SRAO反应阶段的产物分析,揭示SRAO反应机理。
1 材料与方法
1.1 实验装置及运行条件
实验装置为有机玻璃制成的UASB反应器,如图1所示。反应器内径100 mm,反应区高800 mm,有效容积为6.28 L。反应器温度由水浴夹层控制,保持在(32±2) ℃。反应器进水经除氧处理后,加盖静置。实验阶段运行参数:pH为7.9±0.3,水力停留时间(HRT)为24 h。
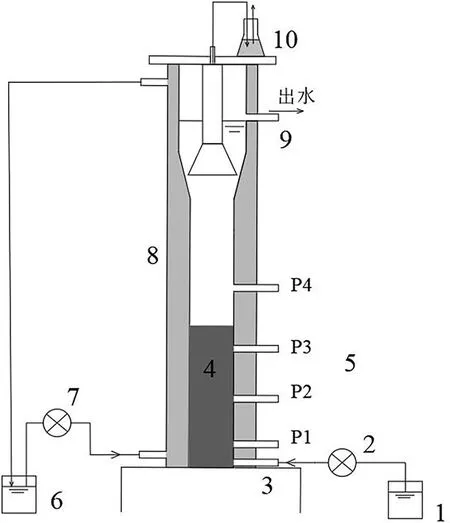
1—进水桶;2—进水蠕动泵;3—进水口;4—污泥层;5—取样孔(P1至P4分别为下层、中层、上层、泥层上);6—保温水桶;7—保温层进水蠕动泵;8—保温层;9—出水口;10—液封瓶图1 实验装置示意图Fig.1 Schematic diagram of the experimental setup
1.2 接种污泥与废水组成
接种污泥为西安市雪花啤酒厂厌氧颗粒污泥与实验室培养的厌氧氨氧化污泥混合的污泥。混合液悬浮固体(MLSS)为50.21 g/L,混合液挥发性悬浮固体(MLVSS)为26.09 g/L,MLVSS/MLSS=0.52。
废水采用人工模拟废水,进水中的氨氮与硫酸盐分别由NH4Cl与Na2SO4提供,按需添加,化学需氧量(COD)由无水葡萄糖提供。配水组分:KH2PO427 mg/L,KHCO3500 mg/L,CaCl280 mg/L,MgCl2·6H2O 160 mg/L,微量元素Ⅰ、Ⅱ各1 mL/L。微量元素Ⅰ:乙二胺四乙酸(EDTA) 5 g/L,FeSO4·7H2O 5 g/L;微量元素Ⅱ[15]:EDTA 15 g/L,ZnSO4·7H2O 0.43 g/L,CuSO4·5H2O 0.25 g/L,NiCl2·6H2O 0.19 g/L,MnCl2·4H2O 0.99 g/L,CoCl2·6H2O 0.24 g/L,NaMoO4·2H2O 0.22 g/L,H3BO40.01 g/L,Na2SeO4·10H2O 0.21 g/L,NaWO4·2H2O 0.05 g/L。
1.3 分析方法
氨氮、亚硝态氮、硝态氮、硫酸盐、硫离子的测定方法参考《水和废水监测分析方法(第四版)》。氧化还原电位(ORP)采用ORP仪(MTC10103型)测定,溶解氧(DO)采用DO仪(HQ40d型)测定;pH采用pH计(PHS-3E型)测定;微生物测序分析由上海某生物工程公司完成。
1.4 实验方法
1.4.1 不同氮硫摩尔比实验
在反应器运行稳定后(123 d)将进水氨氮提高到约78 mg/L,硫酸盐提高到约156 mg/L,进水氮硫摩尔比从2提高为3。稳定运行20 d后,计算平均去除负荷并与反应器第三阶段后期(87~122 d)平均去除负荷进行对比,探究不同氮硫摩尔比条件下反应器中氨氮与硫酸盐平均去除负荷及硫离子平均产生速率变化情况。
1.4.2 活性测定实验
氨氧化细菌(AOB)、硝化细菌(NOB)活性测定:SRAO反应体系建立后,取反应器下、中、上污泥层泥水混合物,用磷酸盐缓冲液清洗3次倾去上清液。称取3 g湿污泥置于150 mL的锥形瓶内,分别加入基质至150 mL,其他基质同反应器进水,控制pH为7.9±0.3,在34 ℃水浴中充分曝入空气,每间隔2 h取样,测定氨氮和亚硝态氮浓度,计算AOB、NOB活性。
厌氧氨氧化菌(AnAOB)、硫酸盐还原菌(SRB)、SRAO菌、硫自养反硝化(SADN)菌、反硝化菌(HDB)活性测定:SRAO反应体系建立后,取反应器下、中、上污泥层泥水混合物离心后倾去上清液,称取3 g湿污泥置于130 mL的血清瓶中,加入基质至130 mL,其他基质同反应器进水,控制pH为7.9±0.3。以高纯氮气曝气10 min后置于恒温水浴摇床(34 ℃、140 r/min)中培养,每间隔12 h取样测定基质浓度,计算活性。
主要基质如表1所示,上述实验设定3组平行实验,微生物活性以单位质量挥发性悬浮固体去除的基质质量进行计算。

表1 活性测定设定基质质量浓度Table 1 Determination of substrate concentration for activity assay
1.4.3 批式实验
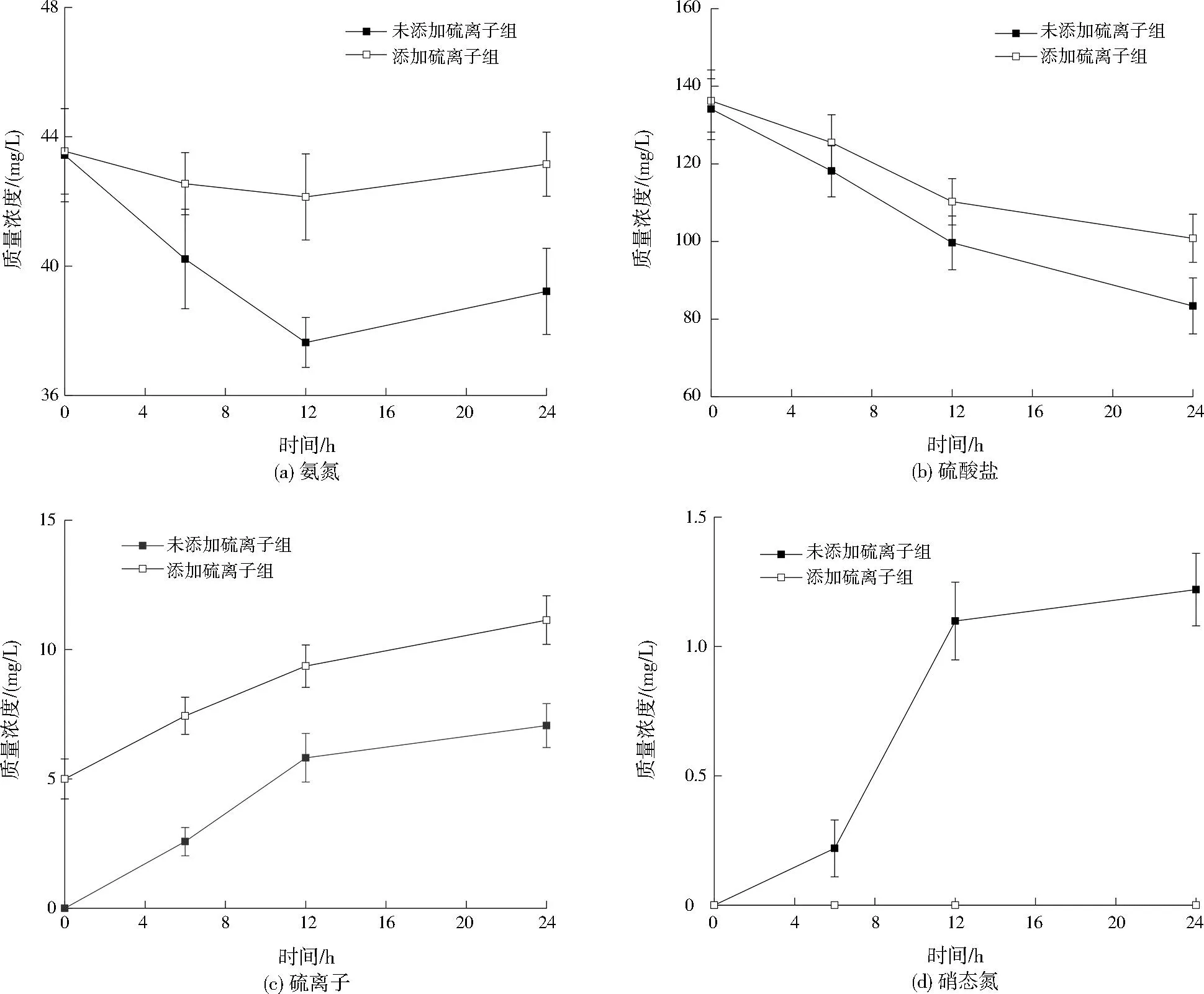
SRAO反应体系建立后,采用批式实验探究SRAO反应的中间产物及硫离子对SRAO反应的影响。批式实验分为未添加硫离子组与添加硫离子组,氨氮、硫酸盐及COD分别约为43、135、100 mg/L,添加硫离子组中硫离子约为5 mg/L,其他基质同反应器进水,控制pH为7.9±0.3。批式实验在厌氧血清瓶中进行,具体方法同1.4.2节中SRAO菌活性测定实验,间隔一定时间取样测定基质浓度。
2 结果与讨论
2.1 厌氧条件下SRAO反应体系的建立及性能研究
2.1.1 SRAO反应体系的建立
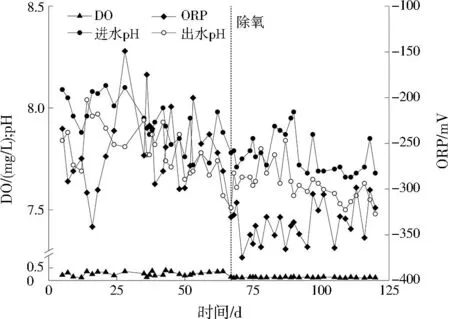
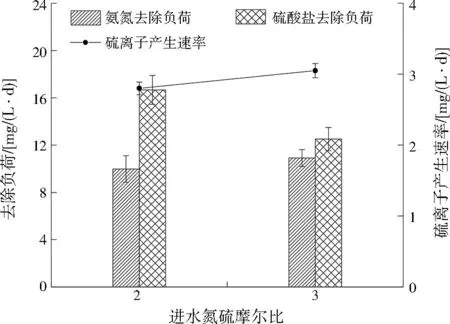
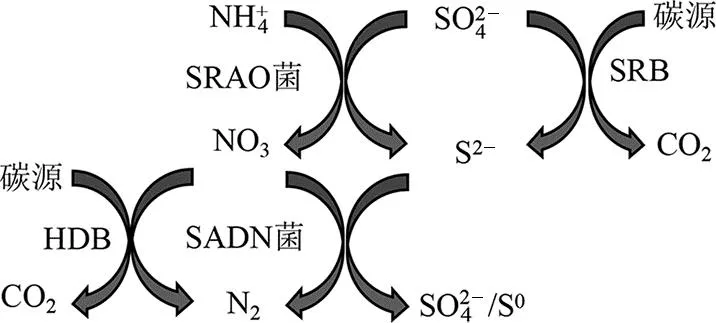
采取逐步提高进水氨氮与硫酸盐的浓度及除氧的方式启动反应器。图2所示为SRAO反应体系建立过程中氨氮与硫酸盐的变化情况。图3为反应器DO、ORP及进出水pH变化情况。第一阶段(1~24 d)为微生物适应阶段,进水氨氮、硫酸盐及COD平均值分别约为21、62、50 mg/L,反应器内DO、ORP基本维持在缺氧条件(0.2 mg/L 图2 进出水氨氮、硫酸盐及硫离子变化Fig.2 Variation of ammonia nitrogen,sulfate and sulfur ion in the inlet and outlet water 图3 反应器内DO、ORP及进出水pH变化Fig.3 Variation of DO,ORP and pH of inlet and outlet water in the reactor 第二阶段(25~55 d)为微生物活性提高阶段,进水氨氮、硫酸盐及COD平均值分别约为37、64、50 mg/L。反应器内DO、ORP大致维持在缺氧条件,在这一阶段氨氮去除率逐渐升高,最高去除率达到32.65%。硫酸盐平均去除负荷为6.68 mg/(L·d),硫离子平均产生速率为4.95 mg/(L·d)。在此阶段发生了氨氮与硫酸盐同时去除的现象。 第三阶段(56~122 d)为稳定阶段,进水氨氮、硫酸盐及COD平均值分别约为38、130、100 mg/L。由于反应器在前两个阶段未能达到完全厌氧条件,在67 d对进水采取除氧措施,进水除氧后反应器基本达到厌氧条件(DO<0.2 mg/L,ORP<-330 mV)。在进水除氧后部分微生物不适应厌氧环境而衰亡,导致氨氮、硫酸盐浓度略微高于进水。经过一段时间的稳定后,87~122 d,氨氮去除率逐渐升高,氨氮平均去除负荷为9.98 mg/(L·d),最高去除率为40.87%,硫酸盐平均去除负荷为16.67 mg/(L·d),硫酸盐最高去除率为19.10%,硫离子平均产生速率为2.80 mg/(L·d)。 2.1.2 不同氮硫摩尔比对氮、硫去除影响 图4为进水氮硫摩尔比分别为2和3时反应器中氨氮与硫酸盐平均去除负荷及硫离子平均产生速率变化情况。当进水氮硫摩尔比从2提高为3时,氨氮平均去除负荷提高了0.93 mg/(L·d),硫酸盐平均去除负荷减少了4.16 mg/(L·d),硫离子平均产生速率提高了0.25 mg/(L·d)。ZHANG等[18]在无机条件下启动SRAO发现随着进水氮硫摩尔比的增加,出水中亚硝态氮的浓度也增加。刘福鑫等[19]在探究SRAO时发现,在实验后期SADN反应增强时出水硫酸盐浓度高于进水。在本研究中出水未检测到亚硝态氮及硝态氮,提高进水氮硫摩尔比可以促进氨氮的去除,使中间产物增加,但是在有机条件下亚硝态氮及硝态氮会很快被HDB利用。此外,反应器中产生大量硫离子,SADN菌也可以利用亚硝态氮及硝态氮将硫离子转化为硫酸盐,使出水中硫酸盐浓度升高,导致硫酸盐去除减少。 图4 不同氮硫摩尔比条件下氨氮与硫酸盐去除情况Fig.4 Ammonia nitrogen and sulfate removal under different N/S molar ratio condition 2.2.1 反应器内氮、硫转化效能分析 为了探究反应器内氮、硫转化途径,在进水氮硫摩尔比为3的阶段,对反应器不同位置各指标变化进行分析,结果如图5所示。结果表明,进水氨氮在下层污泥至中层污泥这一段被去除,氨氮降低至66.69 mg/L,在下层污泥检测到硝态氮生成。在反应器下层污泥至上层污泥这一段,DO小于0.2 mg/L,ORP低于-330 mV,反应器处于厌氧环境。硫酸盐在下层污泥中被去除,其质量浓度降至44.47 mg/L,在下层污泥中硫离子产生量为5.81 mg/L。随后在中层污泥中硫酸盐升高至113.08 mg/L,硝态氮降低为0.41 mg/L。 图5 反应器不同高度各指标变化Fig.5 Variation of each index at different height of the reactor 对氨氮及硫酸盐浓度变化进行计算,发现进水桶至中层污泥去除的氨氮量为0.78 mol/L,进水桶至下层污泥去除的硫酸盐量为1.16 mol/L,一部分硫酸盐通过SRAO反应去除,一部分通过硫酸盐还原反应去除。下层污泥至中层污泥产生的硫酸盐量为0.71 mol/L。去除的氨氮量(0.78 mol/L)等同于产生的硝态氮,与产生的硫酸盐量基本一致,说明去除的氨氮全部转化为硝态氮,且通过参与SADN途径被尽数去除。 2.2.2 反应器内氮、硫转化过程分析 在反应器运行过程中,会产生大量硫离子,但是氨氮的中间产物却很难检测到,为了探究SRAO反应过程的中间产物及硫离子对SRAO的影响,开展批式实验,并探究添加硫离子(5 mg/L)对SRAO实验的影响,结果如图6所示。结果表明,未添加硫离子组中,氨氮与硫酸盐可以稳定去除,在第12小时,硫离子产生量积累到5.82 mg/L,氨氮去除停止,而硫酸盐去除不受影响。在反应过程中产生硝态氮,由于在批式实验中没有形成稳定的微生物群落结构,硝态氮得以积累。添加硫离子组中氨氮并没有发生明显的去除,而硫酸盐可以稳定被去除且产生硫离子,硫离子的添加抑制了SRAO反应的进行。通过以上分析认为本研究中SRAO反应的中间产物为硫离子与硝态氮,硫离子的积累会抑制SRAO反应的进行,影响氨氮去除。在UASB反应器中,存在复杂的微生物群落结构,产生的硫离子会被SADN菌利用,使得SRAO反应可顺利进行,当硫酸盐还原反应增强时会产生较多硫离子,将抑制SRAO反应的进行。 图6 批式实验中氮、硫变化情况及硫离子对SRAO的影响Fig.6 Variation of N and S in the batch experiment and the effect of sulfur ion on SRAO 2.2.3 反应器内微生物群落结构分析 SRAO反应体系建立后对反应器不同高度污泥层微生物活性进行了分析,结果如图7所示。结果表明,厌氧条件下反应器未表现出AOB活性及NOB活性。同时,对反应器0 d及122 d中下层污泥微生物属水平相对丰度进行对比,结果如表2所示。反应器中AOB(Armatimonadetesgp5)及NOB(硝化螺旋菌)逐渐衰亡。由于进水中未添加亚硝态氮,且反应器长期在有机条件下运行,导致AnAOB活性受到抑制[20],AnAOB(unclassifiedCandidatusbrocadiaceae)相对丰度从6.84%降至1.11%。反应器下层污泥及中层污泥中SRAO微生物活性分别为18.88、21.21 mg/(g·d)。文献[8]、文献[9]认为浮霉菌门(Planctomycetes)是参与SRAO反应的重要菌种。在表2中观察到unclassifiedPlanctomycetaceae的相对丰度从2.68%提升到6.87%,成为反应器中优势菌种,推断unclassifiedPlanctomycetaceae在SRAO反应过程中对氨氮与硫酸盐的转化起到了重要作用。硫杆菌属为反应器中SADN菌,可以以硝态氮为电子受体将硫离子或硫单质氧化为硫酸盐[21],其相对丰度从0.51%增加到3.23%,说明在反应过程中会产生硝态氮,使硫杆菌属得到富集。在反应器中、上层污泥中检测到SADN菌活性分别为11.52、12.78 mg/(g·d)。结合2.2.1节中反应器不同高度各指标变化情况,可证明氨氮与硫酸盐在污泥中下层发生反应,SADN反应发生在污泥中上层。在反应器不同污泥层都存在SRB活性,脱硫球菌、unclassifiedDesulfobacteraceae是反应器中主要的SRB,可以利用COD将部分硫酸盐还原。由于UASB反应器内基质具有垂直分布特征,反应器能够在垂直空间营造适合多种微生物生存的环境[22],使反应器中氮、硫能够被稳定去除。 表2 微生物属水平相对丰度Table 2 Genus level relative abundance of microbe 图7 反应器不同高度污泥层微生物活性Fig.7 Microbial activity at different level of the reactor sludge layer 2.2.4 SRAO反应途径分析 本实验在有机条件下探究SRAO过程,发现下层污泥中产生大量硫离子,同时产生硝态氮。厌氧条件下,反应器中不发生好氧氨氧化作用,同时由于AnAOB活性被抑制,反应器中也不发生厌氧氨氧化作用。反应器中硝态氮的产生不是经由好氧或厌氧氨氧化两种途径产生的,而反应体系中的电子受体只有硫酸盐,故认为氨氮与硫酸盐发生了SRAO反应产生了硝态氮。综合上述实验结果,推测在UASB反应器中SRAO过程分步分层进行:首先,在中下层污泥中氨氮与硫酸盐在微生物作用下发生反应生成硫离子和硝态氮(见式(1));随后,在中上层污泥中硫离子与硝态氮发生SADN反应生成硫酸盐和氮气(见式(2)),当硝态氮不足的时候硫离子被氧化为硫单质(见式(3))。反应器内氮、硫代谢途径如图8所示。 图8 反应器内氮、硫代谢途径Fig.8 N and S metabolic pathway in the reactor (1) (2) (3) 1) 本研究在有机厌氧条件下实现了氨氮与硫酸盐的同步去除,成功建立了SRAO反应体系。提高进水氮硫摩尔比后可以促进氨氮转化为硝态氮,增强SADN反应,导致硫酸盐去除减少。 2) 本研究发现UASB反应器中SRAO过程分步分层进行。首先,在中下层污泥中,氨氮与硫酸盐在微生物作用下发生反应生成硫离子和硝态氮;随后,在中上层污泥中,硫离子与硝态氮发生SADN反应生成硫酸盐和氮气。反应器中多种微生物协同作用,最终实现氮、硫同步去除。 3) SRAO过程主要受到反应器中硫离子积累的影响,硫离子的累积会抑制SRAO微生物活性,这使得第二步反应是整体反应的限速步骤。
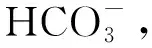
2.2 SRAO反应机理分析



3 结 语

