人参皂苷抗肿瘤机制及其纳米药物递送系统的研究进展
李铭莹,林 霖,王 岩,时 军,吴传斌,朱春娥*
1.广东药科大学中药学院,广东 广州 510006
2.暨南大学药学院,广东 广州 510032
癌症是威胁全球人类健康的重大疾病之一。根据世界卫生组织的报告,2022 年中国癌症新发病例占全球的23.7%,死亡病例占全球的30.2%,死亡人数约为美国癌症死亡人数的5 倍[1]。目前,手术、放射治疗及化学药治疗虽能有效延长癌症患者的生存时间,但仍无法根治,且治疗过程会降低患者的免疫功能,出现多药耐药等不良反应。因此,寻找新型抗肿瘤途径是现代医药研究领域的热门方向之一。
现代研究发现,人参属植物的主要活性成分——人参皂苷具有抗肿瘤功效。人参皂苷是一类三萜皂苷化合物,对心血管类、精神类、肿瘤类及内分泌疾病等均具有积极的治疗作用[2-5]。在治疗癌症方面,人参皂苷不仅具有显著的抗肿瘤活性,且对化疗药物具有明显的增效减毒作用[6]。目前已有人参皂苷类口服用或注射用制剂应用于临床,但由于人参皂苷的组成成分复杂,且大部分单体难溶于水,其生物利用度低,使其使用范围仍较局限[7],因此,人参皂苷新剂型的研究与开发极其重要。综合查阅近年来的文献记载,本文对人参皂苷的基本性质、抗肿瘤作用机制及剂型研究等方面进行综述,为人参皂苷的临床应用及剂型研究提供参考。
1 人参皂苷分类
人参皂苷是糖基化的三萜类化合物,根据苷元结构不同可分为4 类:人参二醇型(protopanaxadiol,PPD)、人参三醇型(protopanaxatriol,PPT)、齐墩果酸型(oleanolic,OA)及奥克梯隆型(ocotillone,C17SCV)。不同类型人参皂苷的代谢产物可归纳为原型人参皂苷和稀有人参皂苷(表1),其中稀有人参皂苷主要是原型人参皂苷的部分糖基水解转化得到的次级代谢衍生物,其极性低,具有较强的疏水性和细胞穿透性,可用于癌症的治疗,尤其是人参皂苷Rg3和Rh2,是目前研究最多的人参皂苷单体成分,也是最具应用前景的用于辅助治疗癌症的药物。

表1 人参皂苷单体及代谢产物的分类Table 1 Classification of ginsenosides monomers and metabolites
2 人参皂苷的抗肿瘤作用机制
大多数人参皂苷对肿瘤细胞具有良好的抑制作用,其中稀有人参皂苷抗肿瘤活性相对较好,主要通过抑制肿瘤细胞增殖、侵袭和转移,诱导肿瘤细胞凋亡和周期阻滞,抑制肿瘤新生血管的形成及增强细胞的免疫调节等实现抗肿瘤功效(图1),对肺癌、胃癌、肝癌、直肠癌和乳腺癌等均具有良好的预防及治疗效果。

图1 人参皂苷抗肿瘤的作用机制Fig.1 Antitumor mechanism of ginsenosides
2.1 抑制肿瘤细胞增殖
近年来,研究发现人参皂苷可通过靶向微小RNA(microRNA,miRNA)、表皮生长因子受体(epidermal growth factor,EGFR)和组蛋白等,抑制肿瘤细胞的增殖。Li 等[8]研究发现,人参皂苷Rh2在体外可剂量相关地促进miR-150-3p的表达,阻断非受体酪氨酸激酶信号传导抑制剂1/分泌型糖蛋白/β-连环蛋白(sarcoma receptor coactivator kinase signaling inhibitor 1/Wnt/β-catenin,SRCIN1/Wnt/βcatenin)信号通路,从而抑制结肠癌SW620 和HCT-116 细胞的增殖。Tang 等[9]研究发现生物合成的人参皂苷3β-O-Glc-DM(C3DM)在剂量25~50 μmol/L时可抑制EGFR 的磷酸化,并靶向磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)下游信号通路,抑制胶质瘤G422 和GL261 细胞的增殖,并呈现了一定的剂量相关性。当采用 5 mmol/L 人参皂苷Rg1作用于宫颈癌HeLa 细胞时,药物可抑制人组蛋白H3 相关蛋白激酶(homo sapiens histone H3 associated protein kinase,HASPIN)介导的组蛋白H3-Thr3 磷酸化,使着丝粒Aurora-B 缺失,导致着丝粒的完整性和纺锤体动力学发生异常,从而阻断HeLa 细胞有丝分裂,进一步发挥抗肿瘤作用[10]。由此可见,人参皂苷不仅能调控miRNAs、EGFR 及其下游信号通路,还能靶向组蛋白进一步影响细胞的有丝分裂,从而抑制肿瘤细胞增殖。
2.2 抑制肿瘤细胞的侵袭和转移
基质金属蛋白酶(matrix metalloproteinases,MMPs)是导致肿瘤细胞侵袭和转移的物质基础,而上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞侵袭和转移的重要生物学过程。研究发现,MMP1 高表达会促进肿瘤细胞的转移。人参皂苷Rh4通过调控Wnt/β-catenin 信号通路和c-Myc 水平来抑制EMT,以延缓食管鳞状肿瘤细胞向淋巴结和肺部转移[11]。同时,人参皂苷Rh1可抑制MMP1 和MMP3 的表达,提高组织中金属蛋白酶抑制因子3 的水平,从而抑制结肠癌细胞的侵袭和转移。此外,人参皂苷Rh1能降低荷瘤小鼠组织中细胞外信号调节激酶1/2(extracellular signal-regulated kinase1/2,ERK1/2)、p38 及氨基末端激酶(jun kinase,JNK)的磷酸化水平,阻断丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)信号通路,最终延缓肿瘤细胞的侵袭和迁移[12]。综上,人参皂苷可通过多种信号通路抑制EMT 过程和MMPs 的表达,从而延缓肿瘤细胞的侵袭与转移。
2.3 诱导肿瘤细胞凋亡和周期阻滞
肿瘤细胞的过度生长是基于癌细胞凋亡失效而完成的。细胞凋亡主要涉及2 个蛋白家族:半胱氨酸天冬氨酸蛋白酶(cysteine aspartate protease,Caspase)家族——细胞凋亡的执行者;B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族——细胞凋亡的协调者,控制线粒体外膜通透性,其中Bcl-2 蛋白是肿瘤细胞凋亡的阻碍者。人参皂苷可靶向调控与这两大蛋白家族相关的信号通路及细胞因子,从而促进肿瘤细胞的凋亡[13]。研究者们发现人参皂苷化合物K(ginsenoside compound K,CK)衍生物(CK-3)可显著抑制Bcl-2 的合成,促进B 淋巴细胞瘤-2 相关X 蛋白(B-cell lymphoma-2 associated X protein,Bax)等促凋亡蛋白的表达,水解激活Caspase-9 后,进一步激活Caspase-3;同时,CK-3可剂量相关性地提高Caspase-8 的表达量[14],进而诱导肝癌HepG2 和HCC-LM3 细胞凋亡。研究发现,以20~60 µmol/L 的CK 作用于肝癌细胞,可抑制Bcl-2 相关转录因子的表达及ERK 通路的激活,从而破坏线粒体的结构和功能,使线粒体释放促凋亡因子,最终促进肝癌细胞的凋亡[15]。此外,CK 还可抑制谷氨酰胺酶1 的表达,减少肿瘤细胞三磷酸腺苷(adenosine triphosphatase,ATP)的产生,降低谷氨酰胺代谢相关氨基酸的利用率,诱导谷胱甘肽的消耗和活性氧积累,阻断肿瘤细胞的营养供给,从而促进对谷氨酰胺高依赖的三阴性乳腺癌细胞凋亡[16]。还有研究发现,CK 可抑制Bcl-2、KIT、DNMT3A、MYC和CSF-1的基因表达,促进TET2基因的表达,进而诱导急性髓系白血病细胞(包括U937、THP-1、MV4-11 和C1498 细胞)停滞于G1期,使其凋亡[17]。除此之外,人参皂苷Rh3可改变参与DNA 复制启动蛋白Orc6、Cdt1 和Mcm2的表达,使HCT116 细胞处于G1期,致使结肠直肠癌细胞凋亡[18]。综上说明,人参皂苷不仅通过激活线粒体凋亡信号通路,还能激发外源性受体的凋亡通路,最终诱导肿瘤细胞凋亡。
2.4 抑制肿瘤新生血管的形成
血管内皮生长因子(vascular endothelial growth factor,VEGF)家族蛋白具有增加血管通透性和促进内皮细胞增殖的功能,在肿瘤新生血管的形成中发挥关键作用,是预防和治疗肿瘤的重要靶点。人参皂苷可靶向VEGF 及其受体,抑制肿瘤新生血管的形成,从而阻断肿瘤细胞的氧气和营养供给,延缓肿瘤的发展。在裸鼠原位肿瘤异种移植模型中,人参皂苷Rg3(25 mg/kg)不仅可以抑制结肠直肠癌细胞的生长与干性,还可以降低血管生成因子(VEGF、ANGPT1、ANGPT2、CCL13)的表达,最终抑制肿瘤血管的生成[19]。人参皂苷Rd 通过阻断Akt/mTOR/p70S6K 信号通路,抑制缺氧反应因子-1α(hypoxia-inducible factor-1α,HIF-1α)/VEGF 通路和VEGFR2 的激活,有效消除VEGF 诱导的细胞迁移、侵袭及毛细血管样结构的发生[20],最终抑制肿瘤血管的形成。这一抗肿瘤作用机制即目前备受研究者们关注的“饥饿疗法”,在未来的肿瘤治疗中将扮演重要的角色。
2.5 增强细胞的免疫调节
众所周知,免疫系统与肿瘤的形成和发展有关。目前,免疫治疗已成为肿瘤治疗的一个新方向,其中人参皂苷可通过增加免疫细胞活性及调控免疫细胞因子来增强机体的免疫功能。去甲肾上腺激素可诱导肺癌A549 细胞和肉瘤S180细胞的增殖和侵袭,并抑制粒细胞的抗肿瘤功能,人参皂苷Rg1通过降低ARG2、MMP1、S100A4、RAPSN的mRNA 表达,促进LAMC2、DSC2、KRT6A、FOSB的mRNA 转录,进而提高荷瘤小鼠中粒细胞的迁移能力及抗肿瘤活性[21]。硫酸盐修饰的人参总皂苷衍生物可促进T 淋巴细胞增殖并激活γ 干扰素(interferon-γ,IFNγ)和肿瘤坏死因子-α(tumor necrosis factor-α,TNFα),从而增强自然杀伤细胞活性,协助YAC1 小鼠淋巴瘤细胞的凋亡[22]。因此,在肿瘤治疗过程中,提高免疫细胞的活性是激活人体免疫能力的关键。而细胞因子是先天性和适应性抗肿瘤免疫的重要介质,在癌症的发生、发展和消除中均起着重要作用,也是治疗肿瘤的关键靶点。
肿瘤微环境(tumor microenvironment,TME)由细胞、脉管系统、细胞外基质、代谢物和趋化因子组成,通常TME 呈酸性。癌细胞中高浓度的乳酸会诱导免疫细胞凋亡并改变细胞因子的分泌,导致免疫逃逸的发生。在G422 和GL261 小鼠模型中,按10.0 mg/kg 的剂量给予小鼠生物合成的人参皂苷C3DM后,发现肿瘤组织中乳酸的生成量显著降低,而CD3+、CD4+和CD8+细胞的百分比显著增加,从而改善小鼠的TME,进而激活T 细胞的免疫功能,最终抑制胶质瘤细胞的增殖和迁移[9]。由此可见,采用人参皂苷调节TME 可直接或间接抑制肿瘤的进程。
3 人参皂苷抗肿瘤的临床应用
2000 年,全球第1 个人参皂苷抗癌新药在中国成功上市,即参一胶囊。参一胶囊不仅能“负向抑制”局部肿瘤,还能“正向重建”全身免疫系统。艾迪注射液是含人参提取物的中药注射剂,已被纳入美国国立综合癌症网络,广泛应用于非小细胞肺癌的辅助治疗。此外,康艾注射液、复方斑蝥胶囊等含人参皂苷的复方制剂,作为化疗药物的辅助用药也在临床上有了一席之地。目前已上市的含人参皂苷的中药制剂及其主要功效见表2,这些制剂的功效特点表明,人参皂苷不仅具有较强的抗肿瘤活性,与化疗联用时还可发挥增效减毒、逆转肿瘤多药耐药性等作用,进而延长患者的生存时间,并改善患者的生活质量,具有极大的应用前景。

表2 已上市的人参皂苷中药制剂及其主要功效Table 2 Marketed preparations related to ginsenosides and their main effects
4 人参皂苷的纳米药物递送系统
剖析人参皂苷相关的上市制剂发现,大部分制剂由多味中药联合应用,只有参一胶囊是以人参的单体提取物入药,主要是因为人参皂苷的大部分单体成分具有溶解度低、渗透性差、半衰期短、外排严重等缺点,导致其生物利用度低,临床应用受到了限制。近年来,利用制剂学手段提高人参皂苷生物利用度的研究越来越多,如聚合物胶束、纳米粒、脂质体等药物递送系统(图2),基于载体材料的特殊性能实现缓释、控释、靶向等给药目的,最终提高人参皂苷的生物利用度。

图2 人参皂苷纳米药物递送系统Fig.2 Nano-drug delivery systems of ginsenoside
4.1 聚合物胶束
聚合物胶束是两亲性嵌段共聚物在水中自组装形成的纳米级胶体分散体系,可包载亲水或疏水药物,从而防止药物降解、增加难溶性药物的溶解度、提高药物稳定性和靶向性、延长药物在血液中的循环时间。此外,聚合物胶束还可改变药物的组织分布和药动学特征,从而实现更好的抗肿瘤效果。目前,聚合物胶束在药物递送系统中已经有了广泛的研究及应用。
Zhang 等[28]以脱氧胆酸-O-羧甲基壳聚糖为载体,利用A54 肽制备了肝靶向的CK 聚合物胶束(APD-CK),结果发现APD-CK 具有良好的分散性、pH 响应性及缓释性,并能增加细胞对药物的摄取率,提高了药物的肝癌靶向性及抗肿瘤活性。Xia 等[29]以Solutol®HS15 和D-α-生育酚聚乙二醇琥珀酸酯为载体,采用薄膜分散法制备人参皂苷Rh2胶束(Rh2-M)。实验结果表明,Rh2-M 不仅具有粒径小、载药量及包封率高等优点,还可以提高药物的溶解度(约提高150 倍),并通过抑制P-糖蛋白作用,增加药物在肿瘤部位的浓度和滞留时间,逆转肿瘤耐药性,最终提高抗肿瘤效果。Jin 等[30]以磷脂酰胆碱和1,2-二硬脂酰-锡-甘油-3-磷酸乙醇胺聚乙二醇2000 为载体材料,制备CK 聚合物胶束,与游离药物相比,该聚合物胶束表现出更好的溶解性、渗透性、滞留性、细胞摄取率和肿瘤靶向性,显著增强了抗肿瘤效果。由此可见,聚合物胶束可大大提高人参皂苷单体在抗肿瘤领域的应用效率,亟待进一步深入研究。
4.2 纳米粒
随着纳米技术的迅速发展和生命科学世纪的到来,研究人员致力将纳米技术应用于癌症治疗中,以达到更加安全、有效地治疗癌症的目标。目前常用的纳米粒包括无载体型纳米粒、有机载体纳米粒和无机载体纳米粒3 类。
无载体型纳米粒因无须引入其他物质、载药量高等优势,是目前研究的热点,但并不是所有药物都适合制备成无载体型纳米粒。人参皂苷单体具有两亲性分子结构,可将人参皂苷直接制成纳米粒应用于纳米给药系统中。Zuo 等[31]采用纳米沉淀法将人参皂苷Rg3和Rb1制备成无载体型纳米粒(Rg3-Rb1NPs)。与人参皂苷Rg3和Rb1的物理混合物相比,Rg3-Rb1NPs 具有显著的pH 敏感性,在肿瘤pH微环境下释药更完全,且无明显的毒副作用。
有机载体纳米粒主要分为聚合物纳米粒和蛋白纳米粒。其中聚合物纳米粒是聚酯类材料通过自组装形成的纳米制剂,以有效递送其他药物。Zhang等[32]采用离子交联法制备的O-羧甲基壳聚糖载CK纳米粒(CK-OCMC NPs)改善了CK 的溶解性,同时,CK-OCMC NPs 呈现了明显的pH 依赖性、对PC3 细胞较大的细胞毒性以及较高的细胞摄取率,最终表现出显著的抗肿瘤细胞增殖的特性。El‑Banna 等[33]以乳清分离蛋白、麦芽糊精及阿拉伯胶为载体,制备人参皂苷Rg3纳米粒(Rg3-NPs)。基于人参皂苷Rg3与3 种载体的协同抗氧化及免疫调节作用,Rg3-NPs 对埃利希实体瘤鼠的发育表现出了明显的保护作用。另一类有机载体纳米粒常以白蛋白作为载体材料,由于白蛋白能与Gp60 受体靶向结合,再与细胞内Caveolin-1 蛋白结合形成转运囊泡,通过细胞膜的内吞作用将纳米粒递送至富含半胱氨酸(酸性分泌蛋白)的肿瘤部位,并与之结合,实现靶向递送药物的目的。Dong 等[34]设计了1 种新型的叶酸修饰牛血清白蛋白(folic acid modified bovine serum albumin,FA-BSA)纳米载体,该载体具有明显的肿瘤靶向性,并能提高人参皂苷Rg5的溶解度。利用脱溶剂法制备的FA-Rg5-BSA 纳米粒载药量大、包封率高、稳定性好,并呈现出明显的pH 依赖性释药特征。细胞实验结果显示,叶酸修饰后的载药纳米粒在受体介导的内吞作用下,有显著的细胞内化趋势,增加了肿瘤细胞内人参皂苷Rg5的摄取量,最终诱导乳腺癌MCF-7 细胞凋亡。基于有机载体材料的特殊性能,设计人参皂苷纳米递送系统可改善人参皂苷单体自身的局限性,为人参皂苷的临床应用提供了无限的潜能。
无机载体纳米粒多以金属和石墨烯为主要载体材料,基于材料的多重功能提高药物的生物利用度,降低药物的毒副作用。目前,无机载体材料在抗肿瘤应用领域已暂露头角。金属纳米复合材料尤其是金纳米粒,因其独特的结构和性能在生物医药领域受到越来越多的关注。Kim 等[35]将CK 与细菌介导的DCY51T-金纳米粒通过非共价键偶联成光热治疗剂,与原料药对比,偶联后的制剂对A549及HT29细胞的毒性显著增强,并更有效地促进了细胞凋亡。Fu 等[36]以阿仑膦酸钠修饰的K7M2 细胞膜及中空的二氧化锰为载体,制备人参皂苷Rh2纳米粒,该纳米粒靶向骨肉瘤组织后可成功释放人参皂苷Rh2,从而激活TME 应用于核磁共振成像,并能有效增强机体的免疫功能。石墨烯作为蜂窝晶格的二维碳纳米材料广泛应用于光热治疗、生物成像及药物递送等领域。Lu 等[37]以叶酸和聚乙二醇修饰的氧化石墨烯(PEG-GO-FA)为载体,以吲哚菁绿(indocyanine green,ICG)为光敏剂,制备人参皂苷Rg3纳米粒(PEG-GO-FA/ICG-Rg3)。与游离的人参皂苷Rg3相比,联用了光动力治疗的PEG-GOFA/ICG-Rg3对骨肉瘤细胞的恶性进展有更显著的抑制作用。此外,氧化石墨烯与人参皂苷Rg3结合(GO-Rg3)可消除人体细胞因氧化石墨烯产生的活性氧,显著降低了氧化石墨烯载体的毒性。Rahimi等[38]基于GO-Rg3设计了pH 响应的载多柔比星纳米递药系统,该载药系统在肿瘤组织的酸性环境中会特异性释放药物,基于靶向释药原理以降低化疗药物多柔比星的使用剂量。综上表明,无机新型多功能纳米材料的发展,对人参皂苷在抗肿瘤领域的应用产生了极大的推动作用,前景值得期待。
4.3 脂质体
近年来,脂质体作为药物递送系统已获得了极大的关注。基于脂质体的双分子层结构,除能提高难溶性药物的溶解度外,还可将药物靶向递送至肿瘤细胞。由白桦酸、小白菊内酯、厚朴酚和人参皂苷Rh2制成的鸡尾酒脂质体不但可以促进肿瘤细胞对制剂的摄取,还能帮助脂质体逃离溶酶体,从而改善癌症治疗效果[39]。为了减少脂质体被单核吞噬细胞摄取,有研究对脂质体表面进行糖基化或利用亲水性物质进行修饰,以减少脂质体与血液中其他成分(如血浆蛋白、调理素等)的结合,降低单核吞噬细胞对脂质体的摄取。Jin 等[40]用肿瘤归巢肽修饰载有小白菊内酯和CK 的长循环脂质体,成功避免了网状内皮系统的非特异性清除,提高了药物在血清中的稳定性,并延长了药物的作用时间,增强抗肿瘤功效的同时降低了药物的毒副作用。
最新研究发现,人参皂苷不仅可作为癌症辅助治疗药物,还可替换胆固醇作为脂质体的载体材料,与抗肿瘤药物协同发挥治疗癌症的作用。研究发现,部分人参皂苷单体(如人参皂苷Rh2)具有与胆固醇相似的甾体结构(图3),可增加磷脂脂肪酰链中的无序构象及氢键缔合,进而促进脂质体中磷脂与人参皂苷紧密排列[41],对脂质体结构有潜在的稳定作用。此外,糖基化的人参皂苷单体对脂质体的性质有显著影响,如人参皂苷的C-3 糖基化可促进人参皂苷与磷脂的连接,有利于脂质体在体内实现长循环;而C-3 和C-6 糖基化可增加肿瘤细胞对脂质体的摄取,显著增强脂质体的肿瘤靶向性[42]。因此,将人参皂苷取代胆固醇作为脂质体的载体材料,不仅能稳定脂质体的结构,还可与化疗药物实现协同抗肿瘤作用。基于此,Hong 等[43]将人参皂苷Rh2替代胆固醇制备紫杉醇(paclitaxel,PTX)脂质体(PTXRh2-lipo)(图3),与传统脂质体相比,PTX-Rh2-lipo的结构更稳定,并能显著延长脂质体在血液中的循环时间,重塑TME;同时,人参皂苷Rh2对PTX 具有化学增敏作用,可逆转肿瘤的耐药性。此外,Zhu等[44]发现人参皂苷Rg3替换胆固醇制备载PTX 的脂质体后,其肿瘤抑制率高达90.3%,远高于普通脂质体的肿瘤抑制率。由此可见,随着对人参皂苷研究的不断深入,其鲜为人知的性能将不断被发掘,在抗肿瘤领域中的应用将进一步扩大。
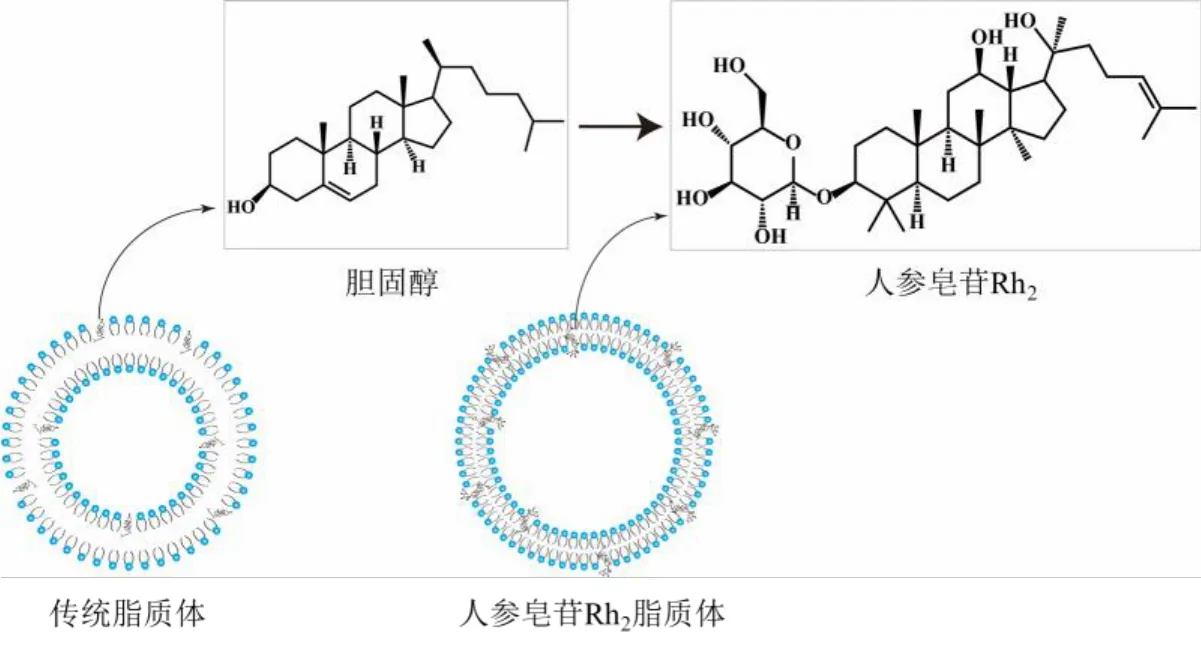
图3 人参皂苷Rh2 替代胆固醇制备的脂质体Fig.3 Liposomes prepared by ginsenoside Rh2 instead of cholesterol
4.4 纳米乳/微乳
纳米乳/微乳具有表面张力低、粒径小、高效分散药物的性能,从而可提高难溶性药物的溶解度和生物利用度。Qu 等[45]将依托泊苷、薏苡仁油和人参皂苷Rh2共分散制成纳米乳/微乳,该纳米乳/微乳体外释药曲线表现出明显的有序释药特性,体内研究显示出快速的肿瘤细胞渗透率以及长效的肿瘤细胞滞留率。以人参皂苷Rg3、灵芝多糖和冬凌草甲素为药物制备的自微乳给药系统(RGO-SMEDDS),与药物的物理混合液相比,RGO-SMEDDS 对肝癌细胞的增殖具有更显著的抑制作用,且安全性及稳定性更好[46]。上述研究表明,基于纳米乳/微乳的剂型优势,人参皂苷部分单体的应用难题可迎刃而解。
5 结语与展望
人参皂苷作为一种多活性的天然药物,其抗肿瘤作用已有较深入的研究,作用机制不仅包括直接抑制肿瘤细胞增殖、侵袭和转移,诱导肿瘤细胞凋亡和周期阻滞,抑制肿瘤新生血管的形成,还能调节机体的免疫功能,间接实现抗肿瘤功效。此外,人参皂苷与化疗药物联用,在逆转肿瘤多药耐药性的同时,最终实现增效减毒的目标。随着人们对人参皂苷研究的不断深入,其进一步的药用价值也逐渐被发现。首先,人参皂苷作为葡萄糖转运蛋白1的底物,其可跨越血脑屏障,对脑胶质瘤的治疗具有特殊的意义。其次,人参皂苷单体具备疏水性的皂苷结构和亲水性的糖基结构,可自组装形成聚合物胶束,对人参皂苷剂型的研究有重要启示作用。最后,部分人参皂苷单体具有类似胆固醇的结构,可取代胆固醇与磷脂相互作用,形成结构更加稳定的脂质体,不仅弥补了传统脂质体结构不够稳定的弊端,还能兼具脂质体自身的剂型优势。因此,人参皂苷在抗肿瘤领域具有极大的应用前景。
然而,人参皂苷的大部分单体水溶性低、半衰期短、稳定性差,导致其生物利用度低,研究者们正试图通过制剂学手段来解决人参皂苷的应用难题,目前已取得了一定的进展。特别在聚合物胶束、纳米粒、脂质体、纳米乳/微乳等纳米药物递送系统方面,人参皂苷的抗肿瘤制剂的研究也在不断深化,力求解决人参皂苷单体自身局限性的同时,保持人参皂苷原有的抗肿瘤作用。尽管目前与人参皂苷相关的纳米药物递送系统还处于临床前研究阶段,但其相关制剂的应用前景不容小觑。进一步完善人参皂苷纳米药物递送系统的药动学研究及安全性评价数据,为人参皂苷的抗肿瘤应用提供有力的证据,是医药学者们共同努力的方向。
利益冲突所有作者均声明不存在利益冲突