经典名方茵陈蒿汤基准样品HPLC 指纹图谱及多指标量值传递研究
肖复耀,桂 郎,曾红玉,刘佳玉,毛 鑫,刘 雨,唐 灿
西南医科大学药学院,四川 泸州 646000
茵陈蒿汤(Yinchenhao Decoction,YD)源于东汉医学家张仲景所著的《伤寒杂病论》,由茵陈、栀子和大黄3 味药配伍而成,具有清热利湿、利胆退黄之功效,疗效确切,组方严谨,用药精简,是治疗阳黄症的经典名方[1]。
方中以茵陈清热利湿、疏利肝胆为君,栀子清泄三焦湿热,兼达退黄之效为臣,大黄通利大便,导热下行为佐。现代临床亦可用于治疗急慢性肝炎、脂肪肝、胆管闭锁症术后、肝硬化和肝衰竭等肝病,以及2 型糖尿病、癌症等疾病[2]。自古以来被众多医家广泛运用,且根据实际病证衍生出许多实用的加减方,更加满足临床实践的需求,对其进行经典名方的开发研究意义重大。
茵陈蒿汤基准样品是在提取工艺“尊古不泥古”的基础上,由其水煎液浓缩冷冻干燥所制,使其在符合传统中药方剂使用形式的同时加以现代技术的应用。但由于中药复方化学成分复杂多样,部分中药材多基原、多产地,药材加工过程有所不同,制剂过程中存在差异,使得质量控制难度较大。目前,对茵陈蒿汤的文献报道多是中药药理及临床应用研究,也有对茵陈、栀子和大黄单味标准汤剂的量值传递研究,尚未见对其复方基准样品量值传递关系分析的相关研究。
本研究通过制备15 批茵陈蒿汤基准样品,对其进行指纹图谱及8 种指标成分的含量测定研究,进行饮片-基准样品量值传递的分析。可为后续经典名方茵陈蒿汤基准样品的相关研究提供实验依据,为后续相关制剂的开发提供借鉴。
1 仪器与材料
1.1 仪器
Shimadzu 型系列高效液相色谱仪,配有LC-2030/2040 PDA Detector,LC-2030 Pump,LC-2030 Autosampler,LC-2030 Oven,株式会社岛津制作所;SB-5200DT 型超声波清洗机,宁波新芝生物科技股份有限公司;ME155DU/02 和ME204E/02 型电子天平,梅特勒-托利多仪器(上海)有限公司;Alpha 1-4 LSCbasic 型冷冻干燥机,Marin Christ 公司;SHZDIII 型循环水真空泵、YRE-2000B 型旋转蒸发器,巩义市予华仪器有限责任公司;800C 型多功能粉碎机,永康市红太阳机电有限公司;C22-WT2202 型多功能电磁炉,广东美的生活电器制造有限公司。
1.2 试药
对照品绿原酸(批号MUST-22111711,质量分数99.82%)、栀子苷(批号MUST-22101813,质量分数99.87%)、芦荟大黄素(批号MUST-22090914,质量分数98.34%)、大黄酸(批号MUST-22111012,质量分数99.10%)、大黄素(批号MUST-22021513,质量分数99.56%)、大黄酚(批号MUST-22110710,质量分数99.46%)和大黄素甲醚(批号MUST-22062811,质量分数99.04%),成都曼思特生物科技有限公司;对照品对羟基苯乙酮,批号111897-201602,质量分数99.90%,中国食品药品检定研究院;甲醇、乙腈、磷酸,色谱纯,Fisher 公司;纯净水,杭州娃哈哈集团有限公司。
于泸州市15 家药房购入此3 味中药,共15 批次,中药饮片均经西南医科大学张春教授鉴定,茵陈为菊科蒿属植物茵陈蒿ArtemisiacapillarisThunb.的干燥地上部分,栀子为茜草科栀子属植物栀子GardeniajasminoidesEllis 的干燥成熟果实,大黄为蓼科大黄属植物掌叶大黄RheumpalmatumL.的干燥根和根茎[3]。茵陈蒿汤基准样品(S1~S15)对应的15 批药材产地组合信息见表1。

表1 15 批茵陈蒿汤基准样品 (S1~S15) 对应饮片来源信息Table 1 Source information of 15 batches of benchmark samples of YD (S1—S15) corresponding to decoction pieces
2 方法与结果
2.1 茵陈蒿汤基准样品的制备
通过前期考证,确定经典名方茵陈蒿汤中3 种饮片的用量及标准汤剂的煎煮工艺[4]。称取茵陈18.0 g,栀子12.0 g,大黄6.0 g。加水720 mL,先加入茵陈,浸泡1 h 后,武火(2200 W)煮沸,再用文火(300 W)煎煮30 min 后,加入栀子、大黄共煎30 min,趁热抽滤;药渣加水650 mL 再煎煮30 min,趁热抽滤,合并2 次滤液,50 ℃减压浓缩至适量,全部转移至西林瓶中,于−20 ℃冰箱中预冷冻12 h 后,置于真空冷冻干燥机(冻干温度−55 ℃,真空度为6 Pa)干燥60 h,即得15 批茵陈蒿汤基准样品(S1~S15)冻干粉样品。
2.2 茵陈蒿汤基准样品指纹图谱方法的建立
2.2.1 色谱条件 Shimadzu Shim-pack Gist C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~10 min,5%乙腈;10~18 min,5%~9%乙腈;18~45 min,9%~10%乙腈;45~50 min,10%~15%乙腈;50~60 min,15%~17%乙腈;60~100 min,17%~25%乙腈;100~110 min,25%~26%乙腈;110~115 min,26%~30%乙腈;115~125 min,30%~40%乙腈;125~140 min,40%乙腈;140~145 min,40%~55%乙腈;145~160 min,55%~70%乙腈;160~170 min,70%~85%乙腈;体积流量1.0 mL/min;柱温30 ℃;检测波长254 nm;进样体积10 μL。
2.2.2 供试品溶液的制备 精密称取茵陈蒿汤基准样品冻干粉约0.5 g 于具塞锥形瓶中,精密加入50%甲醇10 mL,称定质量,超声处理(240 W、40 kHz)30 min,放冷,再称定质量,用50%甲醇补足减少的质量,摇匀,10 000 r/min 离心(离心半径5 cm)5 min 后,取上清液过0.45 μm 微孔滤膜,即得茵陈蒿汤基准样品供试品溶液。
按处方量称取各单味饮片及缺相应饮片的阴性对照复方,按“2.1”项全方标准汤剂基准样品冻干粉制备方法,同法制得单味饮片及阴性对照冻干粉,称取适量各冻干粉制备单味饮片和缺味阴性复方供试品溶液。
2.2.3 对照品溶液的制备 称定绿原酸、栀子苷、对羟基苯乙酮、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚适量,置于棕色量瓶中,加50%甲醇至刻度,摇匀,作为对照品溶液。
2.2.4 指纹图谱方法学考察
(1)精密度试验:取编号为S1 的冻干粉,按“2.2.2”项下制备供试品溶液,按“2.2.1”项下色谱条件,连续进样6 次。以栀子苷为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<0.7%,相对峰面积RSD<3.0%,相似度>0.96,表明仪器精密度良好。
(2)重复性试验:取S1 基准样品冻干粉,按“2.2.2”项下平行制备6 份供试品溶液,按“2.2.1”项下色谱条件进样。以栀子苷为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<0.9%,相对峰面积RSD<4.5%,相似度>0.90,表明方法重复性良好。
(3)稳定性试验:取S1 供试品溶液,按“2.2.1”项下色谱条件,分别于制样后0、3、6、9、12、24 h进样。以栀子苷为参照峰,计算各共有峰相对保留时间和相对峰面积RSD,结果各共有峰相对保留时间RSD<0.8%,相对峰面积RSD<5.0%,相似度>0.95,表明供试品溶液在24 h 内稳定性良好。
2.2.5 指纹图谱的建立 取15 批茵陈蒿汤基准样品,按“2.2.2”项下方法制备成供试品溶液,按“2.2.1”项下色谱条件进样,将所得到的色谱图以.cdf 格式导入《中药色谱指纹图谱相似度评价系统》(2012A)软件中进行评价,以S1 作为参照图谱,采用中位数法,时间窗宽度为0.1 s,进行全谱峰匹配,并生成对照指纹图谱(R),计算相似度。15 批茵陈蒿汤基准样品指纹图谱见图1,相似度结果见表2。从相似度结果可知,15 批茵陈蒿汤基准样品指纹图谱与R的相似度均大于0.900,说明茵陈蒿汤基准样品的制备工艺稳定,不同批次间差异较小。

图1 15 批茵陈蒿汤基准样品指纹图谱Fig.1 Fingerprints of 15 batches of benchmark samples of YD

表2 15 批基准样品指纹图谱相似度Table 2 Similarity of fingerprints of 15 batches of benchmark samples
2.2.6 共有峰的指认及归属 通过与对照品进行比对,共指认了8 个指标成分,结果见图2;分别取各单味饮片及缺味阴性复方供试品溶液,按“2.2.1”项下色谱条件进样,记录色谱图,见图3。结果表明,峰1、6、10、11、13(对羟基苯乙酮)、15、19、20、22 来源于茵陈,峰3、7、8、12(栀子苷)、14、21、23、24、27、28 来源于栀子,峰2、16、17、18、25、26、29~33(芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚)来源于大黄,其中峰4、5、9(绿原酸)为茵陈和栀子所共有。以12 号峰栀子苷为参照峰(S),计算15 批茵陈蒿汤基准样品中各特征峰的峰面积比值和相对保留时间,结果见表3、4。其中18 号峰相对峰面积的比值波动较其他峰更为明显,而所有特征峰的相对保留时间稳定,其RSD 均小于1.5%。

图2 混合对照品与供试品溶液的HPLC 图Fig.2 HPLC chromatograms of mixed reference substances and test solution

图3 茵陈蒿汤单味药及阴性供试品溶液的HPLC 图Fig.3 HPLC of single medicinal material of YD and negative test solution
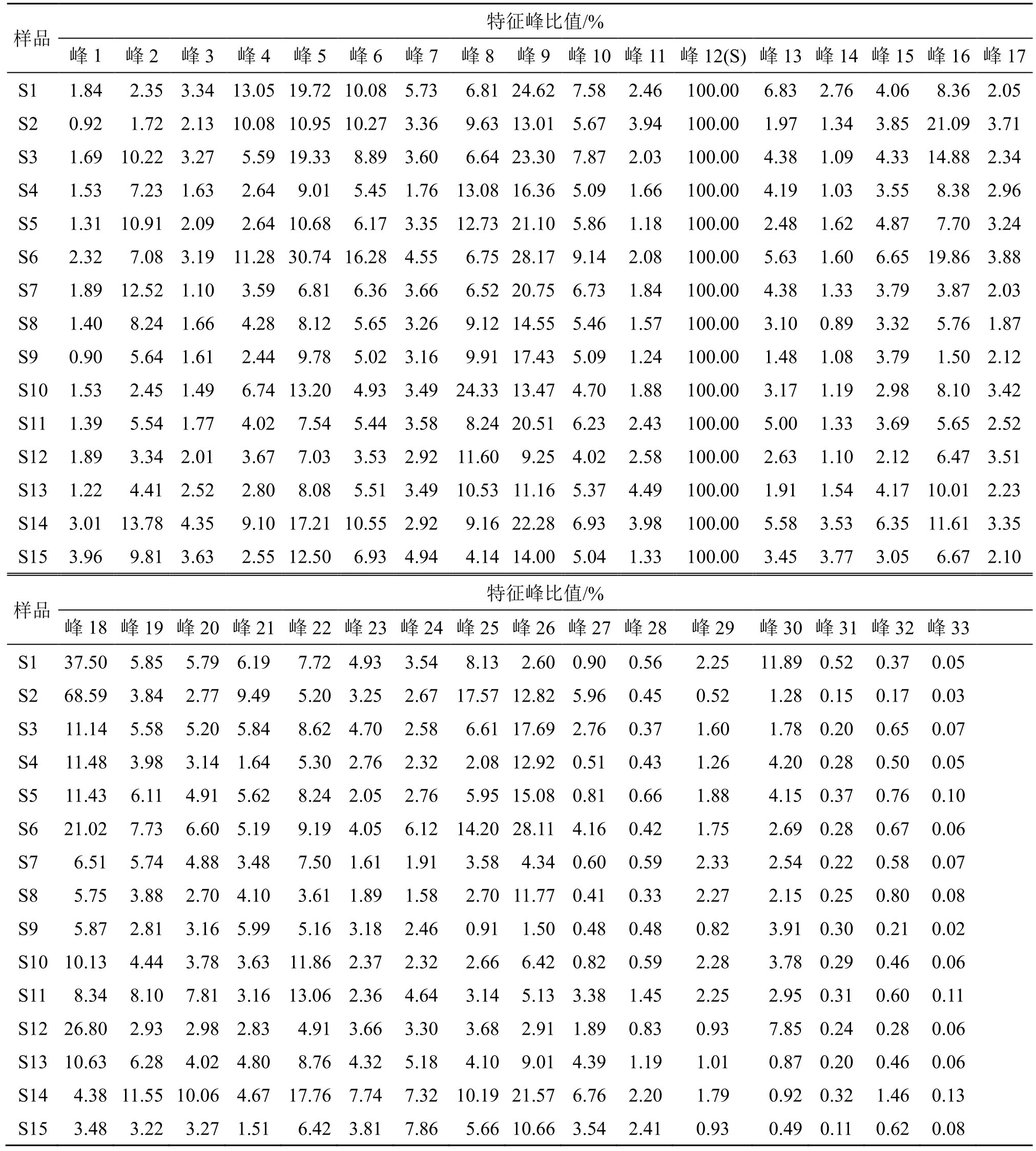
表3 15 批茵陈蒿汤基准样品特征峰比值分析Table 3 Characteristic peaks ratio of 15 batches of benchmark samples of YD

表4 15 批茵陈蒿汤基准样品特征峰相对保留时间分析Table 4 Analysis of relative retention time of characteristic peaks of 15 batches of benchmark samples of YD
2.3 经典名方茵陈蒿汤基准样品指标成分含量测定及量值传递关系研究
2.3.1 色谱条件
(1)HPLC 法测定茵陈中绿原酸含量:色谱柱为Shimadzu Shim-pack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.05%磷酸水溶液(8∶92);体积流量为1.0 mL/min;检测波长327 nm;柱温30 ℃;进样体积10 μL。
(2)HPLC 法测定茵陈中对羟基苯乙酮含量:色谱柱为Shimadzu Shim-pack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.05%磷酸水溶液(15∶85);体积流量为1.0 mL/min;检测波长275 nm;柱温30 ℃;进样体积10 μL。
(3)HPLC 法测定栀子中栀子苷含量:色谱柱为Shimadzu Shim-pack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(10∶90);体积流量为1.0 mL/min;检测波长238 nm;柱温30 ℃;进样体积10 μL。
(4)HPLC 法测定栀子中绿原酸含量:色谱柱为Shimadzu Shim-pack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.05%磷酸水溶液(5∶95);体积流量为1.0 mL/min;检测波长327 nm;柱温30 ℃;进样体积10 μL。
(5)HPLC 法测定大黄中5 种游离蒽醌含量:色谱柱为Shimadzu Shim-pack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.1%磷酸水溶液(80∶20);体积流量为1.0 mL/min;检测波长254 nm;柱温30 ℃;进样体积10 μL。
(6)HPLC 法测定经典名方茵陈蒿汤基准物质中8 种指标性成分含量:色谱柱为Shimadzu Shimpack Gist C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~10 min,5%乙腈;10~18 min,5%~9%乙腈;18~45 min,9%~10%乙腈;45~55 min,10%~20%乙腈;55~85 min,20%~30%乙腈;85~95 min,30%~40%乙腈;95~115 min,40%乙腈;115~120 min,40%~55%乙腈;120~135 min,55%~70%乙腈;135~145 min,70%~85%乙腈;体积流量为1.0 mL/min;绿原酸检测波长327 nm,栀子苷检测波长238 nm,对羟基苯乙酮检测波长275 nm,5 种游离蒽醌检测波长254 nm;柱温30 ℃;进样体积10 μL。
2.3.2 单味饮片供试品溶液的制备
(1)茵陈(绿原酸):取茵陈粉末(过二号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定质量,超声30 min。放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,10 000 r/min 离心(离心半径5 cm)5 min,精密量取上清液5 mL,置25 mL 棕色量瓶中,加50%甲醇置刻度,摇匀,滤过,取续滤液,即得。
(2)茵陈(对羟基苯乙酮):取茵陈粉末(过二号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25 mL,称定质量,超声30 min。放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,10 000 r/min 离心(离心半径5 cm)5 min,取上清液,过0.45 μm 滤膜,即得。
(3)栀子(栀子苷):取栀子粉末(过四号筛)约0.1 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称定质量,超声处理20 min。放冷,再称定质量,用甲醇补足减失的质量,摇匀,10 000 r/min离心(离心半径5 cm)5 min,精密量取上清液10 mL,置25 mL 量瓶中,加甲醇置刻度,摇匀,过0.45 μm 微孔滤膜,即得。
(4)栀子(绿原酸):取栀子粉末(过四号筛)约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇20 mL,称定质量,超声处理30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,10 000 r/min 离心(离心半径5 cm)5 min,取上清液,过0.45 μm 微孔滤膜,即得。
(5)大黄(5 种游离蒽醌):取大黄粉末(过四号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加入甲醇25 mL,称定质量,90 ℃加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.3 茵陈蒿汤基准样品供试品溶液的制备 同“2.2.2”项。
2.3.4 对照品溶液的制备 精密称取绿原酸对照品适量,加50%甲醇制成质量浓度为251.0 μg/mL 的对照品母液;精密称取栀子苷对照品适量,加甲醇制成质量浓度为230.0 μg/mL 的对照品母液;精密称取对羟基苯乙酮对照品适量,加50%甲醇制成质量浓度为363.0 μg/mL 的对照品母液;精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,加甲醇制成质量浓度分别为44.8、107.2、86.4、38.8、39.0 μg/mL 的对照品母液。
精密称取绿原酸、栀子苷、对羟基苯乙酮适量,加50%甲醇制成质量浓度分别为2 110.0、8 420.0、156.8 μg/mL 的混合对照品溶液;精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚适量,加甲醇制成质量浓度分别为72.8、177.6、41.6、43.2、19.6 μg/mL 的混合对照品溶液;分别精密吸取上述2 种混合对照品溶液各5 mL 至10 mL 棕色量瓶中,混匀,配制成含8 种指标性成分的混合对照品溶液,并逐级稀释,得到7 个系列质量浓度溶液,0.45 μm微孔滤膜滤过,即得。
2.3.5 茵陈蒿汤基准样品的指标成分含量测定方法学考察
(1)专属性考察:按照“2.3.1”项下测定茵陈蒿汤基准物质指标性成分含量方法进行实验,结果供试品溶液中各待测成分色谱峰分离度均大于1.5,符合含量测定要求,其他杂质峰及空白对照溶液对待测成分均无干扰。色谱图见图4。

图4 空白溶剂、混合对照品和供试品溶液HPLC 图Fig.4 HPLC chromatograms of blank solvent, mixed reference substances and test solution
(2)线性关系考察:取“2.3.4”项下的混合对照品溶液,按“2.3.1”项下的色谱条件进样7 个系列质量浓度,建立茵陈蒿汤基准样品中8 种指标性成分的标准曲线。以对照品溶液的质量浓度为横坐标(X),以峰面积积分值为纵坐标(Y)进行线性回归,得线性回归方程:绿原酸Y=30 762.607 7X-44 547.844 8,R2=0.999 9,线性范围16.48~1 055.00 μg/mL;栀子苷Y=14 435.473 7X-120 815.574 7,R2=1.000 0,线性范围65.78~4 210.00 μg/mL;对羟基苯乙酮Y=61 433.289 3X-2 311.712 6,R2=0.999 9,线性范围1.22~78.40 μg/mL;芦荟大黄素Y=45 553.528 3X+3 856.672 4,R2=0.999 8,线性范围0.57~36.40 μg/mL;大黄酸Y=42 859.763 0X+4 336.143 7,R2=1.000 0,线性范围1.39~88.80 μg/mL;大黄素Y=35 958.601 1X+1 111.534 5,R2=0.999 9,线性范围0.32~20.80 μg/mL;大黄酚Y=51 661.595 4X-3 017.304 6,R2=1.000 0,线性范围0.34~21.60 μg/mL;大黄素甲醚Y=31 657.585 6X+574.270 1,R2=0.999 5,线性范围0.15~9.80 μg/mL;结果表明各指标性成分在线性范围内线性关系良好。
(3)精密度考察:取茵陈蒿汤基准样品(S1)供试品溶液,按“2.3.1”项下色谱条件连续进样6 次,分别计算绿原酸、栀子苷、对羟基苯乙酮、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD 分别为0.26%、0.05%、1.96%、0.20%、0.14%、2.29%、0.32%、1.45%,表明系统精密度良好。
(4)稳定性考察:取茵陈蒿汤基准样品(S1)供试品溶液,分别于制备后0、3、6、9、12、24 h按“2.3.1”项下色谱条件进样,分别计算绿原酸、栀子苷、对羟基苯乙酮、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD 分别为0.37%、0.06%、2.13%、0.20%、0.24%、2.54%、0.36%、1.51%,结果表明供试品溶液在24 h 内稳定性良好。
(5)重复性考察:取茵陈蒿汤基准样品(S1)冻干粉,按“2.3.3”项下方法平行制备供试品溶液6 份,按“2.3.1”项下色谱条件分别进样,分别计算绿原酸、栀子苷、对羟基苯乙酮、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚峰面积的RSD分别为1.31%、2.03%、1.18%、0.40%、0.40%、0.40%、1.77%、0.50%,结果表明该方法重复性良好。
(6)加样回收率考察:精密称取6 份已测定指标成分含量的同一批次茵陈蒿汤基准样品(S1)冻干粉约0.30 g,根据样品中8 种指标成分的含量以100%的比例加入各指标成分的对照品,按“2.3.3”项下制备样品溶液,按“2.3.1”项下色谱条件分别进样,分别计算加样回收率及其RSD,结果绿原酸、栀子苷、对羟基苯乙酮、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的平均加样回收率分别为100.52%、97.16%、99.50%、100.06%、97.71%、96.99%、98.06%、97.34%,RSD 分别为3.32%、2.75%、1.19%、0.94%、1.35%、1.66%、1.42%、2.83%,结果表明该方法准确度良好。
2.3.6 15 批茵陈蒿汤基准样品指标成分的含量测定及量值传递关系研究 按照“2.3.3”项下方法制备茵陈蒿汤基准样品供试品溶液,采用“2.3.1”项下色谱条件进样,测定15 批茵陈蒿汤基准样品中指标成分的含量。计算饮片-基准样品中指标成分含量的转移率,结果见表5、6。

表5 茵陈蒿汤饮片-基准样品中绿原酸、栀子苷和对羟基苯乙酮的转移率Table 5 Transfer rate of chlorogenic acid, geniposide and 4′-hydroxyacetophenone in herbal pieces-benchmark samples of YD
转移率=w/W
w为基准样品中指标成分的含量,W为对应批次饮片中指标成分的含量
由表5、6 可知,15 批茵陈蒿汤基准样品中指标性成分绿原酸的质量分数为0.107%~0.282%,转移率为 32.290%~61.345%,平均质量分数为0.199%,平均转移率为49.424%;栀子苷的质量分数为 3.153%~5.757%,转移率为 40.365%~81.823%,平均质量分数为4.109%,平均转移率为65.443%;对羟基苯乙酮的质量分数为0.010%~0.035%,转移率为66.473%~93.596%,平均质量分数为0.021%,平均转移率为84.779%;芦荟大黄素的质量分数为0.008%~0.039%,转移率为7.398%~35.966%,平均质量分数为0.021%,平均转移率为19.269%;大黄酸的质量分数为0.007%~0.147%,转移率为 4.971%~91.091%,平均质量分数为0.051%,平均转移率为40.203%;大黄素的质量分数为 0.003%~0.008%,转移率为 1.841%~16.085%,平均质量分数为0.005%,平均转移率为6.467%;大黄酚的质量分数为0.003%~0.012%,转移率为0.599%~6.922%,平均质量分数为0.007%,平均转移率为2.450%;大黄素甲醚的质量分数为0.001%~0.003%,转移率为0.173%~1.965%,平均质量分数为0.001%,平均转移率为0.883%;15 批基准样品中5种游离总蒽醌的质量分数为0.033%~0.185%,转移率为2.081%~40.274%,平均质量分数为0.085%,平均转移率为12.019%。
2.3.7 出膏率测定 15 批茵陈蒿汤基准样品冻干后记录质量,计算出膏率,结果见表6,结果表明,15 批茵陈蒿汤基准样品出膏率为 23.170%~29.952%,平均出膏率为27.205%,出膏率在均值的85.168%~108.826%,13 批基准样品出膏率在其均值的±10%范围内,其中S1 出膏率低于均值的±10%范围,S5 出膏率略高于均值的±10%范围。

表6 茵陈蒿汤饮片-基准样品中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚和游离总蒽醌的转移率及其出膏率Table 6 Transfer rate of aloeemodin, rhein, and emodin, chrysophanol, physcion and free total anthraquinones in herbal pieces-benchmark samples and its extraction rate of YD
3 讨论
3.1 指标成分的选择及饮片中指标性成分含量测定色谱条件的优化
君药茵陈主要含香豆素、黄酮、有机酸类等,其中有机酸与茵陈的清热利湿、利胆作用相关,有明显的抗病毒、保肝利胆等作用[5-7],《中国药典》2020 年版规定绵茵陈的含量测定项为绿原酸,茵陈提取物的含量测定项还包括对羟基苯乙酮。臣药栀子的主要有效成分是环烯醚萜苷类,其中栀子苷具有利胆、抗炎、镇痛、降低血糖等药理活性[8-9],且为药典规定栀子含量测定项。佐药大黄含蒽醌衍生物类、有机酸类、黄酮类、苷类及鞣质等多种有效成分[10],而蒽醌类具有保肝降酶、利胆等作用,结合蒽醌在高温或持续受热时易分解成游离型蒽醌[11],故此仅先选择游离型蒽醌作为指标性成分。
茵陈蒿较滨蒿而言,以绿原酸等为主要质量标志性成分的含量明显较高,主产于陕西、甘肃、河北等地[12-13]。栀子基原确定,临床常用整个栀子入药,主产区为江西、福建、四川等省[14]。掌叶大黄为大黄的主要栽培种,较其他2 个基原的大黄主产地资源丰富,采收较易,资源易受保证,主产于甘肃、青海和四川等省[15-16]。在对饮片中指标性成分进行含量分析时,按照《中国药典》2020 年版药典中规定的色谱条件进样发现,指标性成分绿原酸、栀子苷及游离蒽醌均未在相应饮片中实现基线分离,分离度不满足含量测定要求,故先进行色谱条件的优化,结果发现改变流动相比例后均可满足含量测定要求。
3.2 基准样品供试品溶液的制备考察
经典名方基准样品,是以古代医籍中记载的古代经典名方制备方法为依据,制备的中药药用物质的标准,其基本形态是冻干品或浓缩浸膏[17],考虑到浓缩浸膏不易保存且大黄部分化学成分热稳定性差[18],因此考虑以冻干品为茵陈蒿汤基准样品的保存形式。
本研究考察了水、25%甲醇、50%甲醇及甲醇对基准样品的复溶效果。发现50%甲醇与水复溶的特征图谱基本一致,可以反映基准样品的整体信息。水和25%甲醇复溶后,样品溶液较为黏稠,即使高速离心数分钟后仍不易通过滤膜,而50%甲醇复溶经离心后上清液易过滤膜。50%甲醇与水复溶的基准样品对指标成分的含量测定影响较小,而甲醇复溶后含量测定影响较大,分析原因可能是甲醇复溶产生较多沉淀影响指标性成分的溶出[19]。综上考虑,最终选择50%甲醇作为基准样品的复溶溶剂。
3.3 基准样品指纹图谱的方法建立
在建立指纹图谱色谱条件时,考察几种不同流动相组成对色谱图的影响,包括乙腈-水、甲醇-水、乙腈-0.1%磷酸水溶液、甲醇-0.1%磷酸水溶液、乙腈-0.2%磷酸水溶液,结果发现流动相使用乙腈比甲醇更易获得平稳基线,水相加入磷酸后分离效果更优,但是磷酸的浓度对样品的分离及响应值的影响不大,故选择乙腈-0.1%磷酸水溶液作为流动相。
本实验采用PDA 检测器在190~800 nm 紫外扫描,结果发现指纹图谱的检测波长以254 nm 处色谱峰最为丰富,且8 个指标成分均得到分离。实验发现基准样品溶液在20%~30%乙腈条件下色谱峰丰富,成分较多,基准样品在含量测定色谱条件下50~80 min 内基线不稳定,分离效果不佳,不能确保指纹图谱的评价效果,故此建立指纹图谱色谱条件时宜适当延长梯度洗脱时间,获得更好的分离效果。15 批次基准样品的指纹图谱与对照图谱的相似度均>0.9,各批次间样品相似度均>0.8,说明茵陈蒿汤基准样品制备工艺稳定,不同批次供试品的主要物质差异较小。
3.4 基准样品的量值传递
对共有峰的归属进行分析时发现有11 个共有峰由大黄饮片传递到基准样品中,茵陈饮片贡献12个共有峰,栀子饮片贡献13 个共有峰,有3 个共有峰为茵陈和栀子所共有。15 批茵陈蒿汤基准样品出膏率为23.170%~29.952%,平均出膏率为27.205%,13 批基准样品出膏率在其均值的±10%范围内,S5略高于均值的±10%范围,S1 低于均值的±10%范围,各批次的出膏率均在其均值的70%~130%,表明制备工艺较为稳定。
以基准样品指标成分转移率在均值的±30%为度量标准,15 批茵陈蒿汤基准样品中对羟基苯乙酮转移率完全达到要求,S7、S11 批次的栀子苷转移率略低于度量标准,S15 批次的绿原酸略低于度量标准,且该3 种指标成分的平均转移率均在45%以上,表明这3 种指标成分可以较为稳定的从相应饮片转移至茵陈蒿汤基准样品中。其中绿原酸的转移率为32.290%~61.345%,平均转移率为49.424%,根据倪丽丽等[20]报道的15 批茵陈标准汤剂中绿原酸的转移率及窦志华等[21]报道的23 批栀子标准汤剂中绿原酸的转移率可得出两药煎煮液混合得到的绿原酸平均转移率大致为48.96%,两者结果相差较小。栀子苷的转移率为40.365%~81.823%,平均转移率为65.443%,窦志华等[21]报道的23 批栀子标准汤剂的相应数据分别为55.30%~95.06%和77.16%,两者结果存在一定偏差,分析可能原因是煎煮过程及单煎与合煎导致的差异。
5 种游离蒽醌的转移率变化差异较大,不同批次游离总蒽醌的转移率在2.081%~40.274%,分析原因可能是在制备过程受饮片差异、煎煮环境等因素影响导致转移率相差较大[18],所购入的15 批大黄饮片中有成块或厚片的不同形式,厚片的大小也不尽相同,后期制剂生产可考虑所用中药饮片的质量一致性或者不同批次饮片混批投料用以保证量值传递的均一性[22-23]。
5 种游离总蒽醌的转移率为2.081%~40.274%,平均转移率为12.019%,戴莹等[19]报道的23 批大黄标准汤剂的相应数据分别为 5.44%~37.95%和11.03%,两者结果差异较小。大黄中游离蒽醌类化合物水溶性较差,转移率较低,大黄素甲醚、大黄酚、大黄素的平均转移率分别为0.883%、2.450%和6.467%,芦荟大黄素为19.269%,大黄酸相对较高,为40.203%。但大体上游离型蒽醌的平均转移率偏低,其主要原因可能是,游离型蒽醌苷元为脂溶性成分,极性较小,水煎液提取效果不理想,已有多篇文献提到标准汤剂中脂溶性成分的转移率低的问题[24]。大黄中游离蒽醌类化合物热稳定性差,随煎煮时间的影响显著,故在后期制剂生产中应改进提取工艺,以提高基准样品的有效成分含量且保证其均一、稳定。
利益冲突所有作者均声明不存在利益冲突