复合酶法提取黄秋葵籽油的工艺优化及抗氧化性能研究
李双芳,夏 琳,刘雨辰,吴博雄,刘生杰,2*,季春艳
(1.阜阳师范大学信息工程学院,安徽阜阳 236041;2.阜阳师范大学 生物与食品工程学院,安徽阜阳 236037)
黄秋葵亦称咖啡秋葵,羊豆角等,是锦葵科草本植物,素有“绿色人参”之称[1]。黄秋葵嫩果荚中含有许多的生物活性物质,如黄酮、低聚原花青素和多糖等,可以促进肠胃的消化与蠕动、改善便秘、滋阴补阳等功能[2-4]。但黄秋葵的荚果成熟期比较短,若不及时采收,果肉的质量会发生改变,纤维物质变多,使其食用价值降低,造成资源浪费,同时制约黄秋葵产业的健康可持续发展。因此,针对老熟黄秋葵果实的开发利用尤为必要。研究表明,在老熟黄秋葵中,籽的含量约占秋葵总重的50%。秋葵籽中油脂含量约18%-20%,与大豆中含油量相当,是一种优质功能性油脂[5-6]。其中富含丰富的必须脂肪酸,且饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)比例接近1∶1∶1 的理想模式[7],因此深入研究和开发黄秋葵籽油加工产业具有重要的研究意义。
目前,油脂的萃取工艺主要有:传统压榨法、浸提法、超临界CO2萃取法和水酶法[8-10]。传统压榨法工艺简单,无溶剂污染,但出油率低,耗能较高,不易在油脂工业中应用;浸提法制油出油率相对较高,有利于大规模生产等优点,但制得毛油杂质较多,且易有溶剂残留,且浸提用溶剂均属易燃易爆试剂,存在一定的安全隐患[11-13]。与传统工艺相比,水酶法呈现出其“安全、高效、绿色”等特点,成为当下油脂提取方法的研究热点[14]。陈选等[15]采用碱性内切蛋白酶制备秋葵籽油,但油脂得率相对较低。因单一酶对油料细胞分解不够彻底,很多油脂仍以复合物的形式与其他成分结合,影响油脂提取率。采用多种酶复配提取能使油料细胞中多种复合物结构破裂,油脂分子从中溶出。目前,尚未有复合酶法对黄秋葵籽油脂提取的相关报道。
本研究以黄秋葵籽为研究对象,采用复合酶法提取黄秋葵籽油,拟考察酶制剂种类、复合酶添加量、料液比、酶解温度、酶解时间等因素对黄秋葵籽油提取率的影响,结合响应面试验设计对水酶法提取黄秋葵籽油工艺进行优化,拟在绿色、安全、环保的基础上,为黄秋葵籽油的提取工艺提供理论依据,以期推动黄秋葵资源的综合利用。
1 材料与方法
1.1 实验原料与试剂
黄秋葵籽(市场销售);纤维素酶(1 万U/g)、β-葡聚糖酶(1 000 U/g)、中性蛋白酶(5 万U/g)、木聚糖酶(10 万U/g)、果胶酶(3 万U/g)、酸性蛋白酶(5 万U/g)、过硫酸钾(AR)、ABTS、DPPH 均为上海麦克林生化科技有限公司;石油醚(60-90℃)(AR)、无水乙醇(AR)为国药集团化学试剂有限公司。
1.2 实验主要仪器
脂肪测定仪(Sox406):山东海能科学仪器有限公司;电热恒温鼓风干燥箱(DGT-G 系列):合肥华德利科学器材有限公司;恒温水浴锅(HH-4J):金坛市杰瑞尔电器有限公司;离心机(H5-25KR):湖南可成仪器设备有限公司;粉碎机(BJ-800A):德清拜杰电器有限公司;摇床(ZWYR-211D):上海智城分析仪器制造有限公司;紫外-可见分光光度计(UV-1950):北京普析通用仪器有限责任公司
1.3 实验方法
1.3.1 黄秋葵籽油提取工艺流程
黄秋葵籽→粉碎过筛(60 目)→加蒸馏水→灭酶(90℃,10 min)→冷却后调pH→加酶于摇床中酶解→冷却后加石油醚→离心(5 500 r/min,30 min)→分离→蒸发石油醚→清油
1.3.2 黄秋葵籽油提取率的计算
(1)式中:W 为黄秋葵籽油提取率(%);m1为清油质量,g;m2为黄秋葵籽粉质量,g;m3为黄秋葵籽中粗脂肪含量,g。
1.3.3 黄秋葵籽中粗脂肪含量测定
参照GB 5009.6-2016《食品中脂肪的测定》中索氏提取法对黄秋葵籽中粗脂肪含量进行测定。
1.3.4 酶种类的筛选
在料液比1∶5、酶解时间3 h、酶添加量3%下,考察纤维素酶、β-葡聚糖酶、中性蛋白酶、木聚糖酶、果胶酶、酸性蛋白酶在最适温度与pH 下,对黄秋葵籽油提取率的影响。在单一酶制剂筛选的基础上,选择酶解最适条件接近且提取率较高的两种酶复配。
1.3.5 单因素试验
以黄秋葵籽油提取率为评价指标,确定最佳复合酶种类后,在其他条件不变的情况下,分别考察料液比、复合酶的添加量、酶解时间、酶解温度、pH 对秋葵籽油提取率的影响。
1.3.6 响应面法优化试验
在单因素试验的基础上,固定复合酶为酸性蛋白酶+纤维素酶(1∶1),酶解温度55 ℃,酶解pH 为4.0,选取对黄秋葵籽油提取率影响较大的三个主要影响因素,以黄秋葵籽的提油率为响应值,采用Box-Behnken 中心组合法设计响应面试验,试验因素水平表见表2。
1.3.7 抗氧化活性的测定
(1)DPPH 自由基清除能力测定[16]
取1.00 g 秋葵籽油,用无水乙醇分别稀释至20 倍,40 倍,80 倍,120 倍,160 倍,200 倍,得到不同浓度梯度的秋葵籽油-乙醇溶液,再分别取5 mL秋葵籽油-乙醇溶液(空白组用无水乙醇代替)加入已经配置好的等体积的0.2 mmol/L DPPH 溶液,充分混合后,在室温下避光反应30 min,后用无水乙醇进行调零,于517 nm 波长下来测定样品的吸光度,各秋葵籽油做3 组平行测定,取均值。以相同浓度VC 作为对照组。
式中:A 为秋葵籽油样品吸光度;A0为秋葵籽油样品本底吸光度;A1为空白样品吸光度。
(2)ABTS 自由基清除能力的测定[16]
ABTS 工作液的制备:取5 mLABTS 储备液(7 mmol/L)与88 μL 过硫酸钾溶液(140 mmol/L)充分混合,在25 ℃下避光反应14 h。将反应液用无水乙醇稀释,使其在734 nm 波长下的吸光度为0.70±0.02,得到ABTS 工作液。
取4mLABTS 工作液,分别加入0.50 mL 不同浓度(取1.000 g 秋葵籽油,用无水乙醇分别稀释20,40,80,120,160,200 倍)秋葵籽油乙醇溶液(空白试验用等量无水乙醇代替),混匀后于25 ℃下避光反应30 min,在734 nn 波长下测定吸光度,各试样做3 组平行。以相同浓度VC 作为对照组。
式中:A 为秋葵籽油样品吸光度;A0为秋葵籽油样品本底吸光度;A1为空白样品吸光度。
1.3.8 数据处理
单因素试验结果分析图用Origin 2019b 软件绘制,显著性分析采用SPSS 2021 软件分析;响应面试验设计及分析采用Design Expert 8.0.6 软件。
2 实验结果与分析
2.1 酶制剂的筛选
2.1.1 单一酶种类的筛选
称取10 g 黄秋葵籽粉,按照料液比1∶5 添加去离子水,调节提取温度和pH 至各酶的最适条件(参照表1),分别加入3%的酶,混匀后放入摇床,在6 种酶最适条件下提取3 h,考察6 种酶对黄秋葵籽油提取率的影响,结果如图1 所示。添加酶制剂后,均能显著提高黄秋葵籽油的提取率(P<0.05),其中提油效果最好的为中性蛋白酶(19.69% ± 1.22%)和酸性蛋白酶(19.28% ±0.12%),纤维素酶(13.6%±1.4%)提取效果次之,其次是β-葡聚糖酶(11.4% ± 0.37%)和果胶酶(11.18%±0.9%),木聚糖酶提油率较低(7.08%±0.32%),后续复配试验舍弃该酶。这是因为植物种子细胞壁中主要成分为纤维素、木质素、果胶等,油脂通常与其他大分子物质结合构成脂多糖、脂蛋白等复合物,加酶后,可有效瓦解细胞壁结构,破坏脂蛋白、脂多糖复合物结构,使油脂有效地释放出来,从而提高了提油率[17]。但由于酶具有专一性,单一酶提油效果仍较差,为进一步提高油脂提取率,发挥复合酶的协同作用,选用提油率较高、提取条件接近的酶复配进行酶解。

图1 酶种类对黄秋葵籽油提取率的影响

表1 各种酶的最适温度与最适pH

表2 响应面设计试验因素水平表
2.1.2 复合酶种类的筛选
将空白对照作为组1,因酸性蛋白酶和果胶酶的最适温度(50℃)和pH(3.5)相同,设为组2;同理,设中性蛋白酶+β-葡聚糖酶为组3(提取温度50℃,pH 为6.0)、酸性蛋白酶+纤维素酶为组4(提取温度50℃,pH 为4.0)、纤维素酶+果胶酶为组5(提取温度50℃,pH 为4.0)、纤维素酶+β-葡聚糖酶为组6(提取温度50℃,pH 为5.0),各组酶添加比例均为1∶1,酶添加总量为3%,料液比1∶5 条件下提取3 h,考查不同酶复合对黄秋葵籽油提取率的影响,结果如图2 所示。酸性蛋白酶+纤维素酶复配时,黄秋葵籽油提取率最高(44.6%±1.09%),显著高于其他复合酶提油效果(P<0.05)。这是因为纤维素酶的存在,能有效破坏黄秋葵籽的细胞壁结构,使酸性蛋白酶能充分接触并分解包埋在细胞壁内的脂蛋白,两者发挥协同作用,将包埋在细胞壁内的油脂尽可能多的释放出来[18]。因此后续试验选用酸性蛋白酶+纤维素酶(1∶1)作为油脂提取的复合酶。

图2 不同复合酶对黄秋葵籽油提取率的影响
2.2 单因素试验结果分析
2.2.1 复合酶添加量的确定
固定料液比为1∶5、酶解温度为50℃、酶解pH 为4、酶解时间为3 h 的条件下,考察复合酶(酸性蛋白酶+纤维素酶,1∶1)添加量对黄秋葵籽油提取率的影响,结果见图3。随着复合酶添加量增加,酶与黄秋葵籽粉更充分接触,使得黄秋葵籽油提取率不断上升,当酶添加量为4%时,黄秋葵籽油提取率最高(47.55%±0.65%),显著高于其他组(P<0.05)。当酶添加量继续增加时,提取率反而下降,可能是由于过多的酶会对油脂产生吸附作用,使提油率略有下降[19]。因此,后续试验将复合酶添加量固定为4%。
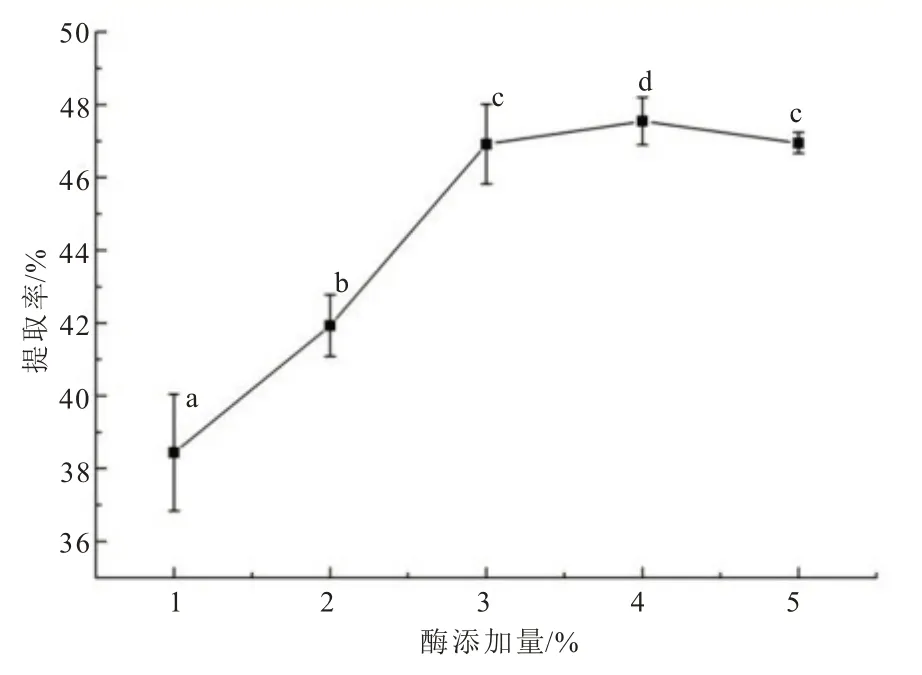
图3 复合酶添加量对黄秋葵籽油提取率的影响
2.2.2 料水比对黄秋葵籽油的提取率影响
在纤维素酶+酸性蛋白酶复合酶(1∶1,酶添加总量为4 %)、酶解温度为50℃、酶解pH 为4.0、酶解时间3 h 条件下,考察不同料水比对黄秋葵籽油提取率的影响,结果如图4 所示。提油率随着料水比增加,呈先上升后下降趋势,当料水比为1∶4 时,提油率最高(50.27% ± 0.008%)。料液比过高或过低时,均不利于秋葵籽油提取,分析原因是由于加水量较低时,提取液相对黏稠,不利于酶与大分子物质充分接触,加水量过高时,提取液太稀,也减少了酶与油料分子的接触机会,降低了酶解速率[20]。因此,将料水比1∶4 作为复合酶提取黄秋葵籽油的最佳比例。
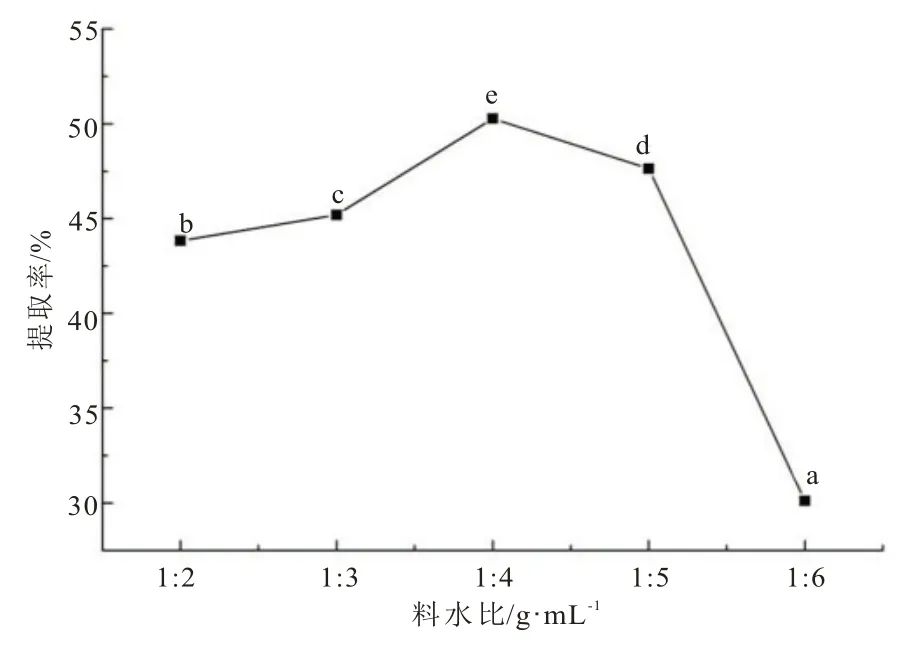
图4 料水比对提取黄秋葵籽油的影响
2.2.3 酶解pH 对黄秋葵籽油的提取率影响
在纤维素酶+酸性蛋白酶复合酶(1∶1,酶添加总量为4%)、酶解温度50℃、酶解时间3 h、料水比1∶4 条件下,考察pH 在3.0~5.0 范围内对秋葵籽油提取率的影响。如图5 所示,在此范围内,提油率随着pH 增加,呈先上升后下降趋势。当pH为4.5 时,提油率为43.55%±1.46%,显著高于其他pH(P<0.05),说明此条件下复合酶的活力较高。因此,确定pH 4.5 为复合酶提取黄秋葵籽油提取的最佳pH。
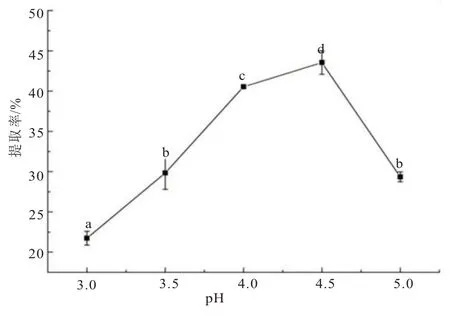
图5 酶解pH 对提取黄秋葵籽油的影响
2.2.4 酶解温度对黄秋葵籽油的提取率影响
在纤维素酶+酸性蛋白酶复合酶(1∶1,酶添加总量为4%)、料水比1∶4、酶解pH 4.0、酶解时间3 h 的条件下,考察酶解温度对黄秋葵籽油提取率的影响,结果如图6 所示。黄秋葵籽油提取率随着酶解温度升高,上升后下降,在酶解温度为55℃时的提油率最高,达到52.1%±0.09%,温度继续升高时,提取率反而下降,分析原因为温度升高会使复合酶的活性受到影响,进而影响破壁程度,减缓油脂提取速率。因此,确定酶解温度55℃为复合酶提取黄秋葵籽油最适酶解温度。

图6 酶解温度对黄秋葵籽油提取率的影响
2.2.5 酶解时间对黄秋葵籽油的提取率影响
在纤维素酶+酸性蛋白酶复合酶(1∶1,酶添加总量为4%)、料水比1∶4、酶解pH 4.0、酶解温度55℃条件下,考察酶解时间对黄秋葵籽油提取率的影响,结果如图7 所示。酶解时间从1 h 到3 h时,提油率逐步上升,当酶解时间为3 h 时,提油率为52.29%±0.01%,3 h 之后提油率逐渐下降。这是因为在合适的酶解时间内,酶可以完全作用破坏细胞壁结构,提取率相对较高。当酶解时间不足时,酶解不完全,提油率较低;当酶解时间较长时,会增加蛋白质与油脂发生乳化反应,降低游离油含量[21]。因此,确定酶解时间3 h 为复合酶提取黄秋葵籽油的最佳酶解时间。
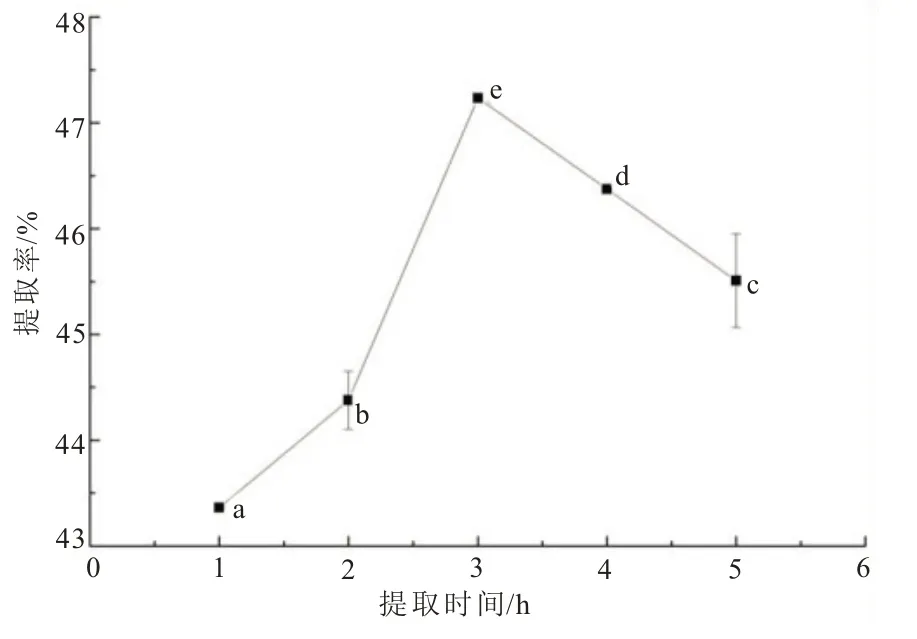
图7 酶解时间对黄秋葵籽油提取率的影响
2.3 响应面分析法优化黄秋葵籽油提取工艺
2.3.1 响应面试验设计结果分析
在单因素试验基础上,固定水酶法提取油脂的复合酶为纤维素酶+酸性蛋白酶(1∶1)、酶解pH 为4.5,酶解温度为55℃。以黄秋葵籽提油率(Y)为响应值,选取料水比(A)、酶添加量(B)、酶解时间(C)三个因素作为自变量,结合Box-Behnken 中心组合设计三因素三水平优化试验,具体结果见表3。
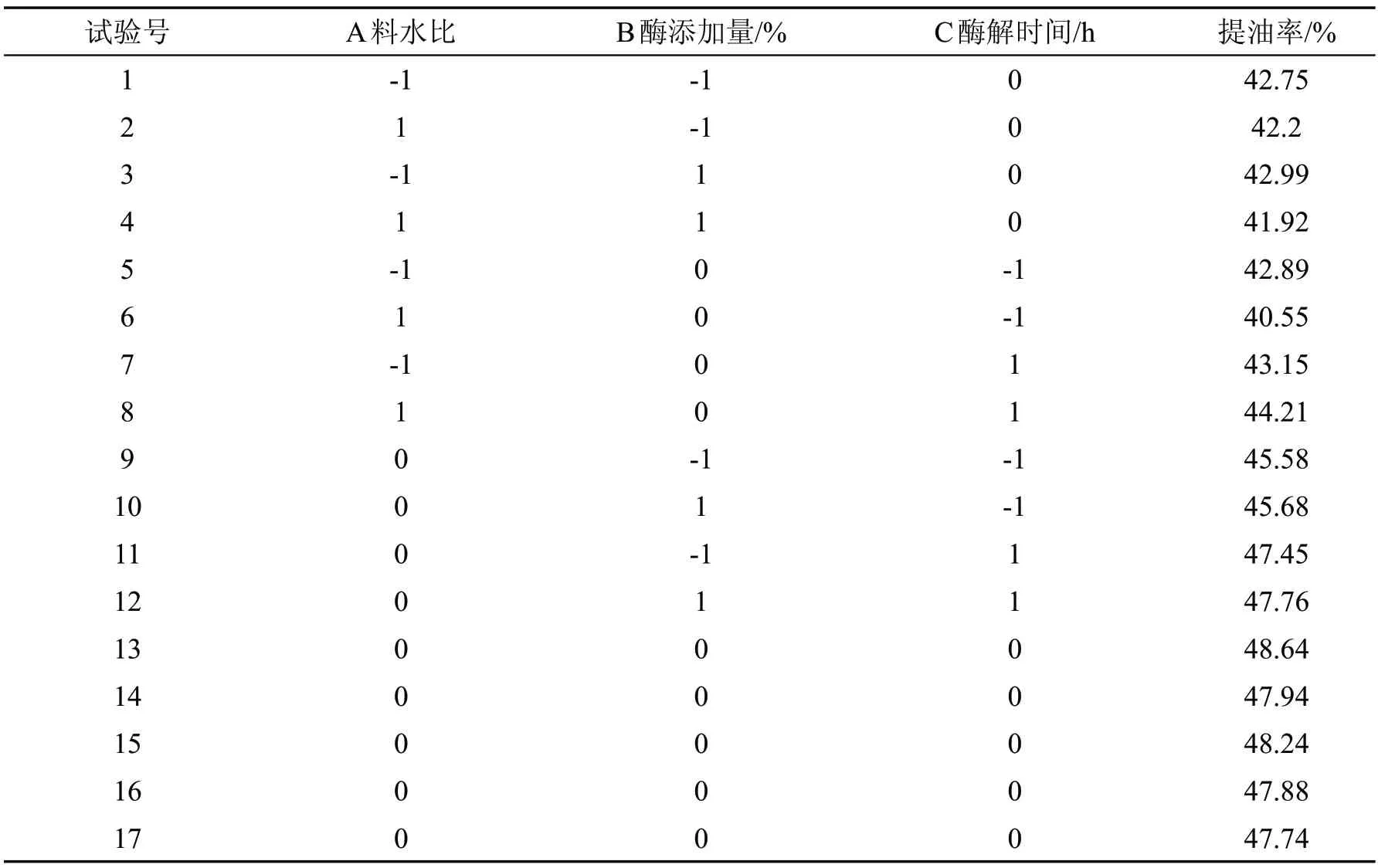
表3 响应面试验设计及结果
2.3.2 响应面回归模型及方差分析
对表3 试验数据进行回归拟合,得到二次多项回归方程为:
对模型进行方差分析,结果如表4 所示。回归模型(P<0.0 001)显著,且失拟项(P>0.05)不显著,说明可用此模型具有可信性,可以用来对试验结果进行分析和预测。模型回归系数R2为0.9 985,R2pred为0.9 817,表明模型预测值与实验结果之间有良好的拟合性,校正后模型的回归系数R2Adj为0.9 966,表明测试值与校正值之间较接近,有良好的拟合性。
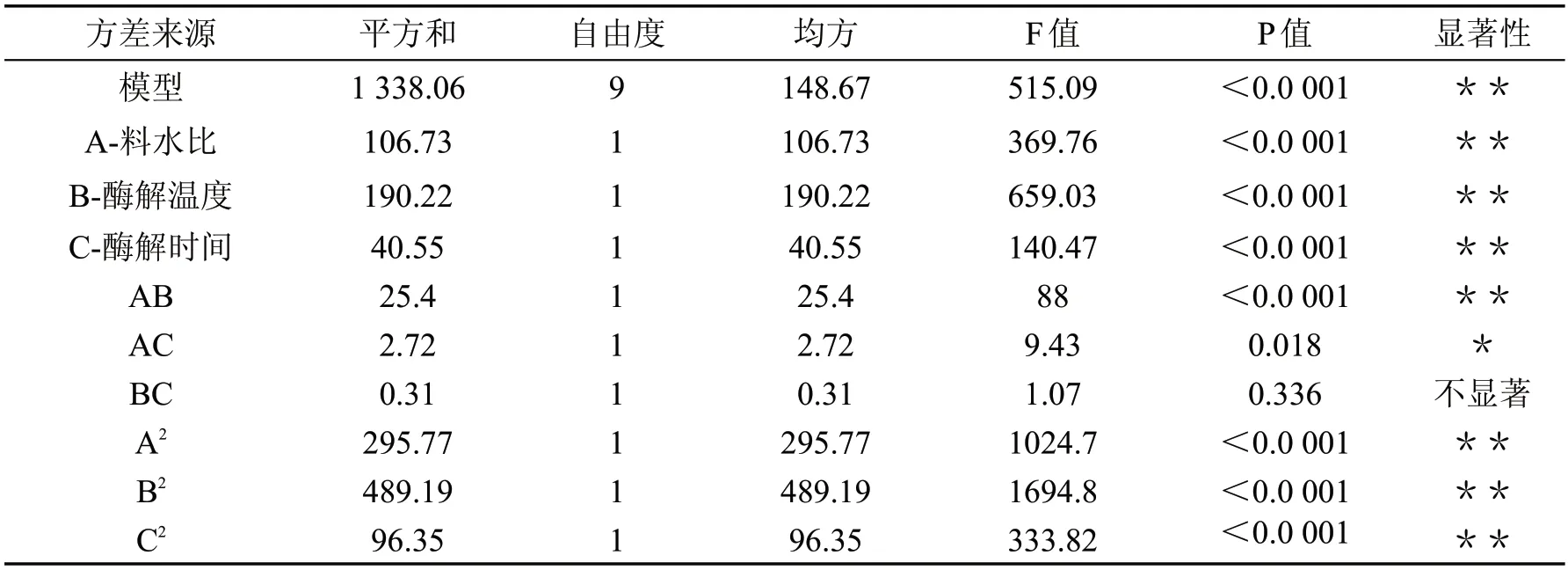
表4 响应面回归模型方差与显著性分析
由F 值可知,三个因素对黄秋葵籽油提取率影响次序分别为B(酶添加量)>A(料水比)>C(酶解时间)。另外,由P 值可知,A、B、C 及AB、A2、B2、C2对黄秋葵籽油的提取率均有极显著影响(P<0.01)。
2.3.3 响应面交互作用分析及最优条件的确定
响应面的坡度反映了各因素之间的相互作用与其对应响应值的敏感程度,坡度越陡峭表明2个因素之间的交互作用对其响应值的影响越显著。以黄秋葵籽油提取率为响应值,分析3 个因素之间的两两交互作用,由图8 中三组响应面图及等高线图可以看出,A(料液比)和B(酶添加量)两两交互作用时得到的响应面坡度较为陡峭,等高线图接近椭圆形,AC、BC 两两交互作用时,响应面坡度较平缓。因此判断因素A(料液比)和因素B(酶添加量)之间交互作用更强。


图8 各因素交互作用对黄秋葵籽油提取率的影响
通过Design Expert 8.0.6 软件对秋葵籽油最佳提取工艺预测分析,并考虑到实际的操作,最终得到水酶法提取黄秋葵籽油的最佳工艺条件为:料液比1∶4(g/mL)、酶添加量为4.25%、酶解时间为3.25 h,在此条件下提取率为54.93%。为进一步验证模型的可靠性,在此条件下进行3 次平行试验验证,得出黄秋葵籽油的提取率为(56.56 ±0.58)%,与预测值接近,表明优化后得出的参数条件是可靠的,所建响应面模型有效。
2.4 黄秋葵籽油抗氧化能力
2.4.1 黄秋葵籽油对DPPH 自由基的清除能力
DPPH 自由基为一种相对稳定的自由基,在波长517 nm 处有最大吸收,当自由基清除剂存在时,DPPH 自由基中单电子被捕获,在最大吸收波长处吸光值减小,且减小程度呈线性关系[22]。
由图9 可知,随着黄秋葵籽油浓度的不断增加,对DPPH 自由基的清除能力不断升高。在浓度为5 mg/mL 时,VC 的自由基清除能力更强,对DPPH 自由基清除能力就大于90%,远高于秋葵籽油的清除能力(58.32% ± 0.13%)。但在5~25 mg/mL 范围内,随着黄秋葵籽油浓度增加,其清除DPPH 自由基能力逐渐加快,之后趋势趋于平缓。当秋葵籽油浓度为50 mg/mL 时,对DPPH 自由基的清除能力最高可达95.25% ± 0.32%,与相同浓度下,VC 对DPPH 自由基清除能力较接近,分析可能与秋葵籽油中含有一定量的不饱和脂肪酸及维生素E 有关。

图9 黄秋葵籽油对DPPH 自由基的清除能力
2.4.2 黄秋葵籽油对ABTS 自由基的清除能力
ABTS 自由基储备液为深蓝色,在734 nm 处有吸收,当加入具有自由基清除剂的物质后,储备液颜色变浅,吸收强度会减少,减少幅度也呈线性关系[22]。ABTS 自由基是如图10 可知,黄秋葵籽油对ABTS 自由基清除能力随着其浓度增加不断升高,说明秋葵籽油在清除自由基能力方面具有一定作用。当秋葵籽油浓度为5 mg/mL 时,其清除ABTS 自由基的能力仅有15.26% ± 0.23%,相同浓度下的VC 对ABTS 自由基的清除能力达到95.3%±0.22%;当秋葵籽油浓度上升到50 mg/mL时,其对自由基清除能力可提升到76.46% ±0.88%,与VC 对ABTS 自由基清除能力逐渐接近。表明秋葵籽油具备抗氧化能力,且与其中含有不饱和脂肪酸及维生素E 有一定关系。
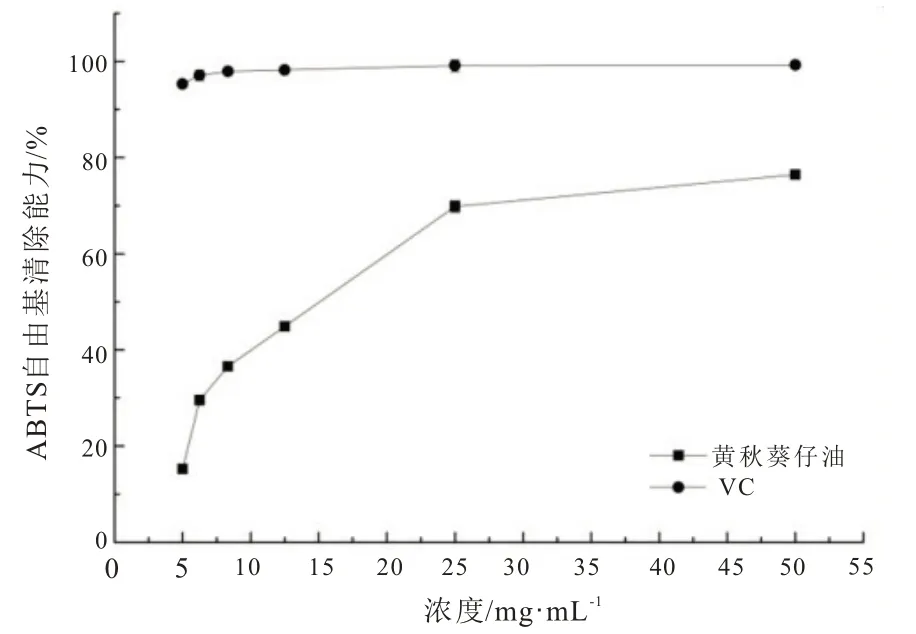
图10 黄秋葵籽油对ABTS 自由基清除能力
3 结论
复合酶作用于黄秋葵籽粉,可使油料细胞破裂更充分,更彻底,从而提高油脂提取率。本研究首先通过单因素试验筛选出纤维素酶+酸性蛋白酶(1∶1)作为水酶法提取黄秋葵籽油的复合酶。再通过单因素试验及响应面优化分析法对水酶法制取黄秋葵籽油工艺进行探索,得出水酶法萃取黄秋葵籽油的最优条件为:酶解温度55℃、酶解pH 为4.0、料液比1∶4、酶添加量为4.25%、酶解时间为3.25 h。在此条件下,黄秋葵籽油的提取率为(56.56±0.58)%,与陈选[15]通过单一碱性蛋白酶提取秋葵籽油(提取率14.25%±0.06%)及姚宏亮[23]通过溶剂法萃取秋葵籽油(24.88%±0.12%)相比提取率较高。秋葵籽油对DPPH 自由基和ABTS自由基均有一定的的清除能力,其中当秋葵籽油浓度为50 mg/mL 时,对DPPH 自由基的清除能力可达到95.25%,与相同浓度下,VC 对DPPH 自由基清除能力接近。该研究为黄秋葵籽油的水酶法提取工艺提供了理论支持和技术依据,为黄秋葵籽资源的综合利用提供参考。

