AIM2炎性小体与胸腔镜下肺叶切除术肿瘤患者单肺通气相关肺损伤的关系及预测价值*
宗宇红 王磊 杜小兵 尹翔宇 许紫舸 王曼 朱蕾
(1.保定市第一中心医院麻醉科,河北 保定 071000;2.河北大学附属医院麻醉科,河北 保定 071000)
急性肺损伤(Acute lung injury,ALI)是胸腔镜下肺叶切除术患者术后死亡的主要原因,具有发病率高 (2%~5%)和死亡率高的特点(约25%)[1-2]。除了手术本身原因,单肺通气相关肺损伤被认为是导致术后急性肺损伤的重要原因之一。目前认为是由于伤害性通气模式(高潮气量、高峰值吸气压、高吸入氧浓度等)引起的炎症介质释放所致。特别是在单肺通气(One-Lung Ventilation,OLV)中,机体依靠一侧肺进行氧合,导致肺内解剖分流增多,引起缺氧肺损伤[3]。人畜实验研究表明,即使采用保护性通气策略(低潮气量、低吸气峰压、降低吸入氧浓度等),也不能完全阻止肺组织中炎症介质的产生和肺损伤的发生[4-5]。因此为了预防术后单肺通气相关肺损伤的发生,需要明确术后单肺通气相关肺损伤的风险因素。黑色素瘤缺如因子2(Absent in melanoma 2,AIM2)炎症小体分布于细胞胞浆中,是AIM2与可募集含有CARD结构域的凋亡相关颗粒样蛋白(ASC)及pro-Caspase1形成的一种多蛋白复合体,这一复合体可进一步活化Caspase1蛋白从而激活细胞质中的IL-1β及IL-18诱发炎症反应。研究发现,AIM2炎症小体与肺损伤有密切联系[6],但AIM2炎性小体是否是胸腔镜下肺叶切除术患者单肺通气相关肺损伤的风险因素,国内外研究鲜见相关报道,因此本研究拟评价肺组织AIM2炎性小体与胸腔镜下肺叶切除术患者单肺通气相关肺损伤的关系及预测价值。
1 资料与方法
1.1 一般资料 选取2019年9月—2021年12月保定市第一中心医院和河北大学附属医院择期全麻下拟行胸腔镜下肺癌行肺叶切除术的肺癌患者750例。纳入标准:①ASA分级I或II级。②年龄40~80岁。③性别不限。④体重40~90 kg。排除标准:①BMI>25 kg/m2。②脑外伤、脑出血、脑梗塞病史,NYHA分级Ⅲ-Ⅳ级。③肝肾功能异常患者。④酗酒滥用药物史。⑤精神心理疾病病史,且近期未服用抗精神病药物。⑥凝血功能异常或血小板减少患者。⑦既往曾接受放疗、化疗或免疫治疗的患者。⑧全身或局部感染(包括C反应蛋白升高、白细胞增多或体温>38 ℃)。⑨影响下肢的周围血管疾病。⑩过去3个月服用维生素、非甾体抗炎药物或糖皮质激素的患者。受试者中途拒绝继续配合试验或者死亡。实验室检查值因各种原因出现明显异常者。各种原因导致未严格执行试验方案者。围术期发生严重的良事件,如心律失常、气道插管困难、过敏性的休克等。本研究中25例患者手术暂停,27例患者不同意进行本研究,12例术中大出血,8例术中出现恶性心律失常,最终纳入678例胸腔镜下肺癌手术患者。本研究已在中国临床研究注册中心注册(临床注册号:ChiCTR1900025040)。经伦理委员会批准后,术前与入选本研究的患者及家属签署知情同意书。
1.2 方法
1.2.1 麻醉方法 将患者转移至手术室时,开放外周静脉、右颈内静脉、桡动脉并将导管连接起来。心电图(导联II和V5)、有创性血压、中心静脉压、心率、双谱指数(BIS)。异丙酚按照Marsh药代动力学模型靶控输注(Graseby 3500;史密斯医疗,沃特福德,英国),最初的目标浓度0.1μg /mL时逐步增加到0.3 μg /mL直到BIS值 40~55,0.03 mg/kg咪达唑仑,1 mg/kg顺阿曲库铵和0.5 μg/kg舒芬太尼静脉注射。双腔支气管内插管后,使用循环容积模式,设置潮气量8 mL/kg,吸气与呼气的比例为1∶2,呼吸频率为12次/min。持续输注丙泊酚和瑞芬太尼维持麻醉,必要时给予舒芬太尼和顺阿曲库铵。通过改变异丙酚浓度,使BIS值在整个手术过程中维持在40~60之间。手术前将通气模式改为单肺通气,调整频率10次/min和潮气量7 mL/kg以维持脉搏血氧饱和度90%以上和ETCO2<30 mmHg。丙泊酚和瑞芬太尼在皮肤缝合后停用。给予新斯的明(20 μg /kg)和阿托品(5~10 μg /kg)拮抗肌松。患者恢复自主呼吸拔管后进麻醉后监护病房(Postanesthesia care unit,PACU)。患者根据Steward评分>4后从PACU中移出。术中保持患者血流动力学稳定,SP、DP、HR波动范围不超过基础值的20%。术毕均连接自控镇痛泵(Abbott公司,美国)行PCIA,维持静态VAS评分<3分,镇痛药配方:诺扬10 mg,使用生理盐水稀释到100 mL,负荷量为2 mL,背景输注速率为2 mL/h,PCA剂量为0.5 mL,锁定时间为15 min。在麻醉的影响下,平均动脉压(MAP)维持在基线值的-20%到+20%之间。低于基线图20%或MAP<60 mmHg持续超过30秒被定义为低血压。当给予静脉注射液体疗法效果不满意时静脉给予去氧肾上腺素(40μg)。静脉注射阿托品(0.3 mg)治疗心动过缓(心率<60 bpm)。静脉注射麻黄素(3~6 mg)治疗心动过缓和低血压。
1.2.2 ALI诊断标准 用急性呼吸窘迫综合征(Adult respiratory distress syndrome,ARDS)来描述开胸术后的ALI。采用2006年中华医学会重症医学分会《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南》提出的诊断标准[7]:①急性起病。②氧合指数(PaO2/Fi02)≤200 mmHg[不考虑呼气末正压(PEEP)水平]。③胸部正位X线片显示双肺均有斑片状阴影。④如氧合指数(OI=PaO2/FiO2)≤300 mmHg且满足上述其他标准,可诊断为急性肺损伤。根据患者是否发生急性肺损伤,将患者分为两组:单肺通气肺损伤组(I组)和单肺通气非肺损伤组(NI组)。
1.2.3 观察指标 由经过专业培训的研究人员进行术前、术后随访并记录相关信息,参与术中管理的临床医生与研究人员互不知情。术前采集患者一般资料包括:年龄、性别、BMI、术前化疗史、基础合并症[慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)等]、ASA分级、吸烟史、术前肺功能及弥散功能指标[包括FEV1/FVC]。术中采集患者一般资料包括:单肺通气时间、PEEP和手术时间(从手术切口到皮肤闭合)。
1.2.4 样本采集 单肺通气30 min后切除肺叶时取远离病变处>8 cm以上肺组织两块分别取5 mm×5 mm×5 mm标本,放入-80 ℃冰箱保存。一块肺组织HE染色后BX4l型显微镜(Olympus公司,日本)观察肺病理学损伤。一块采用Western blot法检测肺组织黑色素瘤缺如因子2(AIM2),凋亡相关微粒蛋白(ASC)和半胱天冬酶-1前体(pro-Caspase1)的表达。取肺组织加入RIPA裂解缓冲液和蛋白酶抑制剂PMSF(碧云天生物试剂研究所),于冰面进行充分的研磨、裂解、离心,取上清液加入适量蛋白质上样缓冲液(5×)(碧云天生物试剂研究所)100 ℃加热5 min,使用12%的聚丙烯凝胶电泳分离蛋白。转移到PVDF膜(北京索莱宝科技有限公司)上,用5%脱脂奶粉在室温摇床封闭3 h,用TBST冲洗后分别加入内参抗体β-actin(1∶6 000)、AIM2一抗(1∶1 000), ASC一抗(1∶1 000),pro-Caspase1一抗(1∶500),均购自美国Cell Signaling公司。4 ℃孵育过夜。TBST洗膜5min×3次,辣根过pro-Caspase1氧化物酶标记的二抗(稀释度1∶2 000,Jackson公司,美国)室温孵育2 h。TBST洗膜15 min×5次。于化学发光检测试剂反应2 min,取出膜,甩去多余的液体,用保鲜膜包好PVDF膜.暗室中用X胶片感光、显影、定影。采用凝胶图像Image J软件(NIH公司,美国)分析蛋白条带灰度值,以目的蛋白条带灰度值与内参β-actin条带灰度值的比值反映其表达水平。
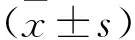
2 结果
2.1 纳入患者 本研究最终纳入678例胸腔镜下肺癌手术患者。术后单肺通气肺损伤的发生率是16.9%。
2.2 对I组和NI组的一般情况进行比较 其中性别、BMI、术前化疗史、COPD、ASA分级、吸烟史、低蛋白血症和PEEP比较,差异均无统计学意义(P>0.05)。I组和NI组年龄、FEV1/FVC、单肺通气时间、手术时间、AIM2、ASC和pro-Caspase1的差异有统计学意义(P<0.05),见表1、图1。
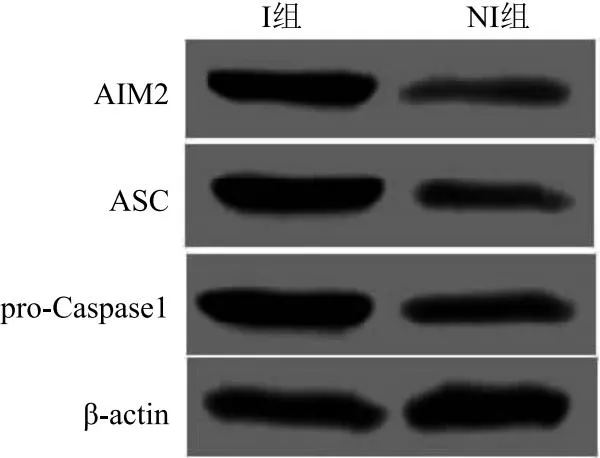
图1 两组患者肺组织AIM2,ASC和pro-Caspase1表达情况
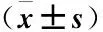
表1 两组患者一般情况和手术情况各指标的比较
2.3 两组患者肺组织HE染色图片观察比较 光镜下,I组肺泡间隔相对增厚,肺泡壁毛细血管及小静脉扩张充血。肺泡内可见较多粉红色渗出,比较均匀的水肿液,见图2A。NI组肺泡结构完整,肺泡腔内渗出物较少,见图2B。
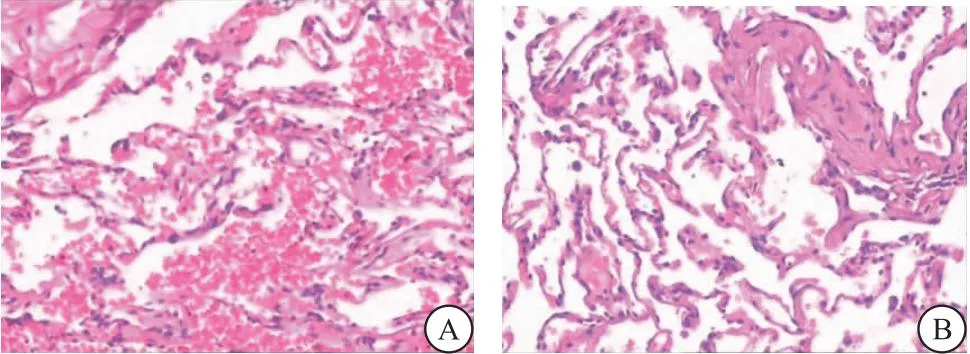
图2 肺组织HE病理结果(400×)
2.4 将上述差异有统计学意义的指标进行多因素Logistic回归分析 结果显示,年龄、FEV1/FVC、单肺通气时间、手术时间、AIM2、 ASC和pro-Caspase1是单肺通气肺损伤的危险因素,见表2。
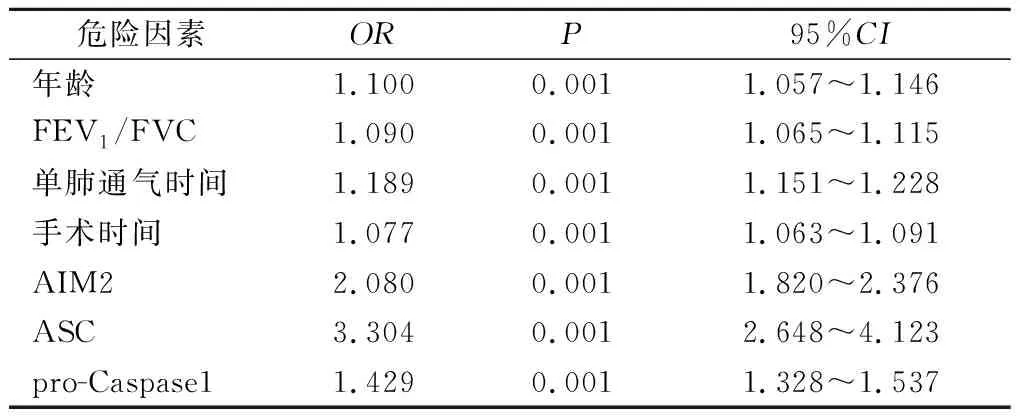
表2 单肺通气相关肺损伤危险因素 Logistic 回归分析
2.5 敏感性分析 纳入不同协变量进行多因素Logistic回归分析结果显示: AIM2、 ASC和pro-Caspase1仍是单肺通气肺损伤的危险因素,见表3、4。
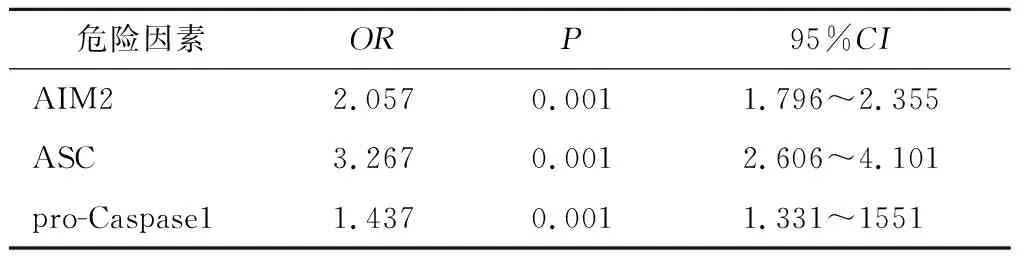
表3 单肺通气相关肺损伤危险因素 Logistic 回归分析(敏感性分析1)
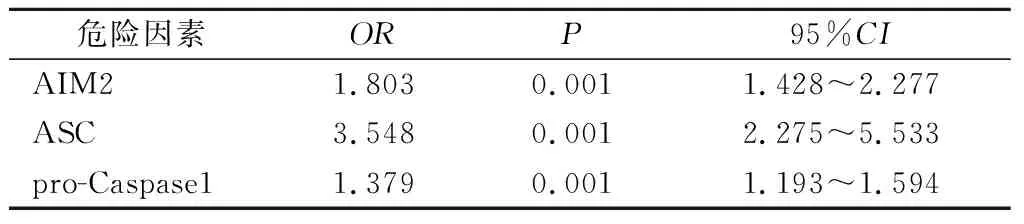
表4 单肺通气相关肺损伤危险因素 Logistic 回归分析(敏感性分析2)
2.6 ROC曲线分析 AIM2 、ASC和pro-Caspase1灵敏度及特异度均较高,曲线下面积大且约登指数较大,预测单肺通气相关肺损伤的发生有较高的准确性,见表5、图3。
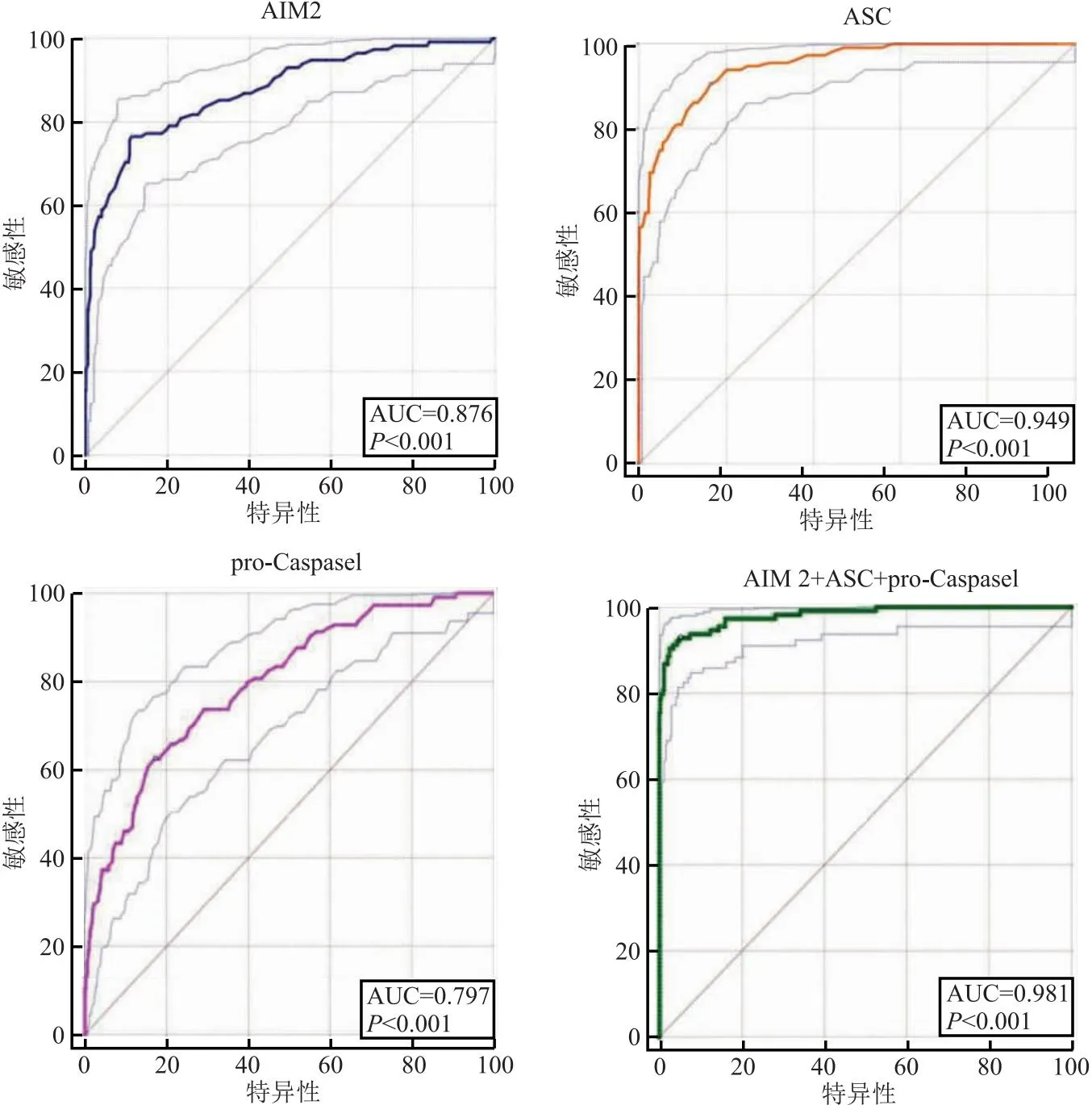
图3 ROC曲线图
2.7 PR曲线分析显示 AIM2 、ASC和pro-Caspase1曲线下面积大,预测单肺通气相关肺损伤的发生有较高的准确性,见表6、图4。
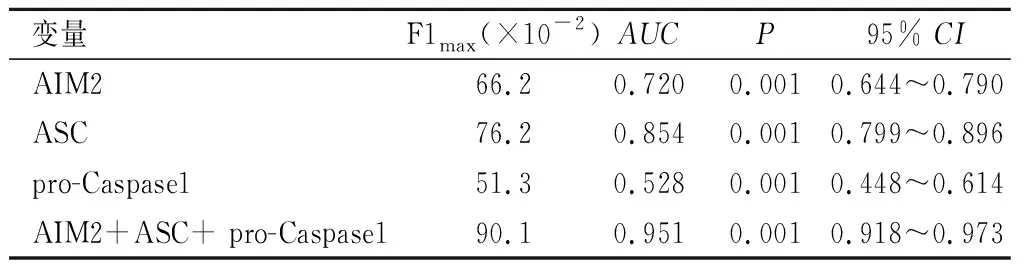
表6 肺组织相关蛋白预测单肺通气相关肺损伤结果
3 讨论
单肺通气(One -lung ventilation,OLV)是一种仅使用一个肺(非手术侧)进行通气的方法[8],可为手术医生提供良好的视野。在肺切除术中,OLV与术后肺部并发症相关且因其低氧血症率高被认为是ALI的一个危险因素。有研究发现开胸术后ALI的发生率为4%~15%,其和急性呼吸窘迫综合征是胸外科术后死亡的主要原因[9]。研究表明肺萎陷时间长可引起严重的肺损伤[10],最近的一项动物实验病理改变显示,在OLV进程中非通气肺组织在复张后由于扩张使肺泡的机械应力增加,并对邻近肺泡产生高剪切力,因此导致完全肺萎陷后的肺复张在萎陷的肺中诱导炎性细胞因子的产生,蛋白外渗和中性粒细胞募集到肺泡。随着肺塌陷时间的延长,中性粒细胞浸润和肺泡结构损伤,从而引起肺损伤[11]。此外有研究发现,单肺通气后肺损伤程度与肺组织塌陷时间呈正相关可能与缺氧、缺血再灌注和细胞破坏有关[12-14]。
本研究发现年龄是胸腔镜下肺叶切除术患者单肺通气相关肺损伤的独立危险因素,与过往研究一致[15]。FEV1/FVC是指最大呼气第1秒呼气量占用力肺活量的百分比,是反映有无气道气流受限的常用临床指标。本研究发现FEV1/FVC是胸腔镜下肺叶切除术患者单肺通气相关肺损伤的独立危险因素。
刘丽霞等[16]研究结果发现术前FEV1/FVC与术后急性肺损伤的发生呈明显正相关,术前肺功能重度受损患者术后急性肺损伤发生率明显升高。本研究发现,单肺通气时间是胸腔镜下肺叶切除术患者单肺通气相关肺损伤的独立危险因素,这与Della等[17]研究结果一致。单肺通气过程中非通气侧肺叶血流因没有得到氧合而导致组织缺氧,促进了内皮素、前列腺素、血管紧张素等血管活性物质的释放,引起缺氧性肺血管收缩,并刺激血管内皮细胞产生氧自由基,通过脂质过氧化反应破坏血管结构,导致肺血管通透性增加,从而导致术后肺损伤的发生。
AIM2是一种胞质受体,是介导细胞因子成熟、分泌和焦亡的细胞质多蛋白平台。典型的炎症小体中有3层分子:传感器、适配器和效应器。传感器蛋白检测病原体来源的分子特征或细胞环境中的蛋白,适配器蛋白通过蛋白-蛋白相互作用将信号传递给效应蛋白,效应器蛋白促炎细胞因子的成熟形式,触发炎症小体级联的激活[18-19]。由于其配体的保守性,AIM2在多种病原体的免疫识别过程中非常重要。此外,AIM2还能在细胞损伤或应激时识别宿主DNA。在感染和ALI的发展过程中,AIM2炎症小体被激活,使含有pyd的寡聚NLRP3和NLRP6片段可形成ASC纤维,导致Caspase-1的成熟,以及它们在血清和组织中的释放,诱导肺部炎症[20-21]。巨噬细胞为炎症小体基因的主要细胞,其激活不仅有助于促炎细胞因子的分泌,还会诱导细胞因炎症反应而程序化死亡,M1和M2巨噬细胞在肿瘤中广泛分布,其中M2(替代激活巨噬细胞)又称抗炎巨噬细胞占主导地位。经典激活的巨噬细胞M1分泌各种促炎介质,包括TNFα、IL1-β、IL6和过量活性氧(ROS),导致炎症反应的激活[22]。研究发现M1极化的巨噬细胞增强AIM2基因表达[23],在肺损伤过程中,巨噬细胞一方面激活AIM2,释放炎症介质,导致炎症损伤,另一方面向M1极化发展,导致肺组织损伤[24]。
本研究发现,术后单肺通气肺损伤患者肺组织中AIM2,ASC和pro-Caspase1蛋白表达较术后单肺通气无肺损伤的患者明显升高,通过多因素Logistic回归分析表明肺组织中AIM2,ASC和pro-Caspase1蛋白表达是发生术后单肺通气肺损伤独立危险因素,并且通过二次敏感性分析结果发现,AIM2,ASC和pro-Caspase1蛋白表达仍是发生术后单肺通气肺损伤独立危险因素。急性肺损伤本质上是一种炎症反应,与内皮和上皮屏障的破坏有关,其特征是富含蛋白质的水肿液积聚、支气管上皮脱落、坏死或凋亡的I型细胞出现、基底膜脱落、间质水肿扩大、内皮细胞损伤以及组织中细胞碎片的积聚。细胞特征包括肺泡-毛细血管膜完整性的丧失,中性粒细胞和巨噬细胞的迁移,以及促炎/细胞毒性蛋白的增加。炎症介质增高伴有抗炎分子表达的下降是肺损伤炎症发病机制的关键,其中NF-KB作为重要的转录因子,在肺部炎症的细胞信息传导调控中起核心作用,多种炎症介质受其调节[25]。单肺通气时各种病理生理改变均可使NF-KB激活,AIM2炎性小体识别炎症信号时,从而使AIM2表达增多,其可直接或通过ASC募集pro-caspase-1,pro-caspase-1经过自剪切作用水解为p35和p10,其中p35再被剪切为CARD和p20,两个p20和p10结合构成具有活性的Caspase-1,发挥对pro-IL-1β和pro-IL-18的剪切作用,进而产生成熟的具有生物学活性的IL-1β和IL-18,从而诱发肺损伤[26-27]。在本研究中ROC曲线结果与通过PR曲线分析验证后结果一致,提示肺组织AIM2炎性小体预测单肺通气相关肺损伤的发生有较高价值。
本研究局限性在于收集肺组织是一种有创操作。监测患者血浆中AIM2炎性小体的浓度将使临床检查更加方便。本项目将通过大规模的临床研究,通过检测外周血中AIM2炎性小体浓度的变化来监测疾病的进展。在动物实验中探索AIM2炎症小体在单肺通气肺损伤中的相关机制是我们未来的研究方向。
4 结论
AIM2炎性小体升高是胸腔镜下行肺叶切除术的肺癌患者单肺通气相关肺损伤的独立危险因素,且肺组织AIM2炎性小体可准确预测单肺通气相关肺损伤。

