混合型生物炭对寒冷地区PAHs 污染土壤微生物修复的强化作用
苏丹,罗桥冰,董昱杉,杨彩霞,王鑫
1. 辽宁大学环境学院,辽宁 沈阳 110036;2. 沈阳大学/区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044
随着人类工农业活动的加剧,具有高毒性、高累积、难降解、可远距离迁移的多环芳烃(polycyclic aromatic hydrocarbons,PAHs)污染物在土壤系统中不断累积,且在土壤表层和次表层的积累趋势明显(姜永海等,2009;Wu et al.,2017),潜在威胁生态安全与人群健康。微生物降解被认为是去除环境中PAHs 的主要途径,具有经济、有效、生态无二次污染等优势,其中固定化微生物技术因其可提高微生物修复效果而备受关注(Alexander,1981;Lea et al.,2019)。
北方寒冷地区土壤受冻融作用影响,大部分PAHs 污染土壤处于中低水平。土壤孔隙自由水0 ℃冻结,团粒吸附水低于-8 ℃冻结(Coxson et al.,1987),冻结会导致大部分微生物休眠,但团粒表面水分子膜在-20 ℃以下仍可保持液态(Koponen et al.,2006;Juan et al.,2018)。冷适应微生物对冻结环境具有较高抗性,在冻结条件下耐冷菌对土壤中PAHs 的降解作用不受限制(Lipson et al.,2004;陈明华,2014)。苏丹等(2017)已从冻结环境中分离得到多株耐冷PAHs 降解菌,并引入固定化技术成功构建了固定化耐冷真菌-细菌共生体系,发现耐冷菌经固定化处理后,对冻融交替条件下土壤PAHs 的去除效率较游离菌提高10%以上,固定化载体-真菌-细菌构建起的微环境作为缓冲体系,有效屏蔽土著微生物的竞争作用和不利土壤条件的侵害作用,体系内PAHs 降解菌的数量与活性均得到不同程度的提高,正逐步由实验研发转向现场应用(巩春娟,2018;普聿,2019;王天杰,2020)。但要实现在原位修复中的成功应用,还须提高低温条件下土壤PAHs 的生物有效性(微生物可利用性),缩短污染物和降解菌之间的距离,强化修复效果。
土壤对PAHs 有很强的截留作用,污染物被土壤绑定、老化而长期停留在土壤中,难以被微生物利用,固定化微生物能够通过固定化载体吸附作用改变土壤PAHs 的分布和结合位点,影响其生物有效性(Martienssen et al.,2000),若要提高土壤PAHs的微生物可利用性,选择合适的载体材料是一个有效途径。与天然载体相比,人工载体因具备可控的比表面积、孔径分布以及传质性能好等优点,能与特定的微生物及复杂污染物更好地匹配,进而获得更优的固定化效果和修复性能(Muhammad et al.,2020)。因此,有必要开发出低成本、环境友好型人工载体,用于耐冷PAHs 降解真菌—细菌的固定化。
生物炭作为一种新型环境材料,由于其特殊的多孔性结构、强的吸附性能,以及富含多种营养元素和特殊官能团等特点,在受污染环境修复方面具有巨大的应用潜能(Ahmed et al.,2016;李晓娜等,2017;Kumar et al.,2018;Gorovtsov et al.,2020;Bianco et al.,2021)。通过控制生物炭的前体物、热解温度、热解时间能获得结构、孔容、比表面积、pH 值、持水性、密度、灰分含量等理化性质和吸附能力各异的生物炭(刘亮,2015;Agegnehu et al.,2017;Yasir et al.,2020)。生物炭具有很高的化学稳定性而且难以被微生物降解。生物炭可以优化微生物的栖息地,改变土壤的酶活以及减少污染物对微生物的毒性,国内外已有采用生物炭负载PAHs降解菌修复PAHs 污染土壤方面的研究,并将较好的修复效果归因于生物炭载体的吸附锁定作用和固定化菌剂的生物降解作用(王银善,2010;Yang et al.,2021)。Garcia-Delgado et al.(2015)研究发现秸秆生物炭负载P.ostreatus对菲的修复效率相比于P.ostreatus的修复,提高了19%,任静(2020)发现棉杆生物炭(MG)和稻壳生物炭(DK)对降解菌Martellsp(AD-3)固定化后,在PAHs 溶液中的降解效果较好,16 h 后,MG、DK 固定化AD-3对Phe 的去除率分别为92.40%、64.09%,对蒽的去除率分别为65.69%、30.91%。热解后的生物炭表面含有大量的碳氢化合物质,这些物质可以发送信号分子(Graber et al.,2010),并被微生物所吸收(Farrell et al.,2013)。但是,这些应用还处于探索阶段,而且大多针对单一类型生物炭,缺乏不同原料生物炭的选配和组合研究,生物炭功效未能有效发挥。因此,有必要根据土壤理化性状和修复目标选择适宜的生物炭载体类型,加强应用研究,实现生物炭功效的最大利用。
在耐冷PAHs 优势菌修复土壤PAHs 污染过程中,选择工农业废弃物为前体物制备生物炭,采用生物炭为固定化载体基材,即可促进降解菌的活性和数量,又可改善土壤理化性质(如持水性、透气性以及pH 等),提高土壤PAHs 迁移性和生物有效性。在田间条件下,进入土壤的生物质炭自身不稳定组分会发生转化、淋溶,并与土壤发生相互作用出现老化现象,导致生物质炭的化学与物理性质发生显著变化(Burrell et al.,2016;He et al.,2021)。生物质炭在土壤中的老化会导致有机污染物的吸附—解吸行为发生改变,且受土壤、生物质炭以及污染物性质的影响较大(卿敬等,2017;Shaaban et al.,2021)。目前,有关如何利用不同类型生物炭的性能,促进生物炭固定化菌剂对土壤中PAHs 的降解及其强化作用机理方面的研究尚未见报道。
本文选用玉米芯、松木屑等工农业废弃物为前体物,分别制备300 ℃和500 ℃不同热解温型生物炭,并对这4 种生物炭(玉米芯300 ℃、玉米芯500 ℃、松木屑300 ℃和松木屑500 ℃)进行十字交叉混配,通过对比不同类型生物炭理化性质,优选出比表面积和孔隙较大的混合型生物炭(C500+W500)作为微生物固定化载体,通过混合生物炭与土壤对Phe 的竞争吸附,探究生物炭对老化土壤中有效态PAHs 迁移过程的影响;以耐冷假单胞菌(Pseudomonassp.,S4)与高山被孢霉(Mortierellaalpine,J7)为PAHs 降解混合菌,采用吸附固定化方法制备生物修复材料,并研究固化了混合菌的混合型生物炭与单一类型生物炭对土壤PAHs 降解性能,从生物炭载体微界面结构特征,以及土壤有效态PAHs 含量随修复时间的变化特征等角度,揭示生物炭在土壤中PAHs 微生物降解过程中的机理与优势作用,为进一步开展寒冷地区PAHs 污染土壤的微生物修复研究和工程应用,发展经济、高效、安全的土壤有机污染修复的实用技术,生产安全农产品提供理论依据与技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试生物炭
生物炭前体物为玉米芯(C)、松木屑(W)生物质,购自沈阳市某农产品加工厂,玉米芯(C)为60 目(孔径0.250 mm),松木屑(W)为20 目(孔径0.850 mm)。
1.1.2 供试土壤
选用中国科学院沈阳生态试验站0—20 cm 表层清洁土,为草甸棕壤,基本理化性状:pH 为7.30,有机质含量为4.62%(质量分数,下同),全氮为0.30%,总碳1.70%。
1.1.3 供试菌种与培养基
假单胞菌(Pseudomonassp.,S4)(GCMCC NO.14048)和高山被孢霉(Mortierellaalpine,J7)(GCMCC NO. 15183)是由本课题组于2019 年自主筛选并鉴定的耐冷高效PAHs 降解菌。
完全培养基:蛋白胨10.0 g,酵母粉5.0 g,牛肉膏5.0 g,葡萄糖10.0 g,氯化钠5.0 g,pH 7.0—7.2,以蒸馏水定容至1 000 mL,121 ℃灭菌25 min,固体培养基另加琼脂粉20.0 g·L-1。
增殖培养液:蔗糖4.0 g,酵母膏3.0 g,KH2PO40.5 g,(NH4)2HPO42.0 g,MgSO4·H2O 0.25 g,pH 6.0—6.5,121 ℃灭菌20 min。
1.1.4 试剂
氯化钠(分析纯,上海麦克林生化科技有限公司)、二氯甲烷(分析纯,成都市科隆化学品有限公司)、丙酮(分析纯,成都市科隆化学品有限公司)、乙腈(色谱纯,Sigma-Aldrich 公司)、PAHs标准品(优级纯,广州硕谱生物科技有限公司)、菲(Phe,纯度>95%,百灵威CK 公司)和芘(Pyr,纯度>98%,百灵威CK 公司)。
1.1.5 仪器与装置
高效液相色谱仪(1200 Series,色谱柱为C-18柱ZORBAX Eclipse,安捷伦科技(中国)有限公司)、扫描电子显微镜(Phenom ProX,荷兰Phenom-World 公司)、全自动比表面积及空隙度分析仪(TriStar II 3020 2.00,美国Micromeritics)、元素分析仪(VARIOELIII,德国Elementar)、高速冷冻离心机(JW-2019HR,安徽嘉文仪器装备有限公司)、涡旋振荡器(VORTEX-5,海门市其林贝尔仪器制造有限公司)、超纯水机(50131922,赛默飞世尔科技(中国)有限公司)、电热恒温鼓风干燥箱(DHG-9140A,上海精宏实验设备有限公司)、数控超声波清洗器(KQ-500DB,昆山市超声仪器有限公司)、冷冻干燥机(FD-1C-50,北京博医康实验仪器有限公司)、电冰箱(BCD-290W,青岛海尔股份有限公司)等。
1.2 实验方法
1.2.1 生物炭的制备与表征
采用限氧控温炭化法制备生物炭,制备过程如下:将玉米芯(C)、松木屑(W)自来水冲洗3 次后,再用蒸馏水冲洗2 次,放置风干2 d,再放入75 ℃烘箱中烘干后,装入铁罐中(直径1 cm,长3 cm)压实生物质,通入氮气,直至里面无氧气,放置马弗炉中,以10 ℃·min-1升温至预设温度(300、500 ℃),然后炭化4 h,待冷却至室温后取出,待用。将各温度下热解制成的生物炭样品分别标记为C300、C500、W300、W500。
生物炭酸碱性测定:准确称取一定质量的生物炭,以质量分数1∶20 比例与超纯水混合,振荡0.5 h后离心静置取出上清液,使用pH 计测定生物炭pH值(GB/T 12496.7—1999)。
生物炭吸水能力测定:准确称取一定质量的生物炭,以质量分数1∶20 比例与超纯水充分摇匀,置于超声波机中振荡24 h 后,抽去多余的水分,然后称取生物炭+水的质量。吸水量=(生物炭+水的质量)-生物炭质量。
采用VARIOELIII 元素分析仪测定生物炭样品中C、H、N、O 等元素含量。
采用TriStar II 3020 2.00 全自动比表面积和孔隙度分析仪,测定6 种生物炭的介孔。将生物炭样品以氮气吸附介质,300 ℃或500 ℃下脱气6 h 后,放置于77 K液氮中测定生物炭样品的比表面积和孔隙结构。
按照参考文献(苏丹,2007)的方法对生物炭样品进行前处理,并采用Phenom ProX 扫描电子显微镜(SEM)观察生物炭的结构与孔隙结构。
1.2.2 混合型生物炭加载耐冷混合菌的制备及其微观结构表征
采用吸附法制备固定化混合菌颗粒,将S4 和J7,按体积比1∶1,在完全培养基中分别接种,设置温度为15 ℃,设置摇床为120 r·min-1,使混合菌在摇床上混合培养3 d,制得菌剂。将不同类型生物炭按质量分数1∶1 混合放入高压灭菌锅,121 ℃,60 min。按质量分数1∶1 将灭菌的生物炭混合物用增殖培养液浸泡,在15 ℃下培养3 d,制得生物炭加载耐冷高效降解PAHs 生物修复材料。
按照参考文献(苏丹,2007)的方法对固定化混合菌样品进行前处理,并采用Phenom ProX 扫描电子显微镜(SEM)观察固化了微生物的混合型生物炭微观结构。
1.2.3 生物炭与土壤对典型PAHs 的竞争吸附
优选比表面积和孔隙较大的混合生物炭(C500+W500)作微生物固定化载体,通过混合生物炭与土壤对典型PAHs—Phe 的竞争吸附,探究生物炭对老化土壤中有效态PAHs 迁移过程的影响。
将土壤置于高压蒸汽灭菌锅中灭菌60 min,烘干土壤。精确称取4.0 g 土(CK-Soil)、0.02 g 生物炭(CK-Biochar)、4g 土+0.02 g 生物炭(CW),分别投入到10 个含有100 mL·L-1的PAHs 的锥形瓶中,置于摇床中,25 ℃,100 r·min-1避光条件下振荡,分别于10、20、30、40、50、60、70、80、90、100 min 取样,离心,过0.45 µm 纤维滤膜,分别提取液体与土壤中PAHs,并用测定其含量。生物炭对Phe 的吸附量由差减法获得。
1.2.4 土壤修复实验设计与实施
实验设置8 个处理,详见表1。每种处理3 个平行,试验重复2 次。将修复实验用土壤过2 mm筛后,分装培养瓶中,每瓶10 g,121 ℃高温灭菌60 min,冷却后每瓶定量加入Phe 或Pyr 的丙酮溶液,使其初始质量分数均为100 mg·kg-1,放置过夜,接种固定化混合菌剂,随时补加无菌水,使土壤水分为40%,在15 ℃下避光培养,分别在0、10、20 和30 d 取样测定土壤中PAHs 的残留量。

表1 土壤修复效果实验的处理设置Table 1 Treatment design for the soil remediation effect experiment
1.2.5 土壤中可提取态PAHs 含量的测定
采用超声振荡抽提法,所用净化柱为硅酸镁净化柱(李娜等,2016;Blatt-Janmaat et al.,2020)。将土样置于50 mL 玻璃瓶中,加入15%氯化钠,15 mL 二氯甲烷、20 mL 丙酮,震荡16 h,转速设定120 r·min-1,温度25 ℃。取出静置1 h。分层,下层水相,上层有机相。取出上层液体转移至硅酸镁净化柱中净化,通风橱挥发3 h 至无液体,加入2 mL乙腈,放入小超声机震荡1 min,用注射器通过0.22 μm 有机滤头过滤注射到液相小瓶里,标号,待测。
PAHs 含量用HPLC 法检测。通过荧光及紫外检测器对样品进行检测分析,水、乙腈为流动相,测定Phe 选用V(乙腈)∶V(水)=75%∶25%,测定Pyr选用V(乙腈)∶V(水)=60%∶40%。按梯度进行洗脱,柱温30 ℃,流速为1 mL·min-1,进样量10 μL。根据色谱峰保留时间定性,Phe 的保留时间为3.1—3.3 min,Pyr 的保留时间为5.8—6.1 min。采用外标法定量,Phe 的回收率72.56%—90.48%,Pyr 的回收率为68.48%—89.21%。
1.2.6 数据处理
利用单因素方差分析(ANOVA,LSD)分析PAHs 含量间差异。采用SPSS 22.0 进行统计分析,Origin 2017 进行处理拟合并作图。
生物炭及土壤对Phe 的吸附量,采用BoxLucasl准一级动力学方程和准二级动力学方程对所获取的数据进行拟合,明确生物炭吸附过程中的吸附机制,线性公式如下:
准一级动力学方程:
准二级动力学方程:
其中:
Qt——t时间的吸附量,μg·mg-1;
Qe——平衡吸附量,μg·mg-1;
k1——准一级吸附动力学常数,min-1,
k2——准二级吸附动力学常数,μg·(mg·min)-1。
2 结果和分析
2.1 生物炭的基本理化性质
2 种材料2 个热解温度下生物炭酸碱性、吸水能力、比表面积、总孔空容与平均孔径如表2 所示。4 种生物炭均为弱碱性,其中C300 pH 最高,为10.13,W500 pH 最低,为8.18。吸水性强的生物炭可以为附着的微生物提供更好的栖息地环境,吸水能力最好的生物炭是松木屑,W500 每克可吸水3.85 g,W300 每克可吸水3.46 g,其余生物炭吸水量均在1.2 g·g-1左右,可见松木屑生物炭显著高于其他材料的生物炭,更适合作为固定化微生物的载体。
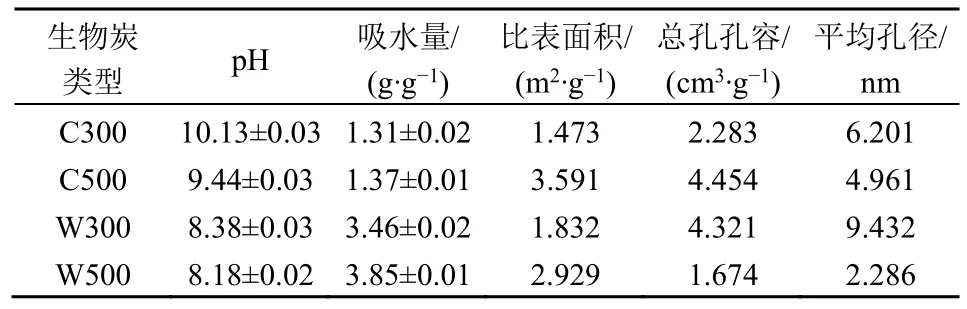
表2 生物炭的pH、吸水能力、比表面积、总孔孔容、平均孔径Table 2 pH, water absorption capacity, Specific surface area,total pore volume and average pore diameter of biochar
生物炭根据孔径分为微孔、介孔、大孔结构(Pietikäinen et al.,2000),范围分别为0—2、2—50、50 nm 以上,根据孔径范围可知4 种生物炭的结构均为介孔结构,其中W300 的平均孔径最大,为9.43 nm,W500 平均孔径值最小为2.28 nm,C300与C500 的平均孔径介于中间,分别为6.20 nm 与4.96 nm。
生物炭孔隙体积较大时,微生物更有可能进入生物炭孔隙并利用其中的养分,此外,具有较大孔隙体积的生物炭更有利于体积较小且生长速率较快的微生物进入其中生长发育(Kasozi et al.,2010)。因此,较大孔隙生物炭更适合作为微生物载体基材。由表1 可知,4 种生物炭孔容最大的为C500(4.45 cm3·g-1)、其次为W300(4.32 cm3·g-1)。
生物炭比表面积的大小可影响微生物在生物炭表面上的生长与繁殖(Bolan et al.,2023),大的比表面积可为微生物创造更多的生存空隙以及吸附点,小的比表面积增大了微生物的空间及养分的竞争力。由表1 可知,C500 比表面积最大,为3.59 m2·g-1,较其它生物炭可以促进微生物的生长以及与更多的有机物接触(Warnock et al.,2001;Shor et al.,2003),其次为W500 的比表面积为2.92 m2·g-1。
生物炭是生物质在限氧热解条件下产生的,表3列出了生物炭的元素组成。由表3 可知,随着热解温度的升高,2 种材料生物炭中有机组分的C 含量逐渐增多,玉米芯生物炭由74.17%到83.70%,松木屑生物炭由72.86%增到88.14%。其中W500 碳含有率最高,为88.14%,B300 的碳含有率较W500 低18.27%,其它生物炭的含碳率在72%—83%。
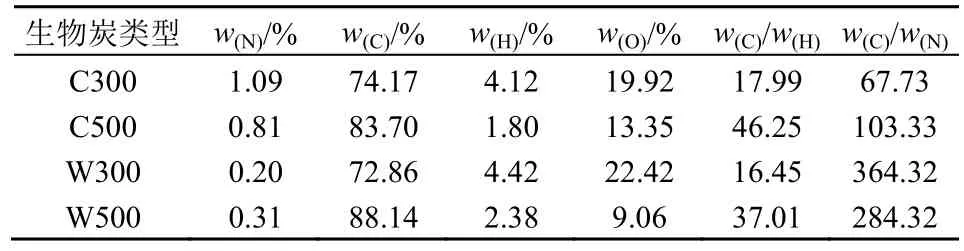
表3 生物炭的元素组成Table 3 Elemental analysis of biochar
生物炭的w(C)/w(H)可以反映有机质的碳化、芳香化程度(Qian et al.,2016;刘伟鹏,2018),且芳香化程度随着w(C)/w(H)变化而变化。由表3 可知,4 种生物炭w(C)/w(H)比值均在16 以上,4 种生物炭芳香性结构都较高,w(C)/w(H)值最大为C500,其w(C)/w(H)值为46.25,其次为W500,其w(C)/w(H)值为37.01,略低于C500。由于生物炭芳香环间电子不规则的分配,使生物炭电子发生了变化,电子的变化引起了π 电子介质的变化,π 电子与有机物中的π 电子结合,进而产生共轭作用促进生物炭吸附有机物。由此可见,4 种生物炭对有机污染物吸附能力均较强。
w(C)/w(N)值会影响微生物的生存与生长,当w(C)/w(N)的比值在25 附近,可以促进微生物的生存与生长(李力等,2011)。在系统处于C 多N 少的情况下,环境中缺少N 会导致微生物活性减小。由表3 可知,C300 的w(C)/w(N)比值较其它生物炭更接近25,其次为C500,说明C300 与C500 中的环境最合适微生物的生存与生长。
2 种生物炭2 种不同温度下的表面结构(SEM)如图1 所示。由图1 可见,不同材料的生物质表面结构不同,玉米芯生物炭(图1a、b)表面凹凸不平,C500 比C300 表面更加粗糙,褶皱更多,且具有更大的比表面积(表2),增加了对有机物吸附的可能性。松木屑生物炭(图1c、d)排列错综杂乱无整齐的顺序,表面褶皱多,W500 比W300 孔隙增多。500 ℃热解下生物质可以清晰的看见生物炭表面覆盖着一层白色碎屑,可能是由于灰分在表面堆积。
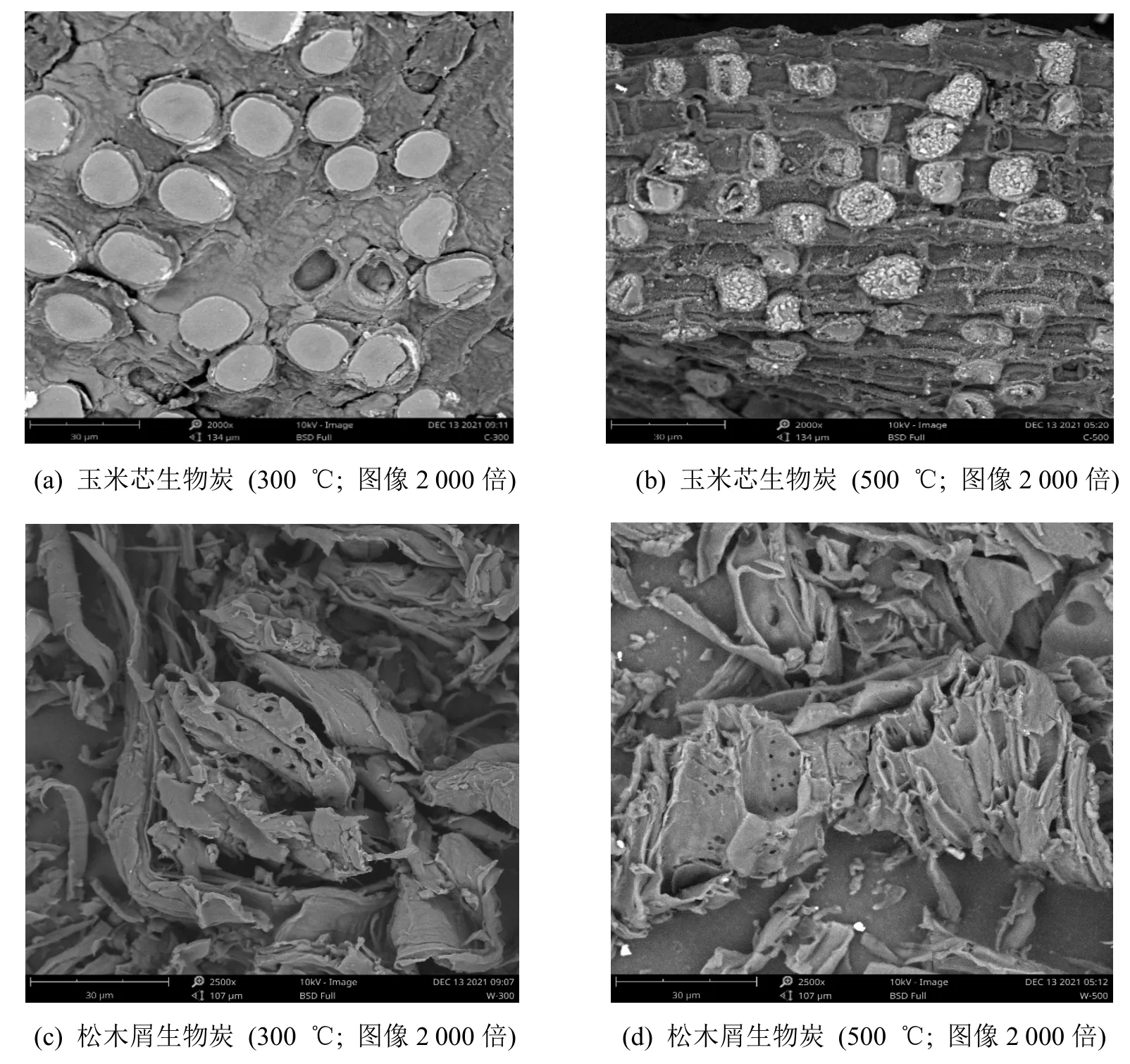
图1 供试生物炭SEM 图Figure 1 SEM of tested biochar
综合以上生物炭的表征数据,混合型生物炭C500+W500 最适宜作为耐冷高效PAHs 降解混合菌的载体基材。
2.2 混合型生物炭固定化菌剂SEM 表征
图2 为单一生物炭(C500 或W500)与混合型生物炭C500+W500 加载耐冷混合菌S4J7 后的表面微观结构(SEM)。由图2a 和图2c 对比可知,混合型生物炭上真菌明显增多,真菌的菌丝横穿在生物炭的空隙中,有的直接吸附在生物炭表面。由图2b 和图2c 对比可知,真菌和细菌均吸附在生物炭上,混合型生物炭上真菌菌丝繁密,纵横生长,随着生长向外不断延伸,菌丝的延伸可更好的接触污染物。

图2 修复材料固定化表面结构Figure 2 Immobilized mixed consortium observed by SEM
2.3 生物炭对典型PAHs的竞争吸附量及吸附动力学
通过混合生物炭(C500+W500)与土壤对典型PAHs-Phe 的竞争吸附,探究生物炭对老化土壤中有效态PAHs 迁移过程的影响,结果如图3 所示。
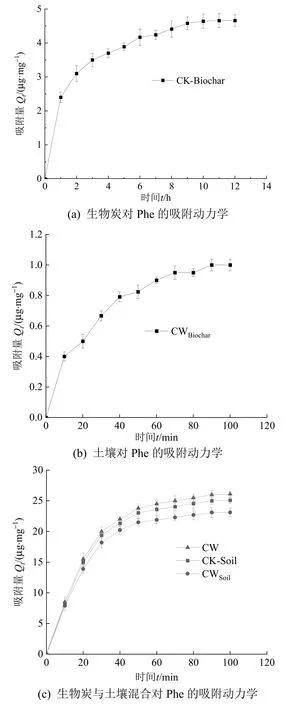
图3 生物炭与土壤对Phe 的吸附量Figure 3 Relationship between the amount of adsorption of Phe in biochar and soil with time
由图3a 可见,第1 小时时CK-Biochar 吸附速率最快,为2.4 μg·mg-1·h-1,此后随着时间增加,吸附速率逐渐降低,在第12 小时吸附到达平衡,平衡吸附量为4.47 μg·mg-1。由图3b 可见,CWBiochar在前10 min 竞争吸附Phe 最快,为0.4 μg·mg-1·min-1,之后随着时间增加,竞争吸附速率逐渐降低,在100 min 时达到吸附平衡,平衡吸附量为0.01 μg·mg-1。由图3c 可见,前15 min,CK-Soil 对Phe 的吸附速率保持一致,为大致15 μg·g-1·min-1,随时间变化,竞争吸附速率逐渐降低,至100 min 后达到吸附平衡,平衡吸附量为25.45 μg·g-1。CWSoil前15 min 对Phe 的吸附速率基本保持不变,大致为 14 μg·g-1·min-1,随时间变化,竞争吸附速率逐渐降低,至100 min 后达到吸附平衡,平衡吸附量为2.03.46 μg·g-1。CW 与CK-Soil 对Phe 的竞争吸附趋势基本一致,前10 min 竞争吸附速率达8.5 μg·g-1·min-1,此后时间增加,吸附速率逐渐降低,在100 min 处吸附平衡,平衡吸附量为26.46 μg·mg-1。
CK-Soil 比CK-Biochar 对Phe 的吸附速率高(图3c),且平衡吸附量也高于CK-Biochar,可能是由于 CK-Soil 处理中的土壤添加量远远大于CK-Biochar 处理组中的生物炭添加量,而且生物炭的吸附机制与土壤对Phe 的吸附机制不同。生物炭的吸附机制主要包括分配作用、表面吸附作用等,CWBiochar对Phe 的吸附量比CK-Soil、CK-Biochar都小,可能是因为土壤与生物炭在竞争吸附Phe。CWBiochar对Phe 的吸附量明显减少,可能是因为土壤的吸附作用使CW 中Phe 的浓度大量减少。在Phe的竞争吸附中CW、CWSoil与CK-Soil 曲线趋势基本相同,平衡吸附量由大到小的关系为 CW>CK-Soil>CWSoil。说明生物炭投加至土壤,吸附剂的整体比表面积增大,吸附量增加,但由于竞争吸附力的存在,吸附剂土壤对Phe 的吸附量减少。CWBiochar与CWSoil相比,平衡吸附量相差较大,这与生物质和土壤物理性质等因素有关。
为了探究生物炭对老化土壤中有效态PAHs 迁移过程的影响,研究了混合生物炭与土壤对典型PAHs-Phe 的竞争吸附,并分别采用一级动力学和二级动力学模型对生物炭(CK-Biochar)、土壤(CK-Soil)、生物炭加土壤(CW)吸附Phe 的动态过程进行了拟合,拟合结果见表4。由表4 可知,CK-Biochar 与CWBiochar对Phe 的吸附作用可以用准二级动力学模型进行描述,拟合效果优于准一级动力学模型;CK-Soil、CW 与CWSoil对憎水性化合物的吸附与准一级动力学模型一致。准二级动力学模型建立在吸附速率限制基础上,是一种化学吸附,在吸附剂与吸附质之间存在电子共用或电子转移(李文静等,2016;高如琴等,2019)。准一级动力学模型是理想模型,其主要对整个吸附过程拟合,但实际吸附有多种控制步骤(Zhu et al.,2014;王彤彤等,2017),而准二级动力学模型包含了液膜扩散、颗粒内扩散和化学反应等吸附的所有步骤,所以准二级动力学模型比准一级动力学模型拟合度要高,更适合描述生物炭吸附Phe 的过程。
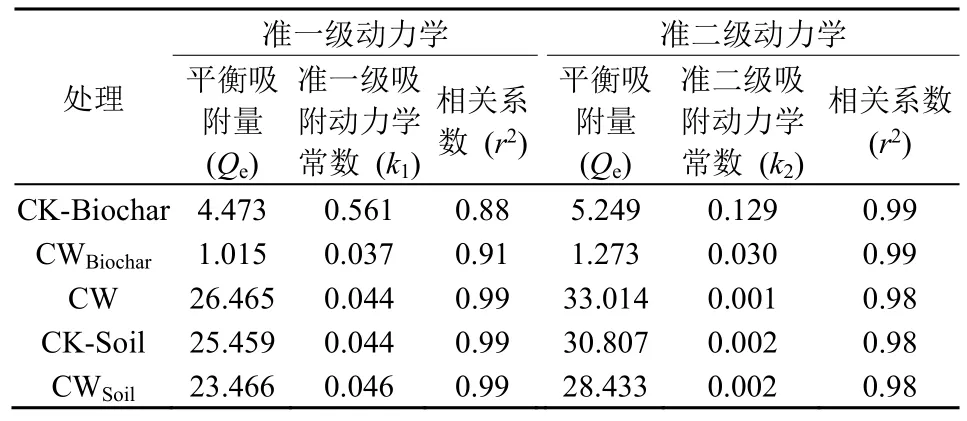
表4 生物炭吸附动力学拟合参数Table 4 Parameters obtained from pseudo-first-order kinetics model, pseudo-second-order kinetics model for Phe adsorption on biochar and soil
2.4 不同修复方式对PAHs 的降解性能
以耐冷假单胞菌(Pseudomonassp.,S4)与高山被孢霉(Mortierellaalpine,J7)为PAHs 降解混合菌,采用吸附固定化方法制备生物修复材料,并研究固化了混合菌的混合型生物炭与单一类型生物炭对土壤Phe 与Pyr 的降解性能,结果如图4 所示。
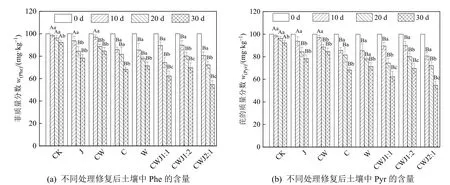
图4 不同处理修复后土壤中菲(a)与芘(b)的含量Figure 4 Phe (a) and Pyr (b) degradation rate of soil sample with different methods
由图4 可知,生物炭加载微生物组(CWJ1:1、CWJ1:2、CWJ2:1)的降解效果均优于游离菌(J),30 d 后CWJ2:1 组对Phe(图4a)、Pyr(图4b)的去除率分别为51.87%、45.28%,分别高于游离菌(J)25.81%、23.65%。生物炭固定化菌剂可促进土壤中PAHs 的降解,使微生物的活性增强,并使微生物能够在复杂的环境中进行高效的工作。任静等(2020)发现棉杆生物炭(MG)和稻壳生物炭(DK)对降解菌Martellsp.(AD-3)固定化后,MG、DK固定化AD-3 对Phe 的去除率分别为92.40%、64.09%,对蒽的去除率分别为65.69%、30.91%。Su et al.(2006)选取玉米棒固定化真菌修复PAHs污染的土壤,发现固定化对污染土地降解PAHs 效果明显。巩春娟(2018)采用蛭石为载体吸附法固定微生物,60 d 后对土壤中Phe、Pyr、苯并芘(Bap)降解率分别为64.38%、48.71%、40.19%。
同时,由图4 可知,与单一生物炭固定化菌的修复效果相比,混合型生物炭为载体的固定化菌的修复效果更优,混合型生物炭组的修复效果与生物炭的混合比例有关。混合型生物炭CWJ2:1 组30d后对Phe(图4a)、Pyr(图4b)的去除率比单一生物炭W 固定化组的去除率分别高18.96%、16.07%,比单一生物炭固定化组的去除率分别高15.63%、13.62%。混合生物炭CWJ2:1 对Phe 的降解高于CWJ1:1 与CWJ1:2,因为生物炭含量影响土壤中PAHs 的吸附效果。CWJ2:1 中含有较多的500 ℃玉米芯生物炭,500 ℃玉米芯生物炭因为比表面积与空隙体积大,所以更适合微生物生存,且更有利于对有机物的吸附。
将可降解PAHs 耐冷真菌与细菌联合固定在生物炭载体上,构建生物炭加载真菌-细菌体系,是提高土壤PAHs 生物有效性的最佳技术途径之一。生物炭-真菌-细菌构建起的微环境作为缓冲体系,可有效屏蔽土著微生物的竞争作用和不利土壤条件的侵害作用,从而保证耐冷高效降解PAHs 微生物的良好生长;同时,耐冷PAHs 降解真菌-细菌共生体系,可充分发挥微生物生物质对土壤PAHs 活化吸附与协同降解双重作用,提高微生物生物质吸附态PAHs 生物有效性;此外,生物炭载体作为吸附剂还可以有效地富集土壤中PAHs,促进土壤中PAHs 进入生物相,可提高土壤颗粒吸附态PAHs 与载体吸附态PAHs 生物有效性;另外,生物炭通过改善土壤理化条件,亦可提高降解PAHs 的微生物活性。
3 结论
1)随着热解温度的升高,生物炭比表面积增大,炭化程度变强,灰分含量升高。4 种生物炭均为介孔结构,其中C500、W500 比表面积较大,分别为3.59、2.92 cm3·g-1;C300 的生物炭的w(C)/w(N)比值最接近25,其次为C500。综合考虑生物炭对有机污染物与微生物的吸附性能,选定C500+W500混合型生物炭为耐冷高效PAHs 降解混合菌的最适载体基材。
2)生物炭投加至土壤后,吸附剂整体比表面积增大,吸附量增加,但由于竞争吸附力的存在,土壤对Phe 的吸附量减少,在Phe 的竞争吸附中CK-Biochar、CK-Soil、CWSoil与CW 的平衡吸附量分别为0.01 μg·mg-1、25.45 μg·g-1、23.46 μg·g-1与26.46 μg·mg-1。生物炭对土壤中Phe 的竞争吸附过程更好的接近于准二级动力学模型。
3)30 d 后CWJ2:1 组对Phe、Pyr 的去除率分别为51.87%、45.28%,分别高于游离菌25.81%、23.65%,高于单一生物炭固定化组高15.63%—18.96%、13.62%—16.07%,表明生物炭起到了促进耐冷混合菌对土壤PAHs 修复的作用,而且混合型生物炭对微生物降解的促进作用优于单一型生物炭。

