蚯蚓驱动的滨海盐碱农田土壤中多环芳烃生物降解的机制研究
吴炜龙,陈艺杰,卫婷,杨贵琼,阳长洪,甄珍,蔺中
1. 广东海洋大学滨海农业学院,广东 湛江 524088;2. 广东海洋大学化学与环境学院,广东 湛江 524088
土壤盐碱化已成为全球性农业和环境问题。中国具有农业利用潜力的盐碱荒地和盐碱障碍耕地总面积约为1.33×107hm2(王佳丽等,2011),其中滨海盐碱障碍耕地面积约1.1×106hm2(胡炎等,2023)。滨海盐碱障碍耕地是中国重要的耕地资源,其合理的开发利用对中国的粮食安全具有重大战略意义(牛东玲等,2002;孙池涛等,2018)。然而,滨海盐碱障碍耕地盐分高、物理结构差、肥力水平低。加之,海洋污染和近岸人类活动导致土壤污染越来越严重,严重影响着滨海盐碱障碍耕地的粮食安全和生态健康(Yang et al.,2015;Shi et al.,2021)。多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)含有两个或两个以上苯环,具有低溶解、耐热解和难降解等特性,是典型的致畸、致癌、致突变的“三致”持久性有机污染物(Persistent Organic Pollutants,POPs)。其主要来源于环境中的焦炉废气排放、化石燃料不完全燃烧、灌溉污水和海洋原油开采渗漏等(蔡杨等,2021;丁家琪等,2023)。由于高疏水性和脂溶性,边缘海岸带中的多环芳烃很容易被土壤吸附固定,使滨海盐碱农田成为多环芳烃的重要储存库。16 种PAHs 在国际上被列为了优先控制的有机污染物(Hawliczek et al.,2012;Hernández-Veg et al. , 2017 ; Nzila , 2018 ;Kariyawasam et al.,2022)。其中,蒽(Anthracene,Ant)作为PAHs 中典型的线性三环芳烃,自然环境中降解缓慢,在PAHs 家族中生态风险相对较高。有研究表明,在广东省许多地区不同利用方式的滨海盐碱土壤PAHs 污染相对严重(Dai et al.,2022;Chen et al.,2023;)。且Zhao et al.(2023)研究了湛江湾海域中PAHs,得出PAHs 全年总浓度范围为5.15—53.7 ng·L-1,这也间接加剧了湛江区域滨海盐碱农田土壤PAHs 的污染。因此,寻找一种生态、环保、可持续的技术促进滨海盐碱农田土壤PAHs 的降解具有重要的研究意义。
自然条件下,PAHs 污染土壤中土著微生物的生物降解起主导作用,是PAHs 去除的主要途径之一(Li et al.,2009)。微生物可以将PAHs 当作唯一碳源或与其它有机质进行共代谢,转换成生命活动所需物质,达到降解PAHs 的效果(Lu et al.,2011)。然而,在实际的污染场地中,由于土著微生物“数量不多、活性不高和降解能力不足”等因素、难以达到较好的降解效果,导致土壤自净效果欠佳(Lin et al.,2016a,2016b)。滨海盐碱农田中,盐胁迫是影响土壤PAHs 降解的关键因素之一(Fernández-Luqueño et al.,2008)。盐胁迫下土壤中的土著微生物的生长严重受到抑制,降解功能微生物种群结构单一、数量不高、活性不强,致使PAHs 在滨海盐碱地土壤中的降解变得更加困难(Wang et al.,2012)。另外,PAHs 易被土壤有机质和团聚体等吸附固定,大大降低了其生物有效性和微生物反应接触机会,更难以被微生物代谢利用(钟茂生等,2012)。近年来,国内外较多研究利用外源物质激发土著微生物的降解效率,比如“添加营养物质、表面活性剂”等方法(Bolan et al.,2023),但面临费用高昂、二次污染和可持续性不高等问题。因此,探寻一种环境友好、持续稳定的低成本修复技术尤为重要。
蚯蚓被称作“土壤生态系统工程师”,广泛分布在世界不同土壤,具有极强的环境适应力和繁殖力。蚯蚓习性等可以改善滨海盐碱土壤PAHs 生物降解面临的诸多限制因素。蚯蚓能够在全盐量较高的盐碱土壤中生存(吴文良等,2001),并对土壤PAHs 污染表现出远高于微生物的耐性和抗性(潘政等,2020)。蚯蚓挖掘、扰动和吞食土壤,并在消化道和蚓粪中充分混合,增加有机污染物和土壤微生物间的表面接触和传播机会,进而提高污染物的生物有效性。蚯蚓具有极强的分解有机质的能力,在消化有机物过程中分解产生大量的氨基酸、多糖类和生物酶(Xiang et al.,2006),可为污染物的生物降解提供共代谢碳源,增强土著微生物的数量和活性。更为关键的是,蚯蚓挖掘可改善土壤通气透水条件,从而使盐碱地表层土壤中的盐分更易淋溶(张涛等,2017),进而缓解滨海盐碱地的关键盐胁迫障碍因素,改善滨海盐碱地土壤健康质量状况。大量研究表明,蚯蚓可加速农田土壤农药、多氯联苯、多环芳烃和邻苯二甲酸酯等有机污染物的生物降解(Lin et al.,2018;Lin et al.,2021)。但蚯蚓强化滨海盐碱农田土壤中PAHs 降解的效果和作用机制研究较少,降解过程中的强化效果主要源于非生物作用还是生物作用有待研究,且关键环境影响因子和降解功能微生物仍未可知。因此,深入了解蚯蚓对盐碱土壤PAHs 污染的降解效果和微生物作用机制,可为丰富和发展滨海盐碱农田的合理开发利用提供理论依据。
1 材料与方法
1.1 供试材料
供试土壤采自广东省湛江市麻章区广东海洋大学实验基地(21°09′10.07″N、110°18′51.98″E),该基地长期种植海水稻。在不同地块的4 个角落以及中心点采样,用土壤采样器采集表层土(0—20 cm),并将所有地块所采的土壤混匀,室内自然风干后除去植物根系和石子等杂物,过20 目筛(孔径0.85 mm)备用。供试土壤未发现蒽污染,土壤pH为7.73,有机质含量为25.21 g·kg-1,胡敏素为13.05 g·kg-1,富里酸为2.30 g·kg-1,胡敏酸为1.57 g·kg-1,全盐量为2.17 g·kg-1。
试验供试蚯蚓为赤子爱胜蚓,购自广东省元辉蚯蚓养殖场。试验前将蚯蚓驯化,具体方法为:按每50 只放入1 kg 试验土壤中,保持土壤湿度为最大田间持水量的60%,且在25 ℃恒温培养箱中避光培养两周。试验时选取健壮、大小相当、具有环带的成年蚯蚓,用无菌水清洗干净放置于装有湿润滤纸的烧杯中。在黑暗培养箱中,室温25 ℃条件下培养24 h,使其排出体内粪便。
蒽为分析纯(ALFA,97%,中国医药公司)。用少量甲醇溶解蒽,再用正丁醇定容配制成500 mg·L-1的蒽的正丁醇溶液作为母液,避光保存,其他化学品均为分析纯。
1.2 试供土壤处理与蚯蚓培养
将土壤分为两个平行处理组,即不做处理的自然土壤(简称自然土)和在高压灭菌锅121 ℃条件下,灭菌3 h 的灭菌土壤(简称灭菌土)。灭菌土用平板划线法判断是否灭菌完全(罗舒文等,2020)。
在无菌操作台上,取灭菌土和自然土各2 kg,分别装入4 个灭菌的陶瓷盆(上口直径28 cm、底座直径18 cm、高度17 cm)中,每个陶瓷盆装土1 kg,用无菌水将土壤保持在最大田间持水量的60%。通过对比试验前期设置的不同污染浓度土壤试验效果以及借鉴前人的研究经验(井永苹,2013;史志明,2014;Zhu,2022),土壤中蒽的浓度过低时,无法达到试验效果,过高时则对土壤生物存在不可忽略的影响。因此试验土壤中蒽的污染浓度设置为10 mg·kg-1。具体方法为:取每组少部分供试土壤分别加入20 mL 母液(500 mol·L-1蒽的正丁醇溶液),再采用逐级等份混合法充分混匀,待有机溶剂充分挥发后,将其分别拌入各组供试土壤中贴上标签,室温平衡24 h 后放蚯蚓。试验设计如下:灭菌对照(SS)、自然对照(OS)、灭菌土壤+15 条蚯蚓(SE)、自然土壤+15 条蚯蚓(OE),每组处理设置3 个重复。
每组处理陶瓷盆均用纱布盖上,放入温度为25 ℃恒温培养箱里通风避光培养40 d;每天用无菌水补充因蒸发损失的水分一次,分别于培养第0、10、20、30 天及第40 天时取样,测定土壤pH、有机质(SOM)和腐殖质组分胡敏酸(HA)、胡敏素(HM)和富里酸(FA)的质量分数及蒽的含量。在第40 天培养结束时,取SE、OE 处理组中的蚓粪,将其储存于-80 ℃冰箱中,用于微生物群落结构分析。
1.3 土壤理化性质测定
采用电位法测定土壤pH(鲍士旦,2000)。将过2 mm 筛的风干土样5.00 g 置于25 mL 烧杯中,并加入12.5 mL 去二氧化碳蒸馏水,充分搅动,使土样充分分散。静置2 h 后,取上清液,用校准后的雷磁pH 计(型号为PHSJ-3F,上海仪电科学仪器股份有限公司)测定pH 值。
土壤有机质采用重铬酸钾外加热法进行测定。取风干土壤0.3 g 置于消煮管中,加入体积分数为98%的硫酸和重铬酸钾溶液(0.8 mol·L-1)各5 mL,并在170—180 ℃下消煮5 min。消煮后,冷却至室温倒入锥形瓶中,用50 mL 蒸馏水多次冲洗消煮管,并将清洗液转入锥形瓶。加入2—3 滴邻菲罗啉作为指示剂,用0.2 mol·L-1的硫酸亚铁滴定至砖红色,按硫酸亚铁的用量推算土壤有机质的含量。
参照标准方法(中国标准出版社,2007)对土壤中腐殖质组分进行测定。取10 g 风干土样研磨后过0.149 mm 筛,装于小广口瓶中备用。将5 g 土样置于250 mL 锥形瓶并加入100 mL 浸提剂(均为0.1 mol·L-1的焦磷酸钠和氢氧化钠混合液),加塞震荡5 min 后,用沸水煮1 h。摇匀并用离心机离心澄清,取上清液于锥形瓶中待测。随后操作同有机质的测定。
吸取10 mL 浸出液移入液试管中(盛有少量石英),用0.5 ml·L-1硫酸中和pH 为7,使溶液出现混浊为止。用水浴蒸发至近干,用重铬酸钾氧化-外加热法测定胡敏酸和富里酸总碳。
取40 mL 浸出液移入锥形瓶中,加热近沸,用0.5 mol·L-1硫酸调pH 至2—3,出现絮状沉淀后,用80 ℃水浴保温半小时,静置过夜。取细孔滤纸用0.025 mol·L-1硫酸湿润,过滤上述清液,再用0.05 mol·L-1硫酸洗涤沉淀多次。用热的0.05 mol·L-1氢氧化钠洗涤溶解沉淀,经细孔滤纸过滤移入100 mL容量瓶,用水定容并摇匀。取20 mL 溶液移入试管中,用0.5 mol·L-1硫酸调到pH 为7,出现浑浊为止。用水浴蒸发至近干,用重铬酸钾氧化-外加热法测定胡敏酸碳量。
胡敏素含量采用差减法计算。
采取残渣烘干-质量法测定(鲍士旦,2000),取过筛风干土样15 g 配置水土比为5∶1 的土壤浸出液,吸取50 mL 土壤浸出液放于烘干的瓷蒸发皿内,在水浴中蒸干。用150 g·L-1的H2O2使残渣湿润,继续蒸干,反复用H2O2处理,使残渣全为白色。再将残渣和蒸发皿放于105 ℃烘箱中烘干1 h,取出冷却后称质量。将蒸发皿和残渣再次烘干0.5 h,取出放在干燥器中冷却称质量。用两次质量计算出土壤水溶性盐总量。
1.4 土壤中蒽含量的测定及相关计算
土壤中提取蒽参照姚炎红等(2016)的方法,采用索氏提取法提取和浓缩。样品中蒽的含量测定参照代军帅等(代军帅等,2018)的方法,用高效液相色谱仪(Agilent 1260 Infinity II)测定。测定条件为:Φ4.6mm×250mm C18柱,进样量为10 μL,甲醇(A 相)和超纯水(B 相)作为流动相,流速0.6 mL·min-1,色谱柱维持在30 ℃下进行色谱分析,分析波长274 nm。配置浓度为50、100、200、500和1 000 μg·L-1的标准系列获得标准曲线,校准曲线的相关系数大于0.995。该方法下回收率为82.6%—97.7%,检出限为4.2 μg·kg-1,(信噪比S/N=3)。
1.5 土壤微生物群落的高通量测序
采用BioFast Soil Genomic DNA Extraction Kit(BIOEER,中国杭州)试剂盒对培养40 d 的不同处理土壤微生物总DNA 进行提取,利用核酸蛋白定量检测仪测定DNA 的浓度,采用1%琼脂糖凝胶电泳评价DNA 质量。提取的土壤总DNA 利用引物(338F:5′-ACTCCTACGGGAGGCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′)对V3—V4 区域进行PCR 扩增。反应体系为:2×Tap PCR Master Mix 10.0 μL、引物2.0 μL、模板DNA 1.0 μL,超纯水(用于将体积补至20.0 μL)。扩增条件为:95 ℃下,进行3 min 预变性,再进行30 s 变性,随后55 ℃下进行30 s 退火,最后在72 ℃下进行45 s 延伸,循环27 次,最后于72 ℃下进行10 min 的延伸。用质量分数2%琼脂糖凝胶回收扩增后的产物并进行检测,最后送至美吉测序平台进行测序。使用Flash 软件对高通量所得数据进行拼接,过滤拼接得到的序列,再使用Uchime 软件鉴定并去除嵌合体序列,获得最终有效数据。使用QIIME 软件对序列在97%的相似度水平下进行聚类、获得OUT。所有的OTUs 分类学注释在Silva数据库(https://www.arbsilva.de/)平台完成。使用QIIME 中核糖体数据库获得科水平上的细菌群落物种丰富图。使用QIIME 基于Euclidean 算法得到聚类热图。
1.6 数据处理与分析
蒽的降解效率通过公式来计算:
式中:
E——蒽的降解效率;
A0——第0 天土壤蒽含量(g·kg-1);
Ai——第i天土壤蒽含量(g·kg-1);
i——培养时间(d)。
利用SPSS 25.0 对试验理化数据(蒽的降解效率、土壤理化性质)进行正态分布和方差齐检验,并且对数据进行单因素方差分析(One-way ANOVA)。用Duncan’s 法对不同处理间进行多重比较(P<0.05)检验不同处理间的显著差异性。利用Origin 2022 完成环境因子(pH、有机质等)的柱形图绘制。以Spearman 和Pearson 为基础,采用Cytoscape 软件将微生物、蒽残留浓度和环境因子之间的相互作用通过共现网络可视化。
2 结果与分析
2.1 不同处理下蒽的降解效率
整个培养期内,所有处理中土壤蒽的降解效率均呈显著上升趋势(图1)。自然对照(OS)中蒽的降解效率始终高于灭菌对照(SS),添加蚯蚓可显著提升自然土壤(SE)和灭菌土壤(OE)中蒽的降解效率。实验结束时(40 d),SS 处理中蒽的残留浓度最高(8.67 g·kg-1),降解效率仅为17.7%。OS 处理中蒽的残留浓度为6.29 g·kg-1,降解效率为40.7%。OS 处理中蒽的降解效率比SS 处理中蒽的降解效率高23.0%,表明没有蚯蚓的自然土壤中蒽的降解以生物降解为主(23.0%),而不是非生物降解(17.7%)。添加蚯蚓可以显著加速土壤中蒽的降解,自然土壤中添加蚯蚓处理(OE)的蒽的残留浓度最低为3.94 g·kg-1,降解效率高达62.1%,灭菌土壤添加蚯蚓处理(SE)的残留浓度最低为5.27 g·kg-1,降解效率为50.4%。结果表明:蚯蚓强化非生物降解和肠道菌群作用共同的效果(32.7%)高于蚯蚓强化土著微生物降解的效果(21.4%)。

图1 不同处理蒽降解效率随时间的变化Figure 1 Variation of anthracene degradation efficiency with time for different treatments
2.2 土壤理化性质在不同处理下的变化
图2 显示了土壤pH 值、有机质、富里酸、胡敏酸、胡敏素和全盐量的在整个培养过程中的变化情况。土壤pH 值(图2a)在处理SE 和OE 中始终呈下降趋势,而对照SS 和OS 中土壤pH 值变化不明显。实验结束时(40 d),添加蚯蚓的处理(SE 和OE)土壤pH 值分别为7.52 和7.34,均显著低于对照SS 和OS(7.77 和7.70)的pH 值(P<0.05)。添加蚯蚓可以显著降低土壤的有机质含量,实验结束时(40 d),自然土壤添加蚯蚓处理(OE)中有机质含量为(19.6 g·kg-1),显著低于灭菌土壤添加蚯蚓处理(SE)中的有机质含量(21.7 g·kg-1),二者均显著低于自然和灭菌土壤对照中的有机质含量(25.4 g·kg-1和24.6 g·kg-1)。添加蚯蚓显著提升了土壤腐殖质各组分胡敏素、胡敏酸和富里酸的含量(P<0.05),实验结束时,处理OE 中胡敏素、胡敏酸和富里酸的含量分别增加了2.94、0.14 和0.63 g·kg-1,处理SE 中胡敏素、胡敏酸和富里酸的含量分别增加了2.40、0.34 和0.68 g·kg-1。
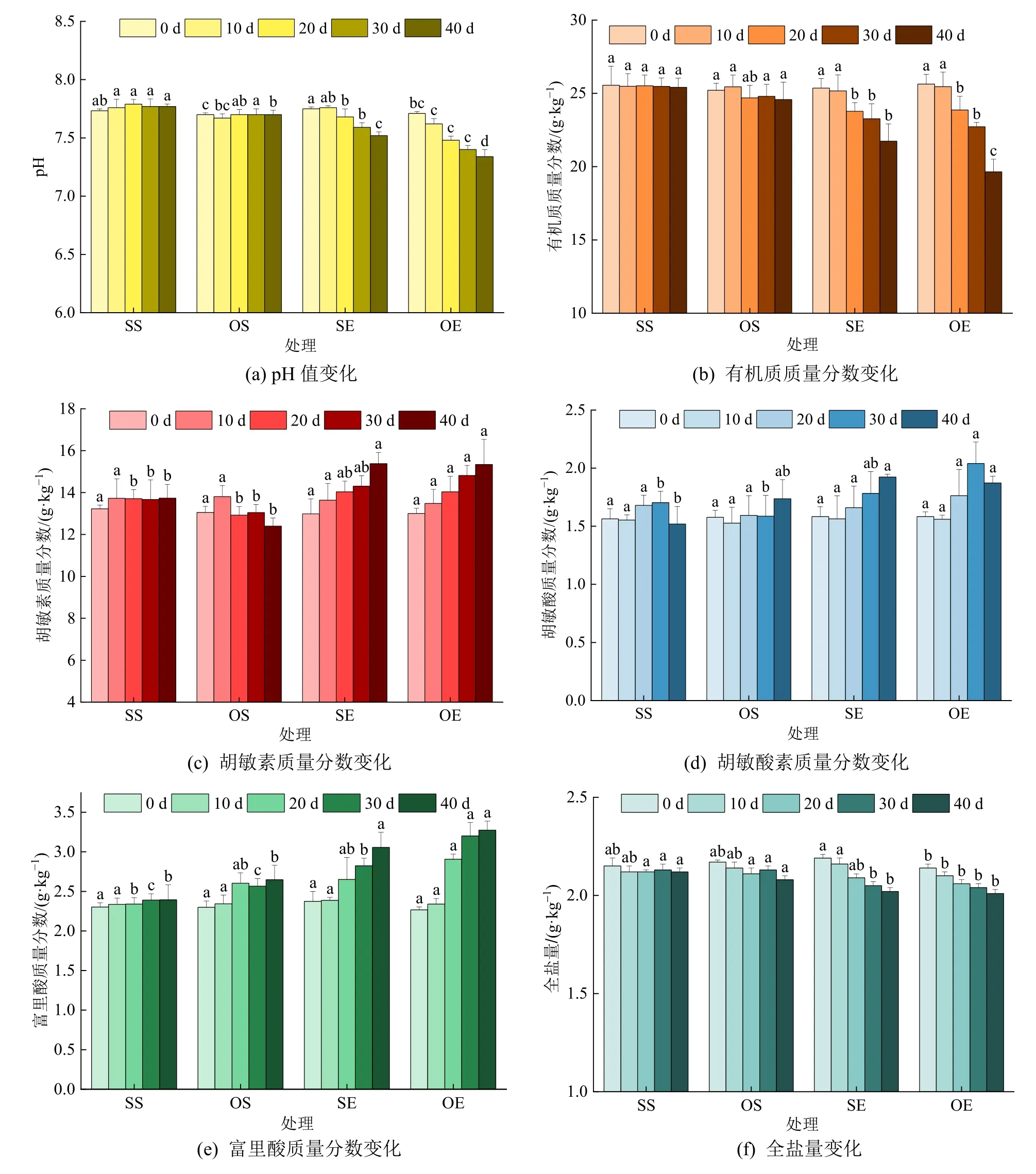
图2 不同处理土壤理化性质随时间的变化Figure 2 Variation of soil physicochemical properties with time for different treatments
2.3 不同处理的土壤微生物群落结构
在科水平上,将相对丰富度前27 的细菌科选为优势细菌科,剩余归为其他(Others)。从图3a 中可以看出,在 OS 处理中以 unclassified_p__Acidobacteria、丛毛单胞菌科(Comamonadaceae)、unclassified_c__Betaproteobacteria、unclassified_p__Gemmatimonadetes_d__Bacteria、黄色单胞菌科( Xanthomonadaceae)、嗜甲基菌科(Methylophilaceae)和环状菌科(Cyclobacteriaceae)为主,约占样品总丰度的38.2%,其中土壤中的假单胞菌科(Pseudomonadaceae)、伯克氏菌科( Burkholderiaceae)和气单胞菌科(Aeromonadaceae)等微生物均占较低的样品总丰度。在OE 处理中以unclassified_p__Acidobacteria、unclassified_c__Betaproteobacteria、unclassified_p__Gemmatimonadetes_d__Bacteria、伯克氏菌科、黄色单胞菌科和气单胞菌科为主,约占样品总丰度的34.7%。与OS 处理相比,OE 处理使伯克氏菌科、气单胞菌科的丰度分别提高了238%、730%。在蚯蚓粪(SE-cast)中,以丛毛单胞菌科、假单胞菌科、环状菌科、红杆菌科(Rhodobacteraceae)、伯克氏菌科和气单胞菌科为主,占样品总丰度的38.3%。图3b 为不同处理及蚓粪的细菌科水平微生物群落结构聚类热图。其中样品SE 处理土壤和SE_cast 的微生物群落结构相近,但与OE_cast(蚯蚓粪)、OE处理和OS 处理分离。其中气单胞菌科、黄杆菌科(Flavobacteriaceae)、伯克氏菌科在OS 处理中的丰度较低,而在OE、OE_cast 中的丰度逐级增加。综上结果表明,自然土中土著微生物伯克氏菌科、气单胞菌科等微生物丰度均比较低,而添加蚯蚓后,改变了土壤中微生物的群落结构以及提升了土壤中土著微生物伯克氏菌科、气单胞菌科等微生物的丰度。同时蚯蚓肠道中还存在伯克氏菌科、鞘脂单胞菌科、黄杆菌科和气单胞菌科等肠道微生物,这些微生物通过蚓粪从蚯蚓肠道定植到土壤当中,进一步的改变了土壤中的微生物群落结构和丰度。

图3 不同处理微生物在科水平上的相对丰度与群落结构Figure 3 Relative abundance and community structure of microorganisms at the family level in different treatments
2.4 蚯蚓影响下环境因子、土壤微生物及蒽的残留浓度的相关性
通过网络分析图(图4)来探讨了土壤中的微生物、环境因子和土壤中蒽的残留浓度之间的联系。该网络图由17 个节点(10 种微生物科、蒽残留浓度和6 个环境因子)和16 个边缘组成。网络分析图中显示,微生物均与蒽的残留浓度呈负相关,其中气单胞菌科、鞘脂单胞菌科、黄杆菌科和伯克氏菌科与蒽的残留浓度为显著负相关(P=0.02)。环境因子中,胡敏酸、胡敏酸和富里酸与与蒽的残留浓度呈负相关,pH、有机质和含盐量与蒽的残留浓度呈正相关,其中pH、有机质与蒽的残留浓度呈显著正相关(P=0.03 和P=0.04)。
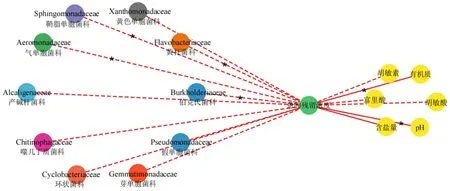
图4 环境因子、土壤微生物与蒽的残留浓度间的网络分析图Figure 4 Network analysis diagram of the residual concentration of anthracene among environmental factors,soil microorganisms
3 讨论
本试验探讨添加蚯蚓对滨海盐碱土壤中蒽降解效率的影响,以及蚯蚓在PAHs 污染土壤修复中的作用机制。在试验第40 天时,不同处理之间蒽的降解效率依次排序为:SS (17.7%)<OS (40.7%)<SE(50.4%)<OE (62.1%)(图1),表明添加蚯蚓可显著促进滨海盐碱土壤中蒽的降解(P=0.001)。蚯蚓能够对有机污染物产生富集作用,并且挖掘和吞食等生命活动改变土壤理化性质、微生物数量和活性,对蒽在土壤中的降解产生影响。在我们前期的研究结果证明,蚯蚓通过富集在体内的有机污染物量较少,对污染物总体的去除效果产生的影响较小(Lin et al.,2016b),降解效果主要来源于非生物降解和微生物降解。并且有研究表明,蚯蚓对PAHs 等有机污染物的富集能力较弱,其体内富集量只占去除总量的很少一部分,并不是去除污染物的主要途径(Ma et al.,1998;井永苹,2013)。在试验中,蒽进入土壤后,与土壤组分容易紧密结合,限制了蒽在土壤中迁移、传质和衰减(蒋绪洋,2022),降低了蒽的可提取性和生物有效性(Kelsey et al.,1997)。并且,在滨海盐碱土壤中,微生物的生长由于盐胁迫的影响受到抑制,使PAHs 在盐碱土中的微生物降解变得更为困难(Wang et al.,2012)。
在40 d 时,OE 处理和SE 处理的含盐量分别下降了0.12、0.16 g·kg-1,显著低于OS 处理和SE处理(P=0.03),说明蚯蚓降低了土壤含盐量。有研究表明,蚯蚓能够在含盐量较高的盐碱土中存活(吴文良等,2001),具有改良盐碱地的效果(伍玉鹏等,2013)。这可能是因为蚯蚓的生命活动间接的促进了土壤盐分自然淋洗的过程(张涛等,2017),以及蚓粪中的Ca2+与土壤中的Na+交换量增加,降低了土壤中Na+含量,进而导致土壤全盐量下降(Oo et al.,2015),与于英钗等(2019)的研究结果一致。此外,SE 处理中蒽的降解效率比SS 处理提高了32.7%,说明蚯蚓能够在灭菌条件下促进蒽的降解,这主要为蚯蚓强化非生物降解和肠道菌群共同作用的效果。在SE 处理中有机质比SS 处理显著下降了3.67 g·kg-1(图2b)(P=0.001),胡敏素、富里酸和胡敏酸分别显著提升了1.65、0.66 和0.40 g·kg-1(图2c—e)(P=0.04、P=0.01 和P=0.011)。这主要是因为蚯蚓改善土壤结构、通气性和疏水性,使土壤孔隙度变大,增加土壤中的O2含量和湿度(井永苹,2013),并且促进土壤腐殖质的形成和富集(张与真等,1981;王庆洲等,2013),使土壤可溶性有机碳增加(Kalbitz et al.,2006)。而在可溶性有机碳中含有羧基等活性官能团(Zhang et al.,2022),羧基等活性官能团被Tian et al.(2023)证明在PAHs的氧化降解过程中发挥着关键作用。并且Xu et al.(2013)研究发现土壤中O2、水分的增加,均能增强土壤表层的PAHs 光解。这就表明添加蚯蚓影响土壤中O2含量和水分,并且增加土壤中活性官能团的含量,进而影响PAHs 在土壤中的非生物降解。在本实验中,土壤有机质含量与土壤中蒽的残留浓度呈显著正相关(P=0.04)(图4),表明随着有机质含量的下降,土壤中蒽的降解效率增加,这很好的吻合了我们的研究结果。此外,土壤pH 是影响土壤污染物修复的重要因素。在第40 天时(图2a),不同处理间的pH 值差异显著(P=0.001)。OE 处理的pH 比OS 处理下降0.36 个单位,SE 处理的pH比SS 处理下降0.25 个单位。这主要是因为蚯蚓分泌体表粘液等生命活动对土壤的酸碱性起到调节作用(Hao et al.,2018;Luo et al.,2022)。蚯蚓可以沉积pH 值较高的土壤颗粒,显著改变土壤微环境,中和土壤pH 值(Lin et al.,2016b),提高土壤的保水能力。已有研究表明,PAHs 类污染物在偏中性土壤中具有较高的生物有效性,从而促进PAHs 的生物降解(Kästner et al.,1998)。例如,Kim et al.(2005)研究表明,将土壤的pH 值调整到7.0 后,PAHs 的降解得到了有效的加强,甚至一单位的pH 值变化能使菲的降解效率增加了4 倍。在本实验中,土壤pH 与土壤中蒽的残留浓度呈显著正相关(P=0.03)(图4),表明随着pH 的下降,土壤中蒽的降解效率增加,这很好的吻合了我们的研究结果。
土壤微生物是有机物污染土壤修复的主要因素,在环境中的PAHs 污染修复方法主要以微生物降解为主(Jacques et al.,2008;Moscoso et al.,2012)。如图3b 所示,样品SE 处理土壤和SE_cast(蚯蚓粪)中的微生物群落结构相近,说明SE 处理中的微生物均为蚯蚓通过排泄定植的肠道微生物,并且其中含有伯克氏菌科、气单胞菌科和鞘脂单胞菌科等PAHs 降解菌(宋兴良等,2010;于瑶瑶等,2015;黄兴如等,2016;闫双堆等,2021),说明蚯蚓能够通过蚓粪将其肠道中功能微生物定植到土壤当中。而OE 处理和OS 处理土壤微生物群落结构相近,与OE_cast(蚯蚓粪)具有差异,说明OE 处理中,蚯蚓影响了土壤中微生物的群落结构。其中OE_cast中的微生物丰度相对较高,主要是因为蚯蚓粪中富含氮、磷、钾、微量营养素和酶等(Yadav et al.,2011),促进了微生物的生长(Pramanik et al.,2010),并且蚯蚓粪还会影响土壤微生物的相互作用(Singh et al.,2020;Zhao et al.,2020),进而影响到微生物群落结构。在本实验中,相比OS 处理,OE 处理中的土壤微生物的丰度增加,其中伯克氏菌科、气单胞菌科等降解菌的丰度分别提高了238%、730%。这主要是因为蚯蚓改善了土壤环境(袁向华等,2017),以及蚓粪定植的微生物与土著微生物相互作用(Lin et al.,2018),促使土壤中部分微生物的生长繁殖,从而影响土壤微生物群落结果。并且有研究表明,添加蚯蚓影响了土壤中污染物降解微生物的丰度(潘声旺,2009),从而促进有机污染物的降解(Lin et al.,2021)。在本试验中,土壤蒽的残留浓度与伯克氏菌科、气单胞菌科、鞘脂单胞菌科和黄杆菌呈显著负相关(P=0.02、P=0.03、P=0.02 和、P=0.01),表明随着伯克氏菌科、气单胞菌科、鞘脂单胞菌科和黄杆菌丰度的增加,土壤中蒽的降解效率增加,这与我们的研究结果相符。
4 结论
1)蚯蚓可以显著强化滨海盐碱农田土壤中蒽的降解,其中包括强化非生物降解和微生物降解。强化降解效果主要源于土著微生物丰度的提升和蚯蚓肠道微生物的释放等微生物降解作用。
2)蚯蚓可强化土壤原有降解微生物伯克氏菌科和鞘脂单胞菌科等微生物的丰度,加速土壤蒽的生物降解。蚯蚓通过蚓粪释放肠道降解菌假单胞菌科、伯克氏菌科和气单胞菌科,并可定植降解菌假单胞菌科、伯克氏菌科和鞘脂单胞菌科到土壤中,进而可加速土壤蒽的生物降解。
3)蚯蚓通过降低土壤pH 值,促进土壤有机质分解为腐殖质等改变环境因子的作用,间接加速了滨海盐碱地土壤中蒽的非生物降解。

