铜渣氧载体煅烧改性及氧化还原特性研究①
董鑫江, 左宗良, 杨涵奇, 罗思义
(青岛理工大学,山东 青岛 266520)
化学链燃烧(Chemical Looping Combustion, CLC)是一种利用氧载体间接燃烧煤炭等化石能源的清洁无污染燃烧技术[1]。 氧载体是该技术的核心,应具有携氧能力强、氧化还原活性高、耐磨、抗烧结、生产成本低、环保等特点[2-3]。 目前满足上述要求的氧载体主要集中在过渡金属氧化物,如铁基[4-5]、铜基[6]和锰基氧载体[4-5],以及含有多种金属的复合氧载体[7]。 制备复合氧载体主要采用溶胶-凝胶法、共沉淀法、水热合成法、固相合成法、冷冻成粒法、机械混合法和浸渍法等方法[8]。 这些制备方法存在价格昂贵、制备困难等问题,降低氧载体制备成本是当前重要研究方向。 铜渣作为典型的有色冶金固废物质,其主要成分是铁橄榄石[9],实现其资源化利用是冶金行业关注的重点[10-11]。 通过粒化后煅烧处理,将铜渣内部的Fe 向Fe2O3和Fe3O4富集,提高载氧能力,实现铜渣的资源化利用,可以制备廉价氧载体[12-13]。 本文采用干法离心粒化制备铜渣氧载体,并研究其氧化特性和还原特性以及氧化温度、还原温度、铜渣粒径及CaO 加入对铜渣物相组成的影响。
1 实验材料和方法
1.1 实验材料
实验材料:铜渣粉末,褐煤,氮气。 实验所用铜渣来自国内某闪速熔炼炉产生的在空气气氛中缓冷冷却的铜渣。 铜渣经X 射线荧光分析,其主要元素的氧化态化学组成如表1 所示。 对金属氧化物的含量进行XRF 半定量检测时默认铁的氧化物为最高价态。
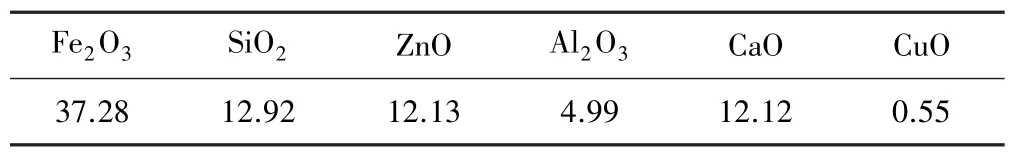
表1 铜渣XRF 成分检测结果(质量分数) %
铜渣XRD 检测结果如图1 所示,铜渣中含铁物相主要为铁橄榄石(2FeO·SiO2)、磁铁矿(Fe3O4)[9]。铜渣中的SiO2与FeO 形成铁橄榄石,另外更大部分呈现为硅灰石及无定形、不透明的玻璃体。 Cu 元素主要以Cu2O 和CuS 形式存在[14]。

图1 铜渣XRD 检测结果
实验采用的煤粉为煤质化程度比较轻的褐煤,实验前对褐煤采用EMA502 分析仪进行有机元素分析,并采用LDGFY-6000S 全自动工业分析仪进行工业分析,褐煤元素分析和工业分析结果如表2 和表3 所示。

表2 褐煤元素分析结果(质量分数) %

表3 褐煤工业分析结果(质量分数) %
1.2 实验装置与方法
首先对铜渣进行粒化处理,将铜渣放入高温箱式电阻炉(HMF-16G)内加热至1 350 ℃并保温2 h。 待铜渣至熔融态后,将液态铜渣倒入离心粒化装置内。利用转杯离心粒化装置将熔融铜渣破碎为粒径0.15 ~2.36 mm 的均匀铜渣颗粒,在空气中将铜渣颗粒冷却至室温[9]。 褐煤煤粉经过干燥处理后,采用破碎机(GJ-2DB)破碎至0.074 mm 以内。
铜渣氧化特性测试分析时,预先将铜渣平铺在刚玉舟内,送入高温真空管式炉(HWL-16G,控温精度±0.1 ℃)中,加热过程中以50 mL/min 的流量通入空气,高温真空管式炉按照预先设定的升温速率升至设定温度并保温一定时间。 待氧化煅烧完成后向炉内继续通入空气,待冷却至100 ℃以下后取出。
铜渣还原特性测试分析时,预先将铜渣与褐煤煤粉按一定比例充分混合后平铺在刚玉舟内,送入高温真空管式炉(HWL-16G,控温精度±0.1 ℃)中,以50 mL/min的流量向炉内预通氮气15 min,确保炉内空气排净,随后按照预先设定的升温速率升温至设定温度并保温一定时间。 待还原完成后向炉内继续通入氮气,待冷却至100 ℃以下后取出。
反应后的样品破碎至0.074 mm 左右后,采用XRD 扫描分析其物相组成。 本文实验工况如表4 及表5 所示。 实验分别考察不同氧化温度、还原温度、铜渣粒径及CaO 加入等对铜渣物相组成的影响。

表4 氧化煅烧测试实验工况
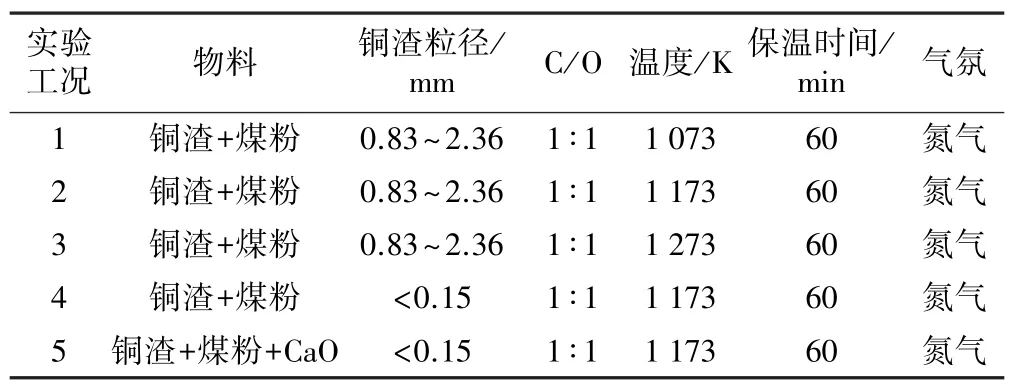
表5 还原煅烧实验工况
2 铜渣氧化及还原特性热力学分析
2.1 铜渣氧化热力学分析
铜渣中主要含铁氧化物为铁橄榄石和磁铁矿。 在氧化煅烧过程中,铜渣中潜在的氧载体主要为铁和铜氧化物,潜在反应如式(1)~(6)所示[12,15]。 各反应吉布斯自由能变化曲线如图2 所示。 各反应吉布斯自由能均随温度升高逐渐升高。 铜渣中存在微量的铁单质,煅烧过程铁单质逐级发生氧化,如式(1)、(3)所示。 铜渣中的二价铁主要以铁橄榄石形式存在,其氧化过程实际是氧化脱硅过程,将逐级完成向Fe3O4及Fe2O3的氧化,如式(1)、(3)所示。 Cu2O 及Cu2S 在氧化煅烧时,通过氧化反应生成更加稳定的CuO,如式(4)、(5)所示。 Merve Durmaz 研究指出CuFe2O4可作为铜渣化学链氧载体的重要成分,其实质是FeO 和Cu的复合物[11]。 CuFe2O4的氧化生成过程实际是FeO和Cu 同步氧化形成复合物的过程,如式(6)所示。
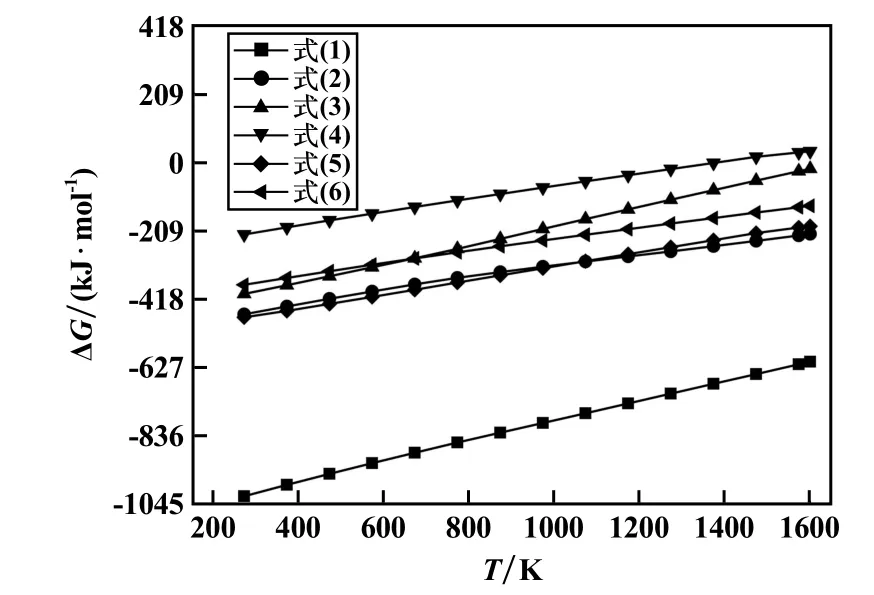
图2 铜渣氧化反应吉布斯自由能变化曲线
2.2 铜渣还原热力学分析
Fe-O-C 系平衡图[16]可以描述在不同温度与C/O条件下,Fe 及其氧化物能够稳定存在的区域。 当温度T>843 K 时,铁氧化物还原过程的反应顺序为Fe2O3→Fe3O4→FeO→Fe,当温度T<843 K 时,铁氧化物还原过程的反应顺序为Fe2O3→Fe3O4→Fe(FeO 不能存在)。在还原煅烧过程中不仅铜渣中含铁氧化物会与硅酸盐、铝酸盐发生固相反应,生成铁橄榄石(2FeO·SiO2)及铁尖晶石(FeAl2O4)等化合物,而且煤粉中的C 会对这些化合物进行还原。 对其中含铁物相生成铁橄榄石(2FeO·SiO2)及铁尖晶石(FeAl2O4)的高温还原过程进行详细热力学计算,如图3 ~4 所示,化学反应见式(7)~(20)。 其中反应(7)~(9)、反应(13)~(15)、反应(17)为直接还原反应,反应(10) ~(12)、(16)、(18)~(20)为间接还原反应。 随着温度升高,还原反应的吉布斯自由能逐渐降低,即高温有利于提高还原反应势。
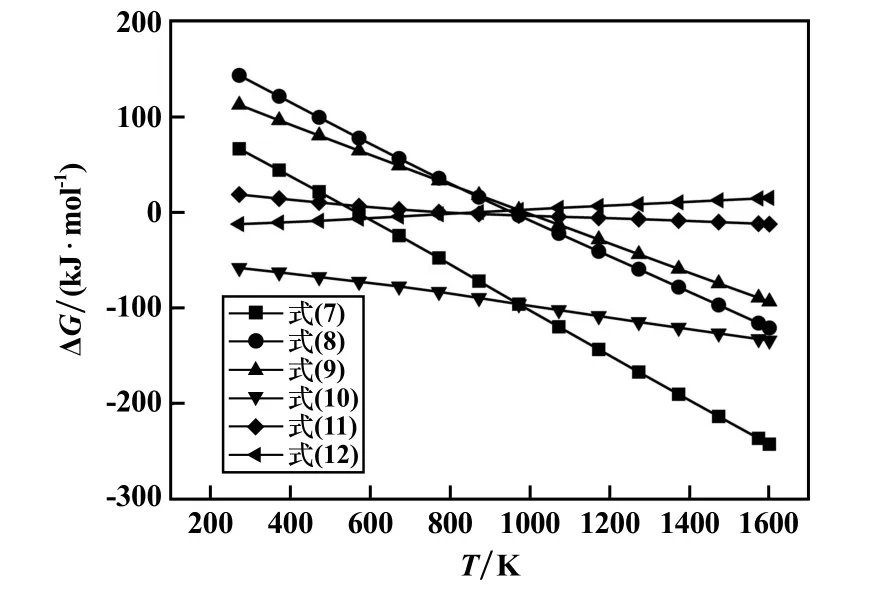
图3 铜渣内金属氧化物还原反应吉布斯自由能变化曲线

图4 铜渣内复合金属氧化物还原反应吉布斯自由能变化曲线
3 铜渣氧化及还原特性实验结果
3.1 温度对铜渣氧载体氧化和还原产物成分的影响
氧化和还原特性实验主要考察含铁氧化物的组成变化情况。 由于其他微量元素杂峰变化不明显,本文不做进一步考察。 不同氧化温度下铜渣物相组成如图5所示。 通过图5 可以看出,氧化煅烧使铜渣中的含铁氧化物(2FeO·SiO2)向Fe3O4和Fe2O3有效转变。 温度对铜渣内含铁物相的吸氧转变具有重要作用,随着反应温度提高,铜渣中Fe3O4峰逐渐减弱,Fe2O3峰逐渐增强,进一步说明了铜渣中铁的吸氧反应是分级进行的,铜渣中铁元素吸氧的顺序为Fe→FeO→Fe3O4→Fe2O3。

图5 不同氧化温度下铜渣XRD 图谱
不同还原温度下铜渣物相组成如图6 所示。 可以看出,煤的还原作用使铜渣中含铁的高价氧化物向单质铁转变。同样,温度对铜渣内释氧反应转变具有重要作用,随着反应温度提高,铜渣中Fe2O3峰已经不存在,Fe 单质物相的峰逐渐增强。 1 073 K 时,还原不足,铜渣中的2FeO·SiO2物相依然存在;1 173 K 时,Fe 单质峰出现,且在温度升至1 273 K 时Fe 单质峰增强,2FeO·SiO2物相的峰逐渐消失。 这进一步说明铜渣中铁的还原反应是分级进行的,还原反应顺序为Fe2O3→Fe3O4→FeO→Fe。 铜渣中铁的还原过程也符合Fe-O-C 系平衡图热力学过程。

图6 不同还原温度下铜渣XRD 图谱
3.2 铜渣粒径对铜渣氧载体的氧化和还原反应的产物成分影响
不同铜渣粒径下铜渣物相组成如图7 所示。 通过图7 可以看出,氧化煅烧使不同粒径铜渣中的含铁氧化物(2FeO·SiO2)均不同程度地向Fe3O4和Fe2O3转变。 对于通过离心粒化得到的铜渣颗粒(粒径为0.83~2.36 mm,0.15 ~0.83 mm),氧化煅烧均使铁橄榄石中FeO 完成了逐级转变。 铜渣粒径越小,越利于FeO 及Fe3O4吸氧反应过程物质的扩散。-0.15 mm 铜渣粉末内Fe3O4峰已经不明显,绝大部分铁橄榄石相转变为赤铁矿相,即Fe2O3。
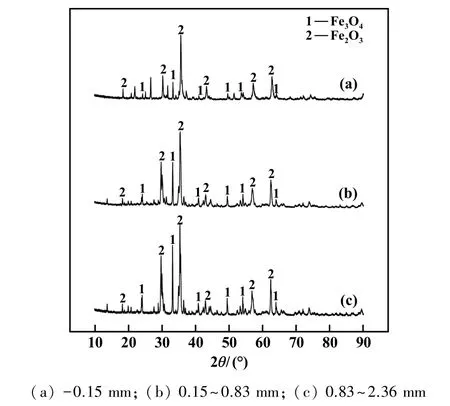
图7 不同粒径下氧化铜渣XRD 图谱
铜渣粒径及造渣剂对释氧还原过程的影响见图8。从图8 可以看出,还原反应后,-0.15 mm 粒级铜渣比0.83~2.36 mm 粒级铜渣的Fe 单质峰更强,但物相中仍有Fe3O4存在。 由此可以看出,对于颗粒较小的铜渣氧载体,其本身的氧化能力无法将其中的氧全部释放出来,需要加入其他的物质来强化氧载体的释氧能力。 CaO 价格低廉并且具有高氧化能力、热稳定性和表面活性等优点,因此本研究中,采用造渣剂CaO 来强化铜渣载氧体的释氧能力,从图8(a)可以看出,加入造渣剂CaO 时,铜渣还原反应得到增强,含铁氧化物全部释氧,物相中Fe3O4全部完成转化。 这主要是因为CaO 与SiO2反应生成了硅酸钙,促进了铜渣中铁橄榄石脱硅反应的进行。
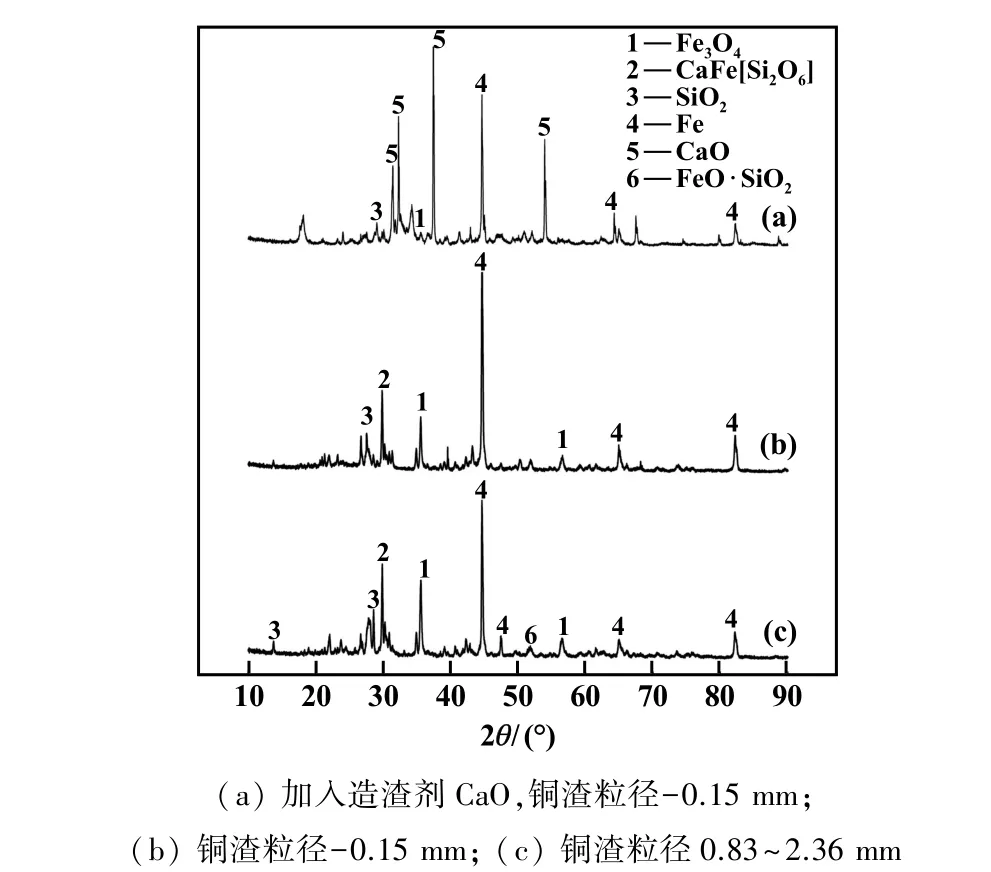
图8 不同粒径及造渣剂条件下还原铜渣XRD 图谱
4 结 论
1) 铜渣中的铁主要以铁橄榄石2FeO·SiO2形式存在,其氧化过程实际是氧化脱硅过程,即逐级向Fe3O4及Fe2O3转变。 铜渣中铁氧化物还原过程有金属氧化物和复合金属氧化物参与,还原过程既有直接还原反应又有间接还原反应。
2) 粒化后的铜渣颗粒通过氧化煅烧具有一定的吸氧能力。 氧化温度对铜渣内含铁物相的吸氧转变具有重要作用,随着反应温度提高,铜渣中Fe3O4峰逐渐减弱,Fe2O3峰逐渐增强。 此外,铜渣粒径越小,越利于FeO 及Fe3O4吸氧反应的进行。
3) 粒化后的铜渣颗粒具有一定释氧能力。 铜渣中铁的还原反应是分级进行的,还原反应顺序为Fe2O3→Fe3O4→FeO→Fe;随着还原温度提高,铜渣中Fe2O3峰消失,Fe 单质物相的峰逐渐增强;且加入CaO 有利于铜渣释氧反应的进行。

