1-羟基-N-(1H-1,2,4-三唑-5-基)-1H-四唑-5-甲酰胺的合成和性能
刘 静,董亚群,李 渺,刘雨季,黄 伟,汤永兴
(南京理工大学化学与化工学院,江苏 南京 210094)
0 引 言
含能材料作为先进军事武器实现远程打击和高效毁伤的能量来源,是各国长期研究的重要内容[1-5]。随着现代技术的发展,新型含能材料的研究愈发火热,其中富氮杂环因具有高生成焓、高含氮量及分解产物绿色无污染等特点,成为设计与合成新型含能材料的首选含能骨架[6-15]。目前富氮杂环含能化合物的构建方法主要是在杂环骨架(如四唑、三唑、呋咱和四嗪等)上通过官能团转换引入致爆基团(如硝基、硝胺、二硝基甲基和三硝基甲基等)。为了进一步提高化合物的性能,研究人员将2 个甚至多个杂环骨架直接相连[16]或以—NH—[17]、—NH—NH—[18]、—(CH2)n—[19-20]、—N=N—[20]以及杂环[20]等桥联基团相连,以此构建氮杂联环含能化合物。
富氮杂环中三唑与四唑具有高含氮量、较高正生成热和容易进行衍生化的位点,可引入多种取代基团对其性能进行灵活调控,并且同时具有三唑与四唑的富氮含能化合物可兼备三唑的低感度和四唑的优良爆轰性能,因此合成含有三唑与四唑的富氮含能化合物已成为构建氮杂联环含能化合物的热门选择之一[21-27]。含有三唑与四唑的联环化合物在生物与医药方面的研究较多[28-29],而在含能材料领域的研究却较 少,目 前 已 报 道 的 有:Klapötke 课 题 组[30]以5-氨基-3-氰基三唑为原料合成了3 种爆轰性能优异的化合物5-(5-硝氨基-1H-1,2,4-三唑-3-基)-1H-四唑-1-醇(NATTO)、5-(5-硝 基-1H-1,2,4-三 唑-3-基)-1H-四唑-1-醇(NTTO)和 5-(5-叠 氮 基-1H-1,2,4-三唑-3-基)-1H-四唑-1-醇(AzTTO),且NTTO 具有良好感度,撞击和摩擦感度分别为35 J 和360 N,但这3 种化合物的热稳定较差,分解温度最高只达152 ℃,在应用上具有局限性;Shreeve 课题组[31]用4-氨基-5-硝基-1,2,3-2H-三 唑 为 原 料,合 成 了5-氨 基-N-(5-硝基-1H-1,2,3-三唑-4-基)-2H-四唑,该化合物密度为1.86 g·cm-3,热分解温度为308 ℃,并且具有优异爆轰性能,在钝感高性能炸药中有着巨大应用潜力。桥联基团的选择对这类氮杂联环含能化合物的热性能、爆轰性能有着重要影响,因此开拓四唑与三唑间的桥联基团对富氮含能化合物的研究具有重要意义[32-33]。
本 研 究 基 于 5-氨 基-1-(1H-1,2,4-三 唑-5-基)-1H-四唑(1)四唑骨架,经胺肟化、重氮化、取代及亲电加成等设计了一种新型的、以酰胺键桥联三唑与四 唑 的 富 氮 含 能 化 合 物1-羟 基-N-(1H-1,2,4-三唑-5-基)-1H-四唑-5-甲酰胺(3)。对其进行结构表征和晶体分析,同时对其性能进行测试研究,分析其热稳定性及感度性质,并预测其爆轰性能。
1 实验部分
1.1 试剂与仪器
试剂:羟胺水溶液,盐酸,亚硝酸钠,叠氮化钠,N,N-二甲基甲酰胺(DMF),乙酸乙酯均为分析纯,购自上海泰坦科技股份有限公司;5-氰基-1-(1H-1,2,4-三唑-3-基)-1H-四唑(1)根据文献[34]合成;40%的盐酸为自制,制备方法为在水中通入新制的氯化氢气体即可获得40%的盐酸。
仪器:TGA/SDTA851E 热重分析仪,Bruker Avance Ⅲ 500MHz 液体核磁共振波谱仪器,Bruker-SMARTAPEX ⅡX-射线单晶衍射仪,全自动气体置换法真密度仪 ACCUPYC Ⅱ 1345,Vario MICRO cube Elementar Analyser 元素分析仪,BFH 12 BAM 撞击感度仪,FSKM 10 BAM 摩擦感度仪,Thermo Nicolet AVA-TAR 370 红外光谱仪,Xevo G2-XS Qtof 超高效液相高分辨质谱联用仪。
1.2 合成路线
化 合 物3 的 合 成 路 线 见Scheme 1。以5-氰基-1-(1H-1,2,4-三唑-3-基)-1H-四唑(1)为原料,参考 已 报 道 的 路 线[34],合 成(Z)-N′-羟 基-1-(1H-1,2,4-三唑-5-基)-1H-四唑-5-碳酰亚胺叠氮化物(2),随后在水中通入新制的氯化氢气体获得40%的盐酸,在40 ℃下对2 进行酸化得到目标化合物1-羟基-N-(1H-1,2,4-三唑-5-基)-1H-四唑-5-甲酰胺(3)。
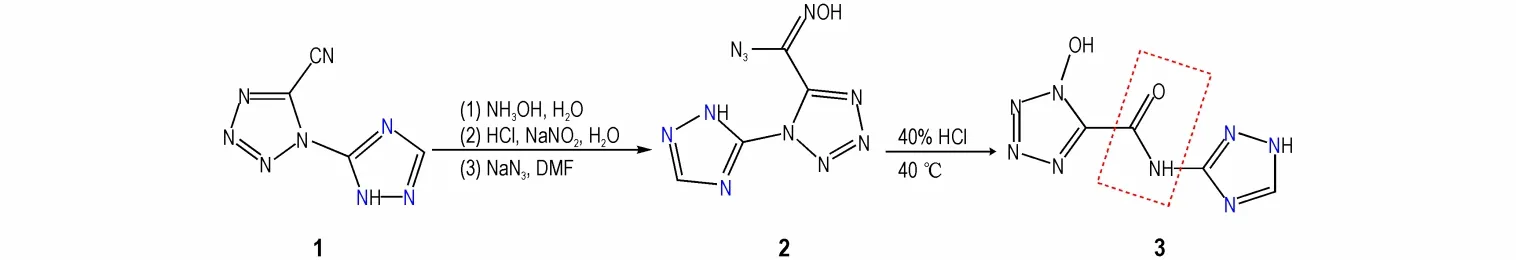
Scheme 1 Synthetic route of compound 3
1.3 合成实验
1.3.1 (Z)-N′-羟基-1-(1H-1,2,4-三唑-5-基)-1H-四唑-5-碳酰亚胺叠氮化物(2)的合成
将化合物1(1.62 g,10.0 mmol)投入水(20.0 mL)中,然后按照摩尔比1∶1.2 加入羟胺(50% 水溶液,1.0 mL),加毕,在室温下连续搅拌6 小时,过滤,干燥得到白色固体;将此白色固体(0.80 g,4.0 mmol)在0 ℃下溶解在盐酸溶液(7 mol·L-1,7.0 mL)中,然后按照摩尔比1∶2.5 缓慢滴加亚硝酸钠(0.69 g,10 mmol)溶液(2.0 mL,26%),加毕,在室温下搅拌8 小时,过滤,用水洗涤,干燥得到白色固体;将此白色固体(0.83 g,4.0 mmol)在0 ℃下 溶 解 在DMF(8.0 mL)中,然后按照摩尔比1∶2.25 缓慢加入叠氮化钠(0.59 g,9.0 mmol),加毕,搅拌4 小时,待溶液清澈,倒入冷水(30.0 mL)中搅拌30 分钟,过滤,用水洗涤,干燥得白色固体2(0.69 g,收率为78%)。1H NMR(500 MHz,DMSO-d6,25 ℃)δ:12.56(s,1H,OH),8.43(s,1H,CH);13C NMR(126 MHz,DMSO-d6,25 ℃)δ:160.4,155.7,148.2,140.4;IR(KBr,ν/cm-1):1635(vs),1565(s),1543(m),1529(s),1496(m),1472(m),1260(m),1054(m),999(m),784(m),687(m);Anal.calcd for C4H3N11O:C 21.73,H 1.37,N 69.67;found C 21.46,H 1.54,N 69.80。
1.3.2 1-羟基-N-(1H-1,2,4-三唑-5-基)-1H-四唑-5-甲酰胺(3)的合成
将化合物2(0.40 g,2.0 mmol)悬浮于水(12.0 mL)中,含瓶称重(20.50 g);将浓硫酸(98%,80.0 mL)滴入氯化钠固体(160.00 g)中,将产生的HCl 气体持续通入上述悬浮液中,一段时间后停止通入气体,此时含瓶称重为29.20 g。将该反应液升温至40 ℃并搅拌16 小时,然后倒入冰水中,乙酸乙酯(3×15 mL)萃取并移除有机相,将水相浓缩并抽滤,滤饼经水洗干燥后得到白色固体3(0.21 g,收率为54%)。1H NMR(500 MHz,DMSO-d6,25 ℃)δ:8.28(s,1H,CH),5.53(s,1H,CONH);13C NMR(126 MHz,DMSO-d6,25 ℃)δ:153.4,149.8,144.7,139.4;IR(KBr,ν/cm-1):1706(vs),1644(m),1280(s),1173(m),1062(m),1022(m),987(m),922(m),790(s),715(s),443(m);Anal.calcd for C4H4N8O2:C 24.50,H 2.06,N 57.13;found C 24.38,H 2.24,N 56.97;MS(ESI),m/z:195.0376[M-H]-。
1.4 结构与性能测试
以去离子水作溶剂配制化合物3 的饱和溶液,在室温下缓慢挥发得到符合测试标准的单晶。选取0.350 mm×0.050 mm×0.030 mm 的单晶,将其放置于Bruker-SMARTAPEX Ⅱ X-射线单晶衍射仪上,采用经石墨单色化的MoKα(λ=0.71073 Å)作为射线源,在170(2) K 温度下收集单晶衍射数据。通过OLEX 2运用SHELXT 以及SHELXL 2017 程序对原子进行精修解析,对晶胞结构进行优化。
在氮气气氛下,利用热重-差示扫描量热(TG-DSC)同步热分析仪测定化合物3 热分解行为,加热速率为5 ℃·min-1,温度范围为50~400 ℃。
在室温氮气氛围下用气体比重计真密度法对化合物3 的密度进行分析测试;运用密度泛函理论中的B3LYP 基组对化合物3 的生成焓进行理论计算;运用Explo5(V6.05.02)软件对化合物3 的爆速和爆压进行理论计算。
按照BAM 测试标准[35],在相应测 试条件:药量(30±1) mg,落锤质量2 kg,环境温度10~35 ℃,相对湿度不大于80%,测试化合物3 的撞击感度和摩擦感度。
2 结果与讨论
2.1 合成条件分析
化合物3 的初始产率只有4%,为进一步提高该化合物的产率,对其反应条件(反应温度、反应时间和盐酸浓度)进行探究,不同反应条件下化合物3 的产率结果如表1 所示。
首先对反应时间进行选择,在反应温度(25 ℃)和盐酸浓度(36%)保持不变时,探究了不同反应时间(8,12,16 h 和20 h)下化合物3 的产率变化(entries 1~4),发现随着反应时间的延长,产率没有明显提升;随后对反应温度进行选择(entries 3 and 5~7),探究了不同反应温度(0,25,40 ℃和50 ℃)对化合物3 的产率的影响,结果表明温度升高至40 ℃时,其产率可达到15%,但温度进一步升高到50 ℃,其产率略有下降;最后探究不同盐酸浓度(30%,36%,40%和44%)下化合物3 的产率变化(entries 6 and 8~10),当盐酸浓度从30%提升至40%时,产率由11%明显提升至54%,将盐酸浓度继续提升至44%,此时盐酸过量,导致反应副产物增加,化合物3 的产率有所降低,因此,化合物3 的最优反应条件为:反应温度40 ℃,反应时间16 h,盐酸浓度40%,此时产率高达54%。

表1 不同反应条件下化合物3 的产率Table 1 The yields of compound 3 under different reaction conditions
2.2 合成机理分析
基于相关文献报道[36-37],化合物3 的可能形成机理如图1 所示。首先化合物2 在盐酸与水的作用下发生亲电环加成反应生成化合物Ⅰ。在高浓度盐酸(40%)与加热作用下,化合物Ⅰ中间的四唑环发生开环异构化反应,形成化合物Ⅱ。随后H+进攻碳氮双键发生亲电加成形成化合物Ⅲ,接下来H2O 中氧的孤对电子与化合物Ⅲ中的碳正离子发生亲核加成形成化合物Ⅳ,Ⅳ脱去一分子HN3后形成化合物Ⅴ,而后失去一个质子得到目标化合物3。
2.3 单晶数据分析
化合物3·H2O 的晶体结构数据见表2,部分键长与键角见表3,部分二面角见表4,分子间氢键数据见表5,晶体结构、三维晶胞结构及分子氢键作用见图2。
由表2 可知,化合物3·H2O 晶体属于正交晶系和Pna21空间群,每个晶胞中含有四个分子(Z=4),在170 K 下的单晶密度为1.711 g·cm-3。从表3 看出,四唑环上N(3)—N(4)、N(2)—N(3)键长分别为1.336 Å 和1.318 Å,均介于N—N 单双键(1.45 Å、1.25 Å)之间,羰基中C(2)—O(2)键长为1.205 Å,介于C—O单双键(1.43 Å、1.20 Å)之间,表明四唑环与环外羰基存在一定程度的共轭。由表4 中可知二面角均接近于0°或者180°,可以看出整个分子处于同一个平面。由图2a 和 表5 所 示,化 合 物3·H2O 分 子 间 存 在3 种 氢键,一是三唑环上的H(7)与水中的O(3)形成的N(7)—H(7)…O(3),其键长为1.758(15) Å;另外两种分别为水中的H(3B)与四唑环上的N(3)、N(4)形成的O(3)—H(3B)…N(4)、O(3)—H(3B)…N(3),键 长 分 别 为1.923(3) Å、3.204(3) Å;同 时 化 合 物3·H2O 存在1 种分子内氢键,是酰胺基团中的H(5)与羟基中的O(1)形成的N(5)—H(5)…O(1),其键长为1.941(18) Å。以上氢键的作用使得化合物3·H2O紧密结合,形成波浪堆积结构,且波浪堆积的层与层间距为2.78 Å,如图2b 所示。
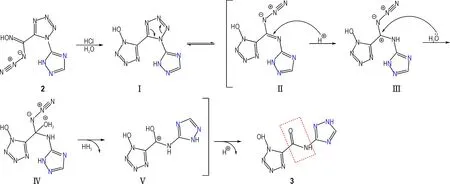
图1 化合物3 的可能形成机理Fig.1 Proposed mechanism for the formation of compound 3

表2 化合物3·H2O 的晶体结构数据和参数Table 2 Crystal data and structure parameters for 3·H2O
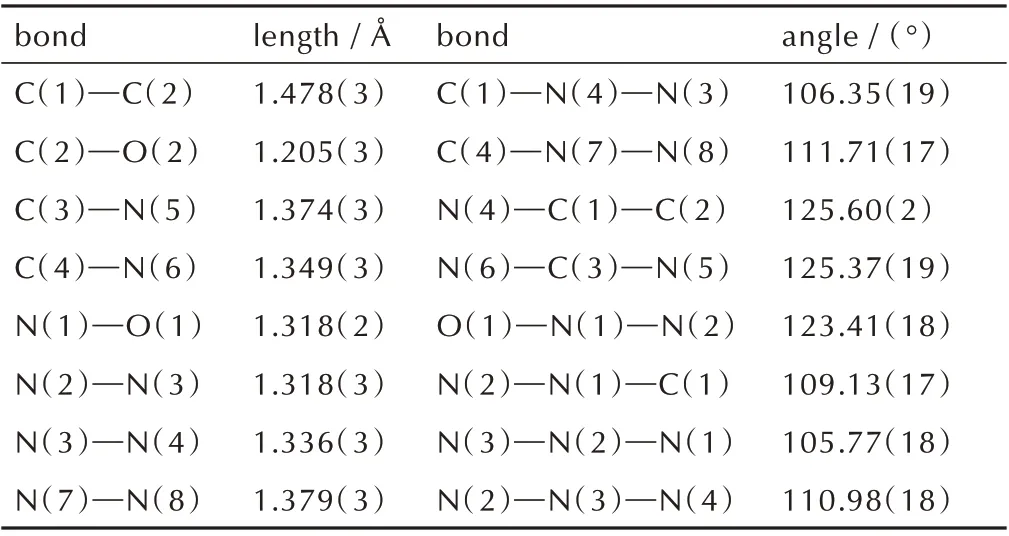
表3 化合物3·H2O 的部分键长和键角Table 3 Selected bond lengths and angles of 3·H2O
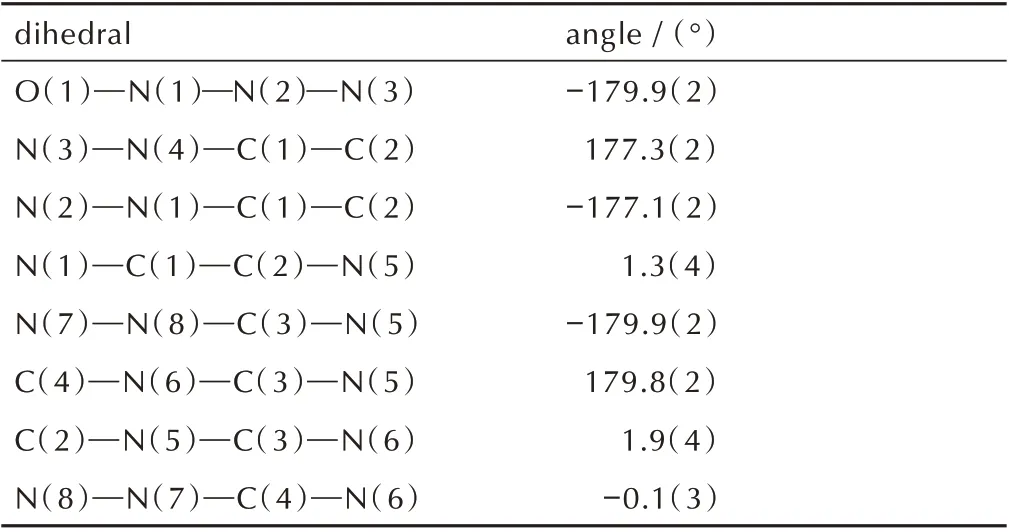
表4 化合物3·H2O 的部分二面角Table 4 Selected dihedral angles of 3·H2O
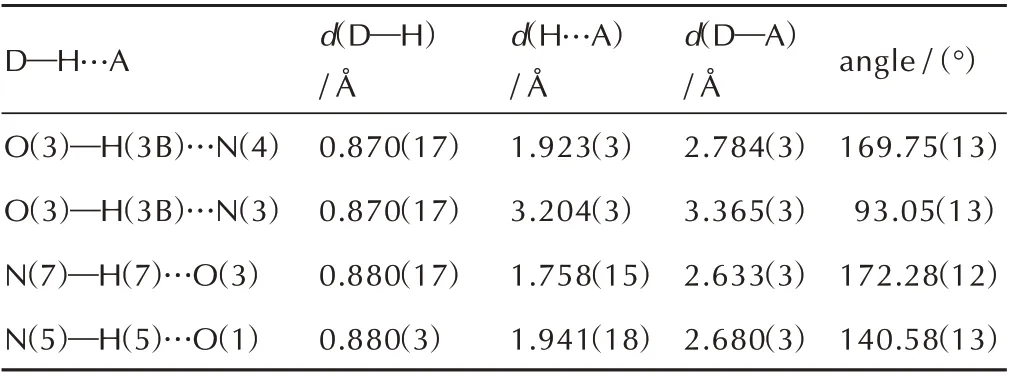
表5 化合物3·H2O 的氢键键长和键角Table 5 Hydrogen bonds (Å) and angles (°) of 3·H2O
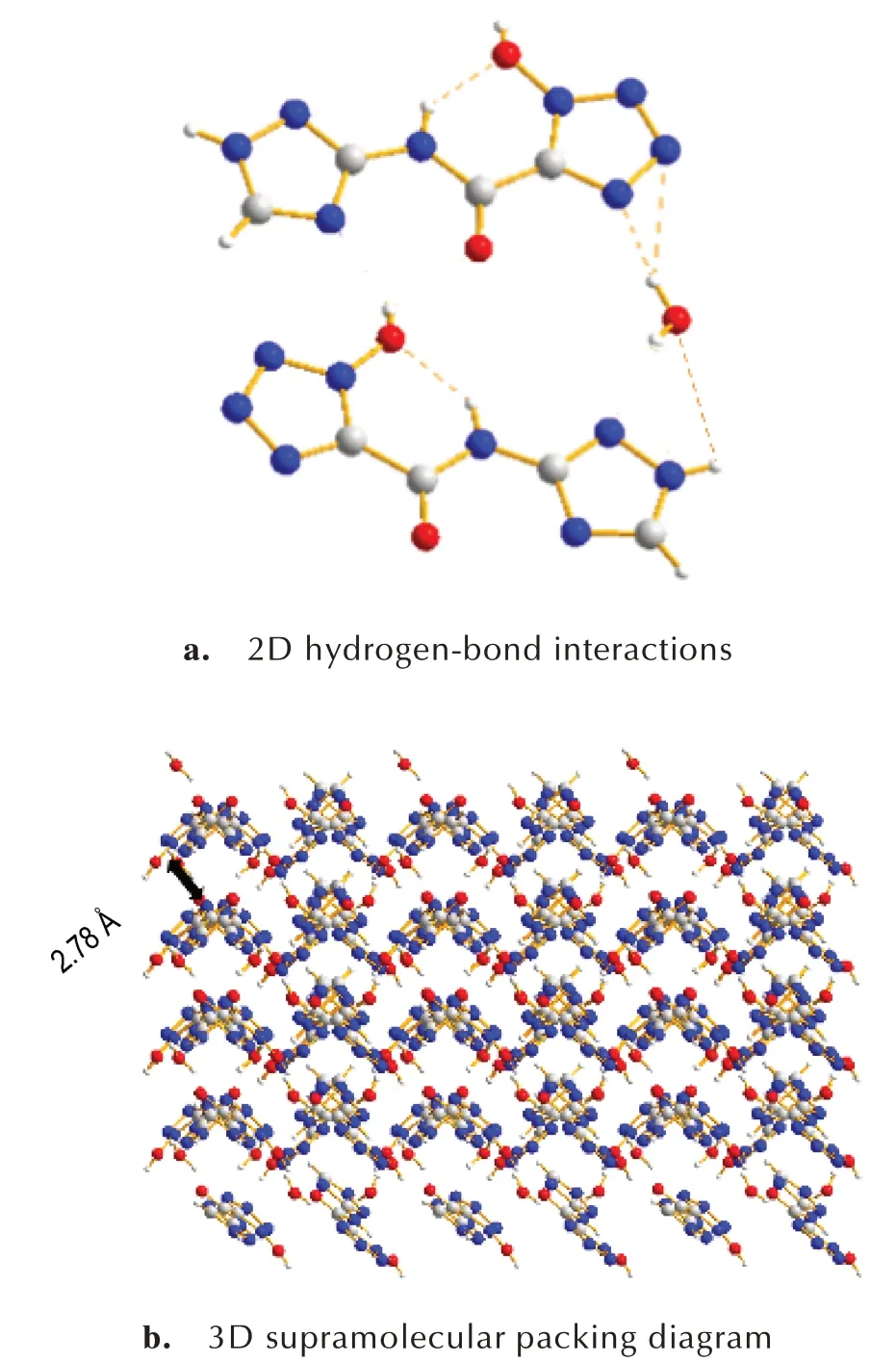
图2 化合物3·H2O 的二维氢键网络图和三维堆积图Fig.2 2D hydrogen-bond interactions in 3·H2O and 3D supramolecular packing diagram of 3·H2O
化合物3 的分子表面静电势(ESP)图如图3 所示,部分表面最大静电势和最小负静电势的位点分别由红色和青色点表示。一般来说,最大ESP值越高,代表正点位的红色区域越大,往往导致感度越高[38-39]。可以看出,化合物3 的正静电势主要集中在羟基周围,此区域有接受电子倾向,其中羟基上方的最大静电势为340.15 kJ·mol-1,负静电势主要集中在羰基下方,此区域的电负性较强,羰基左侧的最小静电势为-235.55 kJ·mol-1,表明羰基能够降低其感度,导致化合物3 具有较低的感度,这与实验结果相符(IS: 20 J,FS:288 N)。
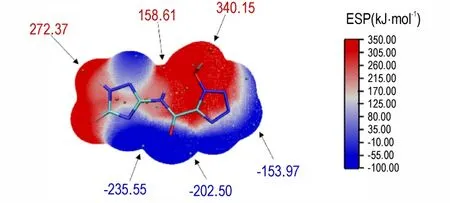
图3 化合物3 的分子表面静电势图Fig.3 Molecular surface electrostatic potential of compound 3
2.4 稳定性及爆轰性能
在氮气气氛下,加热速率为5 ℃·min-1,温度范围为50~400 ℃的条件下测试化合物3 的TG-DSC 曲线,结果如图4 所示。TG 曲线表明,在258~281 ℃之间,质量损失为56.2%,该过程中化合物3 发生剧烈分解。从DSC 图上可以看出化合物3 存在一个尖锐的放热峰,表现出一个快速的分解放热过程,通过基线与放热峰拐点处作切线得到的相交点判定其热分解起始温度为265 ℃,峰值温度为275 ℃。由此可知伴随着迅速放热,化合物3 表现出良好的热稳定性。
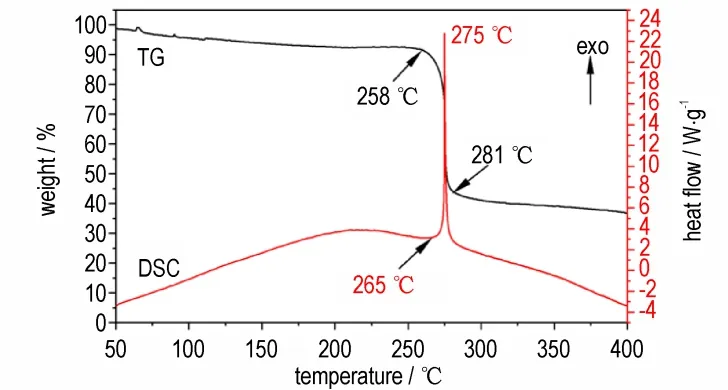
图4 化合物3 的TG-DSC 曲线Fig.4 TG-DSC curves of 3
化合物3、NATTO、NTTO、AzTTO 和TNT 的性能数据见表6。由表6 可以看出,化合物3 的热分解温度(Td=265 ℃)明显高于NATTO、NTTO 和AzTTO,说明酰胺键这种桥联基团的引入可有效改善桥联类四唑含能化合物的热稳定性。在室温氮气氛围下用气体比重计真密度法测量了化合物3 的密度(ρ=1.75 g·cm-3),其明显高于TNT 的密度(ρ=1.65 g·cm-3)。运用密度泛函理论中的B3LYP 基组计算得到化合物3 的生成焓为331.3 kJ·mol-1。根据BAM 标准测试法测定化合物3的撞击感度和摩擦感度(IS: 20 J,FS: 288 N),其与TNT的感度相当(IS: 15 J,FS: 358 N)[20]。根据生成焓和实测密度,运用Explo5(V6.05.02)软件计算得到化合物3的爆速和爆压(Dv=8017 m·s-1,P=23.1 GPa),其爆速爆压均高于TNT(Dv=6821 m·s-1,P=19.4 GPa)[20]。
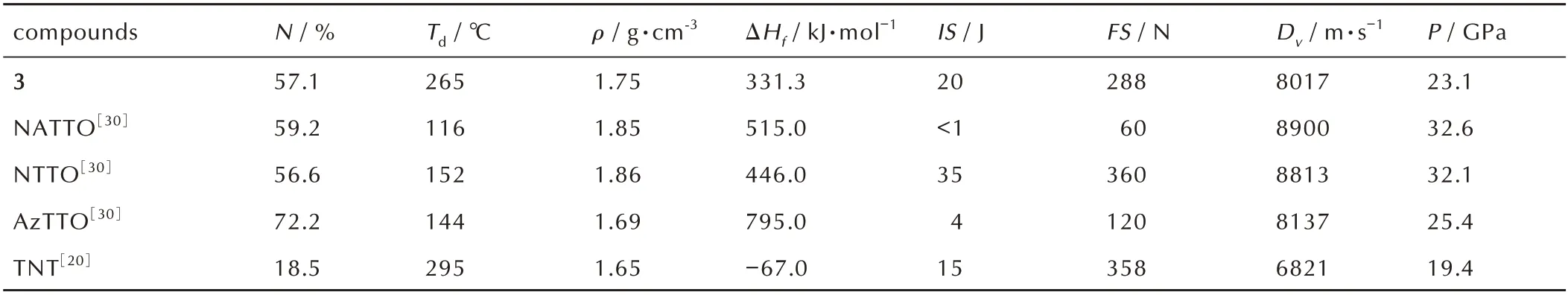
表6 化合物3、NATTO、NTTO、AzTTO 和TNT 的理化性质及爆轰性能Table 6 Physiochemical properties and detonation performances of compound 3,NATTO,NTTO,AzTTO and TNT
3 结 论
(1) 以5-氰基-1-(1H-1,2,4-三唑-3-基)-1H-四唑为原料,合成了以酰胺键桥联的富氮含能化合物,并通过核磁氢谱、碳谱、红外光谱、元素分析、单晶衍射等确定其分子结构。
(2) 通过溶剂挥发法培养了化合物3·H2O 的单晶,通过单晶衍射,确定其晶体结构,由单晶衍射数据表明该晶体属于正交晶系和Pna21空间群,晶体密度为1.711 g·cm-3,分子间呈现波浪堆积,并且分子内与分子之间存在较多氢键连接,构成一种相对稳定的结构。
(3) 化合物3 的热分解温度为265 ℃,实测密度为1.75 g·cm-3,计算生成焓为331.3 kJ·mol-1,计算爆速为8017 m·s-1,计算爆压为23.1 GPa,撞击感度及摩擦感度分别为20 J 和288 N,是一种潜在的新型含能化合物。

