靶向胆固醇稳态小分子药物治疗胶质瘤的研究进展
姜伟,王君萍,周鹏,黄玲玲,张梅,陈学冉,2,王宏志,2,方志友,2
作者单位:1中国科学院合肥肿瘤医院药学中心,安徽 合肥230031;2中国科学院合肥物质科学研究院健康与医学技术研究所,安徽 合肥230031
胶质瘤是成人最常见的原发性恶性中枢神经系统肿瘤之一,起源于神经上皮细胞。Ⅳ级胶质瘤也称为胶质母细胞瘤(GBM),恶性程度最高并且最难治愈,病人总生存期更短,具有极高病死率[1]。GBM 细胞生长十分迅速,且可快速侵袭进入周围的组织间隙,导致相邻的正常组织被血管和淋巴管破坏[2]。替莫唑胺(TMZ)是治疗GBM最为代表性的口服烷化剂,但GBM 对TMZ 易产生耐药性,仅能提高病人两个月的中位生存期。因此探索GBM 发病机制以及研究新的潜在治疗策略具有非常重要意义。
1 细胞代谢与肿瘤发生发展
肿瘤细胞的主要特征是会以最大限度地合成膜、核酸和蛋白质的底物进行自我调整,从而提高增殖率。能量代谢重编程被认为是肿瘤的新标志,肿瘤细胞通过调节能量代谢促进其快速增殖。
葡萄糖代谢主要包括细胞质中的糖酵解途径、磷酸戊糖途径、丝氨酸合成途径和线粒体中的三羧酸循环。肿瘤细胞在有氧条件下选择糖酵解途径来为大分子合成提供中间底物,合成核苷酸、脂肪酸和氨基酸进而加速细胞分裂。每分子葡萄糖通过糖酵解产生三磷酸腺苷(ATP)的效率较低,但产率比氧化磷酸化要快得多,可以满足肿瘤细胞快速生长和增殖的需求,是肿瘤细胞的主要能量来源[3]。
脂肪酸和氨基酸,尤其是谷氨酰胺、丝氨酸和甘氨酸的合成分解失调也是支持肿瘤细胞生长的代谢调节剂。谷氨酰胺通过提供其氮和碳参与癌细胞中能量产生、大分子合成和信号传递的一系列途径。增加谷氨酰胺在线粒体依赖性生物能量产生和细胞生物合成中的使用是许多肿瘤细胞的一个关键特征[4]。
近年大量研究报道了胆固醇代谢在调节肿瘤生物学过程中的作用,特别是致癌信号通路、铁死亡和肿瘤微环境[5]。致癌基因的增加和抑癌基因的丧失是癌细胞的重要特征,并重编程胆固醇代谢途径。越来越多的证据表明,胆固醇及其代谢物是促进肿瘤发展的信号分子[6]。鉴于胆固醇代谢在癌症中的这些重要功能,针对胆固醇代谢的新关键分子和策略的筛选已成为癌症研究领域的热点,且近年来取得了重大进展。
2 胆固醇稳态
2.1 胆固醇合成途径胆固醇是哺乳动物细胞膜的必需脂质成分,是维持机体正常生理功能的必要物质。胆固醇的生物合成在内质网上进行,包括甲羟戊酸(MVA)途径、角鲨烯生物合成等近30 种酶促反应[7]。前两个反应是由硫解酶和3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)催化的可逆反应,随后发生的反应是调节胆固醇合成的关键点,由3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶(HMGCR)催化[8]。固醇调节元件结合蛋白2(SREBP2)和肝脏X受体(LXRs)两组转录因子是参与胆固醇合成基因的关键固醇元件调节蛋白,它能够调节HMGCR、HMG-CoA 合成酶(HMGCA)、甲羟戊酸激酶(MVK)和摄取胆固醇的低密度脂蛋白LDL(LDL)受体(LDLR)等蛋白的表达[9]。
2.2 胆固醇运输途径
2.2.1 胆固醇外排 大多数外周细胞和组织缺乏代谢胆固醇的能力,主要依靠外排途径来维持细胞稳态。有多种机制导致细胞胆固醇流出,其中主动外排途径主要由ATP 结合盒(ABC)转运蛋白ABCA1 和ABCG1 介导。ABCA1 对胆固醇和磷脂流出至载脂蛋白和高密度脂蛋白(HDL)生物发生至关重要。ABCG主要促进胆固醇流出至HDL颗粒。胆固醇流出率取决于细胞中的胆固醇负荷、HDL 的组成、大小和浓度以及流出转运蛋白的表达。
2.2.2 胆固醇内吞 细胞胆固醇来源于内质网(ER)中的从头合成或来源于细胞外环境的摄取。这种摄取可以通过天然或修饰的LDL 的内吞作用,或从脂蛋白中选择性摄取游离或酯化胆固醇而发生。LDLR 是SREBP2 的转录靶点,是外周细胞获取胆固醇的主要参与者。LDL与LDLR结合后,通过内吞作用被转移到细胞内体后再解离出来,并进一步转移到溶酶体,在溶酶体中胆固醇酯被酸性脂肪酶水解以释放游离胆固醇。NPC蛋白是游离胆固醇从溶酶体中转运出来所必需的。在甾醇转运蛋白的帮助下,胆固醇最终被转移到细胞膜或内质网(ER)膜上[10]。LXR 激动剂GW3965能够激动下游的信号通路进一步降低细胞内胆固醇含量杀死GBM 细胞,延长荷瘤小鼠的生存期。而NPC缺失在引起胆固醇积累的同时会导致自噬囊泡向溶酶体的运输缺陷。
2.3 胆固醇代谢途径胆固醇的稳态对维持细胞的功能非常重要,胆固醇合成代谢途径的异常活化是很多肿瘤发生的标志之一,大量的胆固醇能够提供肿瘤细胞在侵袭和迁移过程中所需要的各种物质[11]。肿瘤细胞表现出代谢异常,以满足与肿瘤快速生长相关的高能量和生物合成需求。SREBPs 在调节胆固醇稳态中起关键作用,在GBM 中,抑制SREBP 的水平可以抑制低氧状态下肿瘤细胞的脂质合成和细胞增殖。越来越多的研究表明肿瘤细胞需要吸收足够的胆固醇来维持自身的生长和增殖[12],针对胆固醇稳态的干预在肿瘤治疗过程中的作用也被越来越多的研究者认同。我们调研总结了针对不同靶标的胆固醇稳态调控相关小分子药物及肿瘤治疗的临床应用,如表1所示。
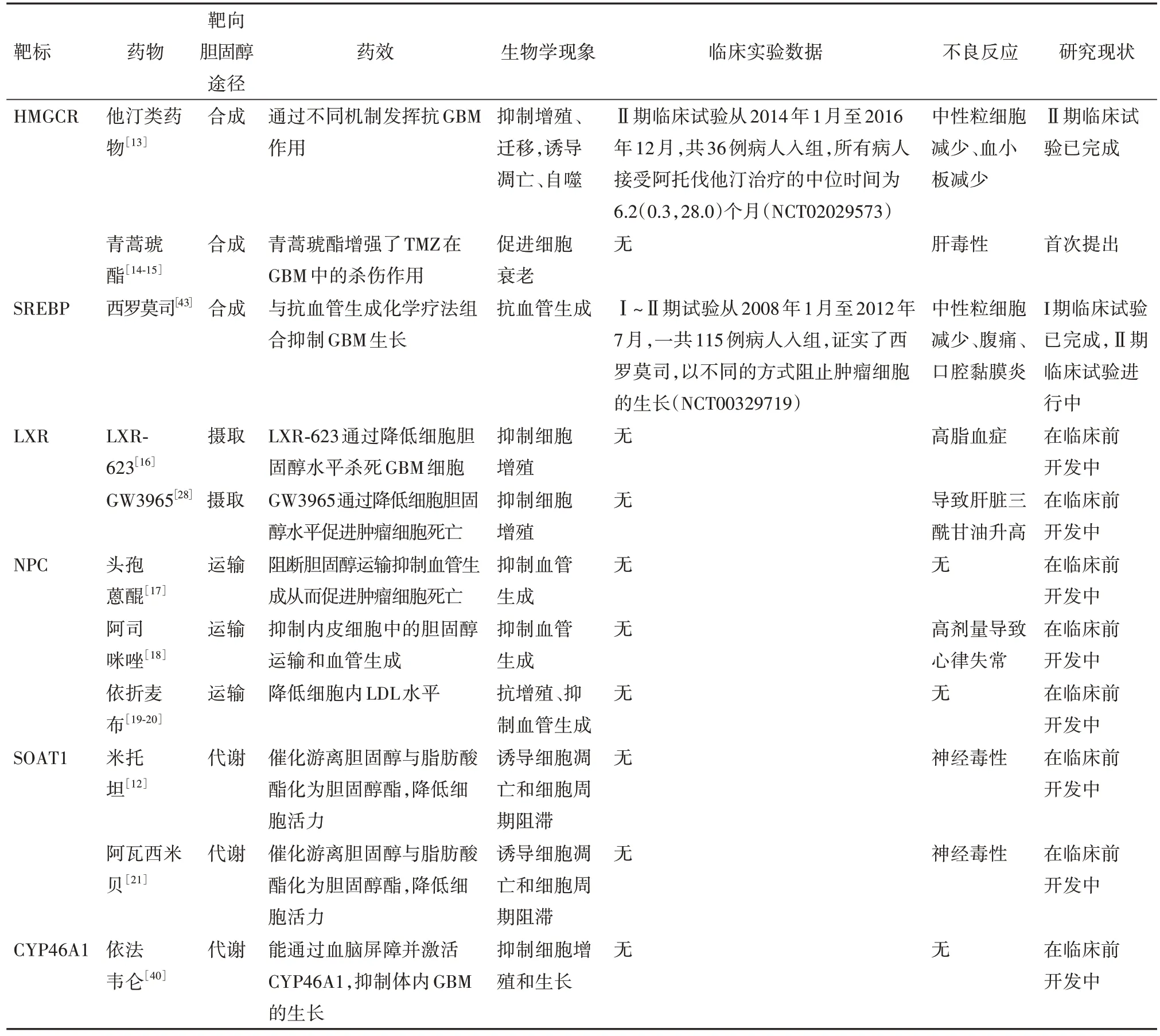
表1 靶向肿瘤细胞中胆固醇代谢的小分子药物
3 针对GBM中胆固醇代谢新方法
3.1 靶向胆固醇合成HMGCR 在GBM 的发展中起着至关重要的作用,在临床的GBM 样本中可以观察到HMGCR 的上调,甲羟戊酸途径是合成胆固醇的重要途径之一,阻断该途径会显著影响细胞活动。临床前研究表明,HMGCR 抑制剂,通常被称为“他汀类药物”,除具有降低胆固醇和改善心血管风险的作用外,还具有良好的抗肿瘤特性[22]。他汀类药物通过抑制甲羟戊酸途径发挥抗癌活性,无论是在体内还是体外,他汀类药物作为单药治疗或联合治疗,对肿瘤都有一定疗效[23]。
辛伐他汀可以通过多种人类肿瘤细胞系的内在凋亡途径诱导细胞死亡,包括星形细胞瘤、神经母细胞瘤和GBM[24]。临床GBM 治疗中连续使用TMZ 会导致耐药性。最近发现他汀类药物治疗被证明在体外可以改善TMZ的抗GBM作用[25]。例如,阿托伐他汀通过异戊二烯化依赖性方式抑制Ras信号传导来提高TMZ 在GBM 中的疗效[26]。有研究表明,洛伐他汀可能通过丝氨酸-苏氨酸蛋白激酶(Akt)∕雷帕霉素靶蛋白(mTOR)信号级联抑制触发自噬诱导,通过抑制溶酶体相关膜蛋白和动力蛋白,可能影响自噬体-溶酶体融合机制[24]。最新的临床研究发现,在18 例恶性GBM 病人的Ⅰ~Ⅱ期试验中,洛伐他汀联合TMZ治疗具有良好的耐受性[27]。
3.2 靶向胆固醇摄取关键调控因子与非肿瘤细胞相比,肿瘤细胞表现出重新编程的代谢能力,因此肿瘤代谢关键因子成为治疗靶标。LXRs属于核受体超家族,被激活后会导致细胞内胆固醇的降低,胆固醇的这种急性流出通过增加其合成得到补偿[28]。通过药理学驱动LXR途径来限制细胞内甾醇的可用性会抑制快速分裂细胞类型(如淋巴细胞)的增殖。LXR激动剂,例如LXR623和GW3965,已经进入临床试验[29]。在黑色素瘤和胶质母细胞瘤的模型系统中,LXR的激活使几种临床前模型系统的病人生存期延长。
LXR 激动剂GW3965 可以调节LXR 的活性,在体外通过ABAC1 的生物学功能从而促进胆固醇的转运,进而影响胆固醇和磷脂在质膜外的分布,使细胞质膜发生重造。研究表明用GW3965处理胶质瘤细胞后,出现剂量依赖性抑制生长并促进肿瘤细胞的死亡,而添加LDL 后这种死亡得以挽救,表明GW3965 对肿瘤的杀死作用是通过改变细胞胆固醇的水平来驱动。ABAC1 是LXR 的直接转录靶标,GW3965 处理后强烈诱导了ABAC1 的表达并且降低了LDLR 的含量,并伴随着59%的肿瘤生长抑制和GBM 中细胞凋亡的增加。这些数据表明LXR 激动剂通过上调转运蛋白基因ABAC1 的外排和降解LDLR来降低LDL摄取,扰乱GBM的胆固醇稳态,从而有效抑制GBM细胞增殖与体内肿瘤生长[30]。
3.3 靶向胆固醇运输蛋白LDL 在内吞作用发生后被细胞吸收并运送到溶酶体,在溶酶体内胆固醇酯被酸性细胞酶裂解以释放游离胆固醇供细胞使用[5]。NPC1 是分布在溶酶体上,具有13 个跨膜结构域的跨膜转运蛋白,其介导的囊泡内吞途径是吸收胞外胆固醇所必需的。NPC2 蛋白是一种小分子量的球状的抗原呈递蛋白,位于溶酶体腔内,它与NPC1 结合后将LDL 释放的胆固醇运输到受体区室,例如内质网、高尔基体和质膜[31]。
在GBM 中,重新编程胆固醇代谢谱是癌症的一个新标志[32]。当细胞缺乏NPC1 时,胆固醇大量积聚在溶酶体腔内,导致溶酶体扩大,并表现出形态、运输和功能缺陷,且伴随着其他细胞区室的功能障碍,包括自噬体、线粒体和过氧化物酶体。有证据表明,NPC 缺失在引起的胆固醇积累的同时会导致自噬囊泡向溶酶体的运输缺陷[33]。综上所述,靶向NPC 调节胆固醇和自噬可能是治疗GBM的新方法。
3.4 靶向胆固醇代谢调控因子
3.4.1 靶向SOAT1 SREBP-1调节的脂肪合成升高是GBM 的一个新特征,它是一种在脂质代谢中起核心作用的转录因子,SREBP激活受到内质网(ER)中胆固醇的负调控。SOAT1 是SREBP-1 活化的关键调控因子之一,可催化游离胆固醇与脂肪酸酯化为胆固醇酯,然后转移到脂滴(LD)中作为储存池用于胆固醇和脂肪酸。SOAT1 已被证明与多种肿瘤的预后相关,是潜在治疗靶点,抑制SOAT1 可有效地阻断SREBP-1,从而抑制GBM的生长[34-35]。
正常细胞中胆固醇维持在相对稳定的水平,内质网中胆固醇水平升高时,会触发负反馈回路抑制其从头合成。在GBM 细胞中会将多余的胆固醇转化为胆固醇酯储存在脂滴中,以防止胆固醇在内质网膜上的积累,避免对SREBP 和肿瘤生长的反馈抑制[36]。通过抑制SOAT1 酶活性使胆固醇在ER 中积累,可抑制SREBP-1 的转录活性。SOAT1 抑制剂已经在心血管病人的临床试验中进行了测试,因此可以迅速将其应用于癌症病人的临床试验。抑制SOAT1 可能对含有大量脂滴的肿瘤特别有效,例如GBM。通过抑制SOAT1 来阻断胆固醇酯化是一种通过抑制SREBP-1 靶向GBM 的有前景的治疗策略[37]。
3.4.2 靶 向 胆 固 醇24- 羟 化 酶(CYP46A1)CYP46A1 是一种可以将胆固醇转化为24-羟化胆固醇(24-OHC)进而将其排出中枢神经系统的脑组织特异性酶,对调节胆固醇的代谢非常关键。24-OHC不仅能够促进胆固醇的外排,还能作为激活LXR 的核转录因子,从而促进其下游胆固醇基因如ApoE和ABAC1 的表达来进一步增加胆固醇的分泌。大数据的生信分析确定了CYP46A1 是参与GBM 中胆固醇稳态的调节基因,其下调最为明显[38]。通过药物激活或者过表达CYP46A1∕24-OHC能够在体内外抑制GBM 细胞的生长,提示CYP46A1∕24-OHC 是导致胆固醇稳态失调的一个重要因素,靶向CYP46A1∕24-OHC可能是治疗GBM治疗的新靶点。
CYP46A1 的缺失部分导致胶质母细胞瘤细胞中过多的胆固醇积累,这有助于维持肿瘤细胞的活力和恶性状态。依法韦仑(EFV)是一种可通过血脑屏障与酶的变构位点结合来激活CYP46A1 的抗HIV 药物。有研究显示,EFV 显著抑制GBM 细胞生长并且诱导肿瘤细胞死亡。在分子水平上,EFV 刺激CYP46A1的活性,导致24-OHC水平升高,进一步减少胆固醇的积累[39]。外源性胆固醇处理或CYP46A1 敲低部分恢复了EFV 诱导的GBM 细胞生长抑制,表明EFV 抗癌作用至少部分是通过调节胆固醇水平介导的[38]。综上所述,CYP46A1 的缺失会导致GBM 中胆固醇的积累和胆固醇稳态失调,这可能是一个GBM 中可行的治疗靶点。CYP46A1 的激活剂通过增加胆固醇代谢物24-OHC 的产生,在体外和体内抑制肿瘤生长,从而扰乱GBM 中的胆固醇稳态。此外,EFV 恢复CYP46A1∕24-OHC 信号轴的活性可能是一种有前途的GBM治疗策略。
4 靶向胆固醇稳态治疗胶质瘤的研究进展
与未接触过他汀类药物的GBM 病人相比,他汀类药物使用时间或强度的增加与GBM 病人预后之间存在着剂量关系,使用他汀类药物相关的GBM 风险降低,表明他汀类药物暴露可能会影响胶质瘤的发展。虽然研究证明了长期使用他汀类药物对GBM 病人的生存率具有潜在的积极影响,但是为了更好地排除外在其他条件的影响,需要更详细的临床和分子数据进行更大规模的研究[40]。西罗莫司是一种有效的免疫抑制药物,被批准用于预防实体器官同种异体移植排斥。有临床研究在病人已有的化疗方案中加入西罗莫司的Ⅰ期剂量递增实验,按照规定的周期进行一些指标的检测,发现随着西罗莫司用药剂量的增加,可能会出现中性粒细胞减少、腹痛、口腔黏膜炎等一些不良反应,但总体来说该方案的耐受性较好。参与评估的15例病人中,有8 例病人评价为SD,但其中1 例GBM 病人由于反复腹痛在没有得到额外治疗后被评价为PD。西罗莫司对免疫途径的抑制以及潜在的反应生物标志物,将在正在进行的Ⅱ期试验中进一步评估[41]。
5 总结与展望
胆固醇代谢对肿瘤生物学过程,特别是对致癌信号通路、铁死亡和肿瘤微环境的新兴作用,还需要在各种肿瘤类型中进一步阐明。肿瘤中胆固醇代谢依赖性和选择性的机制对于靶向代谢治疗是必不可少的,它仍然是癌症研究领域的主要挑战之一。
胆固醇稳态由复杂的反馈回路调节,单一抑制一种胆固醇代谢途径可能对肿瘤生长几乎没有影响。随着胆固醇代谢抑制剂的发展,应进一步探索同时阻断胆固醇合成、摄取、酯化和运输癌症的不同抑制剂的组合,并为下一代代谢疗法提供理论基础。

