HMGB1及CD4+/CD8+比值对脓毒症急性肾损伤患者预后的诊断及与肾脏血流阻力指数的相关性分析
孟宽,张文芝(广东省深圳市龙华区人民医院,广东 深圳 518110)
脓毒症是患者由于感染而引起的一种全身炎症反应综合征,如果机体中的炎症反应出现失控,则会发展为脓毒性休克,严重者可导致多器官出现功能障碍[1]。而脓毒症是患者出现急性肾损伤比较常见的一种病因。脓毒症患者出现肾损伤的概率在40%-50%之间[2]。脓毒症患者一旦产生肾损伤,其死亡率就会升高6-8倍,而且远期内的不良预后风险也会出现升高[3]。如果老年患者发生脓毒症,患者出现肾损伤的概率也会明显地升高。如果能够使用临床中比较容易获得的指标对脓毒症急性肾损伤(AKI)患者的预后进行预测,并且对患者进行针对性干预,就能够明显地降低患者死亡的风险[4]。临床中已经广泛使用彩色多普勒超声血流显像技术对患者的肾血流量进行评估,肾脏血流阻力指数(renal resistive index,RRI)是临床中对于肾功能损伤进行评价的有效指标,该指标对于肾脏血流灌注的能力以及急性肾损伤患者的预后具有较好的诊断效果[5-6]。高迁移率族蛋白B1(highmobility group box-1,HMGB1)是真核细胞中的核内蛋白,该指标可以作为机体中的晚期炎症介质,参与多种疾病的发生以及进展[7]。本文探讨了HMGB1及CD4+/CD8+比值对脓毒症AK1患者预后的诊断及其与肾脏血流阻力指数之间的相关性,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2021年1月-2023年1月在我院进行治疗的脓毒症患者60例,将患者分为非AK1组以及AK1组,每组30例。纳入标准:①患者的年龄在60岁以上;②患者在临床中被诊断为脓毒症,并且合并有急性肾损伤;③患者的临床资料比较完整。排除标准:①患者被诊断患有其他类型的恶性肿瘤;②患者是由于非脓毒症所导致的急性肾损伤;③患者的泌尿系统出现畸形或者进行单侧肾脏切除手术;④患者进行过肾移植手术;⑤患者在近1周内使用过肾毒性的药物进行治疗。本研究经医院伦理委员会审批通过。
1.2 观察指标
1.2.1 一般资料 收集患者的临床资料,主要包括年龄、性别、体质量指数,肾脏血流阻力指数检测:使用GEvividi超声诊断仪的凸阵探头从患者的季肋部后进行外侧扫描,直到患者的肾脏冠状切面,需要定位血管对机体中的叶间动脉或肾弓形动脉的频谱进行相应的测定,需要在每条动脉中测定3-5个连续的血流频谱波形,使用离线测量患者收缩期的峰值血流速度以及舒张末期内的血流速度,计算肾脏血流阻力指数,需要测量3次之后取平均值进行计算。RRI=(收缩末期内的血流速-舒张末期内的血流速)/收缩末期内的血流速。
1.2.2 血清水平测定 在患者入院之后的24h内抽取空腹静脉血5mL,使用高速离心机在3000r/min状态下离心10min,获得上层血清,使用酶联免疫吸附法测定HMGB1,使用流式细胞仪测定CD4+/CD8+水平,使用全自动生化分析仪测定白蛋白、C反应蛋白水平。
1.3 统计学方法 研究所得数据使用SPSS22.0进行分析。计量资料使用()表示,行t检验;计数资料使用率表示,行χ2检验,脓毒症AK1患者的危险因素使用Logistic回归分析,采用ROC曲线评价诊断效果,P<0.05表示有统计学差异。
2 结果
2.1 患者的一般资料对比 经过对比,两组患者的年龄、性别无统计学差异(P>0.05),非AK1组的体质量指数、肾脏血流阻力指数明显低于AK1组,有统计学差异(P<0.05),见表1。

表1 两组患者一般资料对比
2.2 血清指标对比 经过对比,非AK1组患者的HMGB1、CD4+/CD8+、C反应蛋白明显比AK1组要低,白蛋白明显比AK1组要高,有统计学差异(P<0.05),见表2。
表2 两组患者血清指标对比()

表2 两组患者血清指标对比()
?
2.3 多因素Logistic分析 结果表明,肾脏血流阻力指数、HMGB1、CD4+/CD8+以及C反应蛋白均是脓毒症AK1患者预后影响的因素,有统计学差异(P<0.05),以上水平升高,患者的预后越差,见表3。

表3 多因素Logistic分析
2.4 ROC曲线 诊断结果表明,HMGB1、CD4+/CD8+均对脓毒症AK1患者预后有一定的诊断价值,AUC分别为0.750、0.885,联合诊断的价值较高,AUC为0.985,结果见图1、表4。

图1 ROC诊断结果
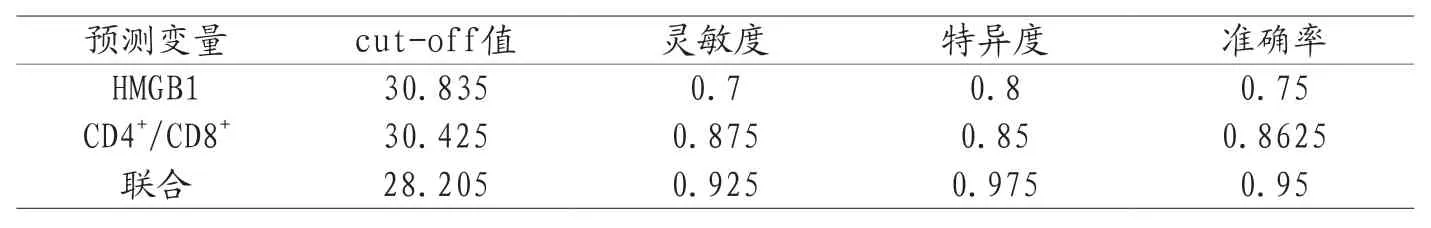
表4 ROC信息表
2.5 相关性分析 相关性分析结果表明,HMGB1、CD4+/CD8+与肾脏血流阻力指数的相关性较高,有统计学差异(P<0.05),见表5。

表5 相关性分析
3 讨论
脓毒症会导致患者的全身产生严重的炎症反应,随着患者病情的加重会发展为脓毒症休克或者是严重脓毒症,是患者产生肾损伤的主要病因[8]。脓毒症产生的并发症中,急性肾功能损伤明显比其他器官出现功能损害的发生率要高,所以肾损伤可能是疾病恶化的一个重要转折点[9]。有研究[10]表明,脓毒症的发病率正在以每年增加1.5%的速度不断地增长,预测至2025年,全球范围内严重脓毒症患者的人数会增加到150万例,而且脓毒症AK1患者的人数会增加到55万例[11-12]。脓毒症AK1会导致患者的其他器官产生损伤,并且会导致患者产生多器官的功能障碍综合征,临床中对于脓毒症AK1缺乏有效的血清学标志物诊断,从而无法很好地对脓毒症AK1患者的病情以及预后进行预测[13]。所以,寻找脓毒症AK1的治疗靶点以及潜在的生物标记物具有比较重要的临床意义。
本文研究结果表明,肾脏血流阻力指数、HMGB1、CD4+/CD8+以及C反应蛋白均是脓毒症AK1患者的预后影响因素(P<0.05)。在临床中一般使用患者的尿量以及Cr指标对患者的肾功能变化进行评估,但是在患者的肾功能出现损伤之后,该指标则无法对肾功能情况进行早期诊断预测,同时也无法对肾功能的血流情况进行评估[14]。而使用超声检测的RRI值能够对脓毒症AK1患者的肾功能情况进行评估,同时还能对隐匿性或出血性休克患者具有较好的预测价值。
HMGB1指标是多种疾病晚期会出现的炎性递质,该指标能够使免疫活性细胞进行过表达,从而可以促进机体中多种致炎因子的释放,还能够加重机体中的炎症反应,HMGB1和脓毒症、免疫性疾病、急性肺损伤以及心肌缺血等疾病的发生以及发展有密切的关系。有研究[15]表明,脓毒症AK1患者在发病之后的24h内,血清中的HMGB1指标会出现明显的升高,而且和脓毒症AK1患者的预后具有密切的关系。本文研究结果表明,AK1组患者的HMGB1表达水平明显高于非AK1组,与上述研究结果相似,这表明脓毒症AK1预后不良患者外周血的HMGB1出现高表达现象。本文研究结果表明,CD4+/CD8+水平是导致脓毒症患者出现肾损伤之后死亡的独立危险因素。目前有相关研究与本研究的结果相似,机体中免疫细胞亚群的变化和肾损伤有一定的相关性。有研究[16]表明,外周血Th1/Th2 比值和肾小球滤过率之间出现负相关关系,外周血Tregs的比例和肾小球滤过率之间呈现出正相关关系。经过分析认为免疫和炎症是导致肾功能出现损伤的一个重要机制,免疫功能紊乱和疾病的发生以及进展相关。有研究表明,对急性肾损伤患者使用血必净联合连续性肾脏替代治疗之后能够明显提高患者的CD4+水平,同时还可以降低APACHEⅡ评分。CD4+/CD8+水平的降低或者升高是免疫功能产生紊乱的重要表现,可能会对患者的预后造成不良影响。作用机制可能和炎症反应导致机体中的免疫细胞亚群出现失调有一定的关系。诊断结果表明,HMGB1、CD4+/CD8+均对脓毒症AK1患者预后有一定的诊断价值,AUC分别为0.750、0.885,联合诊断的价值较高,AUC为0.985。这表明将HMGB1、CD4+/CD8+指标联合应用,能够对脓毒症AKI患者的预后进行诊断,且诊断价值较高。
综上所述,将HMGB1指标以及CD4+/CD8+指标联合应用可以对脓毒症AKI患者的预后进行预测诊断,且诊断价值较高,值得在临床中推广应用。

