乳铁蛋白改善高脂饮食大鼠肝脏胆固醇积累的作用研究
吴昀宣,李德明,何宇然,徐加英,童星,秦立强
(1. 苏州大学公共卫生学院,江苏 苏州 215123;2.苏州大学放射医学与防护学院,江苏 苏州 215123;3.苏州大学苏州医学院实验中心,江苏 苏州 215123)
0 引 言
当前,全球肥胖患病率大幅上升。肥胖不仅与胰岛素抵抗、高血压和心血管疾病等代谢性疾病发病率升高密切相关,也是非酒精性脂肪性肝病(NAFLD)的重要诱因。目前药物治疗代谢性疾病的手段较少,且存在不良反应。因此,针对肥胖的发病机制进行营养干预,对延缓肥胖的发生发展和降低肝脏胆固醇积累风险具有重要意义。
乳铁蛋白(Lactoferrin,Lf)是一种主要存在于乳汁、唾液和胆汁中的糖蛋白,属于转铁蛋白家族。Lf最丰富的来源是乳汁,特别是初乳[1]。Lf 具有许多生理功能,如抗氧化、抗炎、抗病毒和抗菌作用等[2]。Lf在调控脂肪细胞发育代谢中发挥重要作用[3],动物实验发现Lf 能降低高脂饲料(HFD)喂养动物的体重和血脂/肝脂水平[4-7]。脂代谢异常和肝脏胆固醇积累是肥胖的重要特征之一[8]。胆固醇的转化和代谢必须在肝脏完成,主要由内源性胆固醇合成、外源性胆固醇吸收以及机体内胆固醇的外排3 个方面进行调控[9]。人体主要依靠将胆固醇转化为胆汁酸来实现胆固醇的外排,肠道中的胆固醇大多数又通过肠肝循环回流至肝脏并被肝脏重吸收,即胆固醇逆转运(Reverse cholesterol transport, RCT)[9]。体内胆固醇平衡通过转录调节网来维持,肝X 受体(LXRs)分为LXRα和LXRβ2 种亚型,是配体激活的转录因子,属于核受体超家族中的一员。LXRs 与其它核受体超家族成员一起促进胆固醇贮存、转运和分解代谢[10]。本研究以HFD 喂饲大鼠,从LXRα 及其相关基因调节的角度探讨Lf 干预改善肝脏胆固醇积累的作用及机制。
1 材料与方法
1.1 试剂与仪器
乳铁蛋白,Hilamr 公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride, TG)试剂盒,南京建成生物工程研究所;动物饲料,戴茨生物科技(无锡)有限公司;引物合成,苏州金唯智生物科技有限公司;逆转录和PCR 试剂盒,翌圣生物科技上海有限公司;DMI8 型显微镜,徕卡显微系统(上海)贸易有限公司;离心机,艾本德(上海)国际贸易有限公司。
1.2 动物和分组
30 只5~6 周龄的雄性SD 大鼠购于浙江维通利华实验动物技术有限公司,饲养于(22±2)°C 的恒温和60%相对湿度,12 h 的日/夜循环的SPF 动物房中。适应性饲养1 周后,随机分为3 组:(1)CON 组,喂饲标准饲料AIN-93G;(2)HFD 组,喂饲高脂饲料(脂肪供能比60%)诱导肥胖模型;(3)HFD+Lf 组,将HFD 中0.4%酪蛋白替换成Lf(委托戴茨生物科技(无锡)有限公司加工)进行饲喂。本研究在HFD 喂养的同时进行Lf 干预,观察其预防效果。在16 周的干预过程中,自由进食饮水,每周记录体重及摄食量。实验经苏州大学动物福利委员会审核批准(202102A077)。
1.3 收集肝脏和小肠标本
干预结束前12 h 禁食,10%水合氯醛腹腔注射麻醉后腹腔腹主动脉取血离心得血清,迅速分离肝脏和肠组织。取部分肝脏置于10%福尔马林溶液固定,用于组织病理学观察;部分肝脏和生理盐水清洗干净的回肠末端转移到冻存管,于-80 °C 冰箱中保存。用于肝脏脂肪测定和胆固醇代谢相关基因水平测定。
1.4 肝脏TC 和TG 测定
取冷冻保存的肝脏组织,冰浴研磨,离心(2 500 r/min,10 min)取上清,按试剂盒说明书操作测定TG 和TC水平。
1.5 肝脏组织病理学观察
取10%福尔马林溶液固定的肝脏组织,进行常规包埋、切片(4 μm)和苏木精-伊红(HE)染色。切片在显微镜(100 倍和200 倍)下观察并采集图像,并进行脂肪变性评分和NAFLD 活动度评分(NAS)[11]。NAS得分在10 倍镜下任取5 个视野,由肝细胞脂肪变、小叶内炎症和肝细胞气球样变3 方面综合评分。NAS>4分可诊断非酒精性脂肪肝。
1.6 PCR 检测基因表达
取冷冻保存的肝脏及回肠,提取cDNA 后用逆转录试剂盒逆转录为mRNA,按照qPCR 说明书将其与上下游引物及PCR 反应液混合后离心上机,采用2-ΔΔCt 法计算结果,GAPDH 为内部对照。用熔解曲线分析来评估扩增的特异性。所用引物序列Forward Primer(5’to 3’)及Reverse Primer(5’to 3’)分别为:GAPDH:CTCTCTGCTCCTCCCTGTTC,CGATACG GCCAAATCCGTTC;LXRα:TGCCCACTTTACTGA GCTGG,TCTCCAGAAGCATCACCTCG;ABCA1:GG GCTCCTCCCTGTTTTTGA;TCTGAGAAACACTG TCCTCCTTT;ABCG1:ATCATGCGGGACTCGGTA CT,AGAACAGGAAGCCGGAGTTG;ABCG5:CTTAG GTAGCTCAGGCTCAGG,GCCGTTCACAAACACT TCCC;NPC1L1:GTGGCCCCCATAAGGATGAG,AT ACGCTGCTAGACCCCCTT。
1.7 统计分析
数据以均数(Mean)±标准差(SD)表示,用SPSS 26.0 软件(美国SPSS 公司)进行统计分析。统计分析采用单因素方差分析(ANOVA),然后使用Bonferroni的事后检验进行多重比较。P<0.05 表示2 组间具有统计学差异。
2 结果与讨论
2.1 Lf 对体重、肝脏脂肪含量的影响
干预第16 周时,与CON 组比较,HFD 组大鼠体重显著增加,体重增加超20%,因此HFD 喂饲成功诱导了大鼠肥胖。与HFD 组相比,HFD+Lf 组大鼠的体重显著降低了13%,如图1(a)。相应地,HFD 组大鼠肝脏TG 和TC 含量也显著升高,而Lf 干预抑制了HFD 诱导的肝脏TC 和TG 含量的增加,如图1(b)及图1(c)所示。结果提示Lf 干预具有降低体重和肝脏脂肪含量的作用。
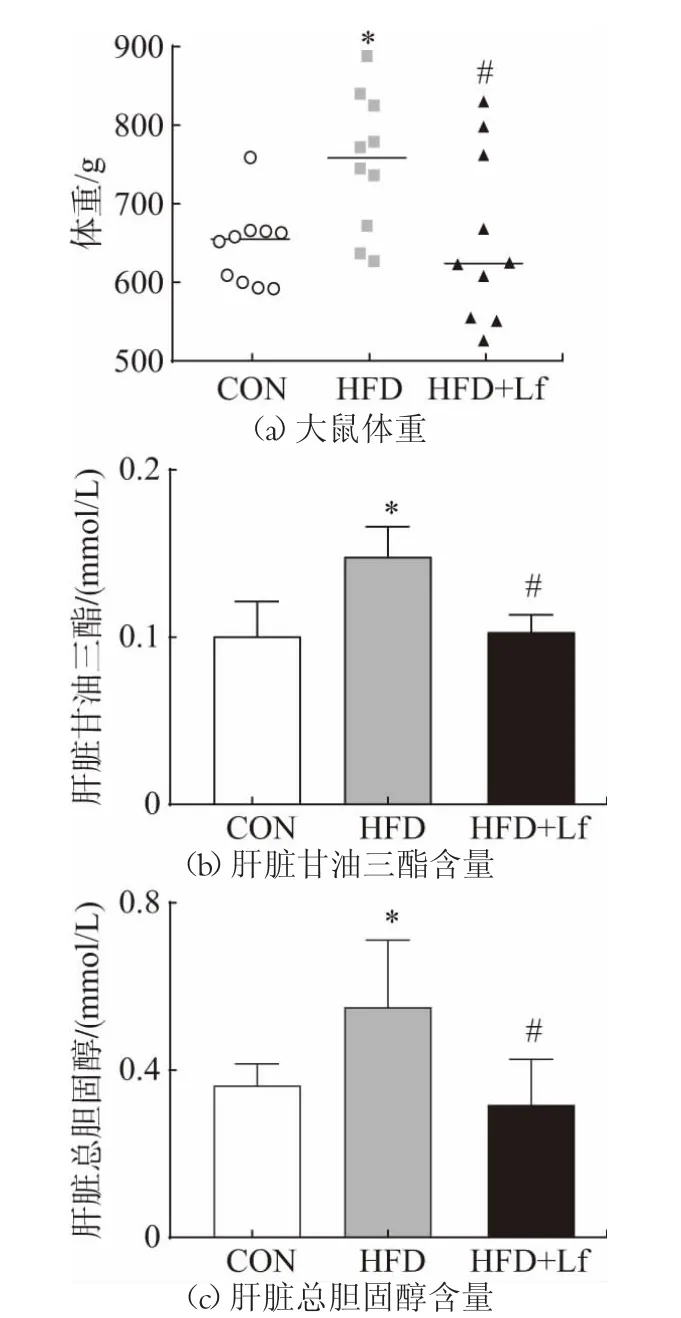
图1 各组大鼠体重、肝脏TG 及TC 含量
2.2 Lf 对肝脏形态学结构的影响
肥胖通常伴有肝脏的脂肪变性,病例组织学是诊断NAFLD 和判断其预后的金标准。肝脏HE 染色后CON 组大鼠的肝细胞形态和结构正常,HFD 组则观察到许多大小不均的脂滴空泡堆积、大泡性脂肪变性和微泡状脂肪变性,显示HFD 诱导了大鼠肥胖和肝脏脂肪堆积。但是HFD+Lf 组的空泡的数量和体积减小,如图2(a)所示。半定量分析进一步显示HFD+Lf组显著降低了HFD 组中升高的steatosis 评分和NAS评分,如图2(b)及图2(c)所示。表明Lf 干预可以改善大鼠肝脏脂滴积累,改善肝脏脂肪变性。AOYAMA Y[12]的研究也发现,Lf 可以显著降低高脂喂养的Cx32ΔTg大鼠肝脏的NAS 评分和纤维化面积,从而缓解其脂肪性肝炎。
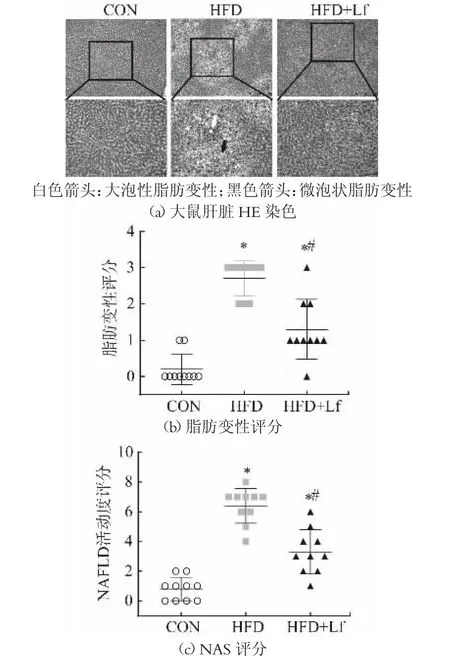
图2 各组大鼠肝脏HE 染色以及脂肪变性评分和NAFLD 活动度评分
2.3 Lf 对肝脏胆固醇代谢相关基因表达的影响
LXRα 在肝脏中大量存在,脂肪、肠等组织也普遍存在和表达。LXRα 主要通过参与RCT,促进胆固醇在肝脏中的代谢,促进胆固醇在小肠中的排泄并阻止其外周细胞的摄取等途径,发挥其降低胆固醇的作用[10]。结果发现与CON 组相比,HFD 组大鼠肝脏LXRα 的mRNA 表达水平,有下调趋势,但是HFD+Lf 组LXRα 的mRNA 表达水平显著高于HFD 组,如图3 所示,表示其在Lf 调节胆固醇代谢中发挥作用。在肝脏中,LXRα 通过上调胆固醇转运体(ABCA1、ABCG1、ABCG5)介导外周组织细胞胆固醇流出从而调节RCT 过程[10],我们也发现Lf 上调了ABCA1、ABCG1 和ABCG5 的mRNA 的表达水平,其中ABCA1 和ABCG5 具有统计学差异,如图3 所示。LXRα 和SREBP 互为拮抗分子,共同维持胆固醇代谢的平衡,SREBP2 是调控胆固醇从头合成的转录因子,并能作用于低密度脂蛋白受体,使细胞摄取更多胆固醇[13-14],HFD 组大鼠肝脏SREBP2 的mRNA 表达水平显著高于CON 组,HFD+Lf 组逆转其上调,表达水平显著低于HFD 组,如图3 所示,即Lf 显著下调了SREBP2 基因的转录水平,从而降低胆固醇的从头合成并促进胆固醇外排。另外,LXRα 还是调节胆汁酸代谢的核受体,用高胆固醇饲料喂养LXRα 敲除小鼠,不能上调胆汁酸代谢经典途径的限速酶CYP7A1,从而导致肝脏胆固醇积累[15]。我们前期的研究发现Lf 干预高脂高胆固醇膳食喂养小鼠8 周后,增加了粪便中总胆汁酸和结合型胆汁酸含量[6]。结合本研究的发现,我们可以推测,Lf 可能通过调节LXRα增加了胆汁酸排泄,通过下调SREBP2 减少胆固醇的合成,进而减少了肝脏胆固醇积累。
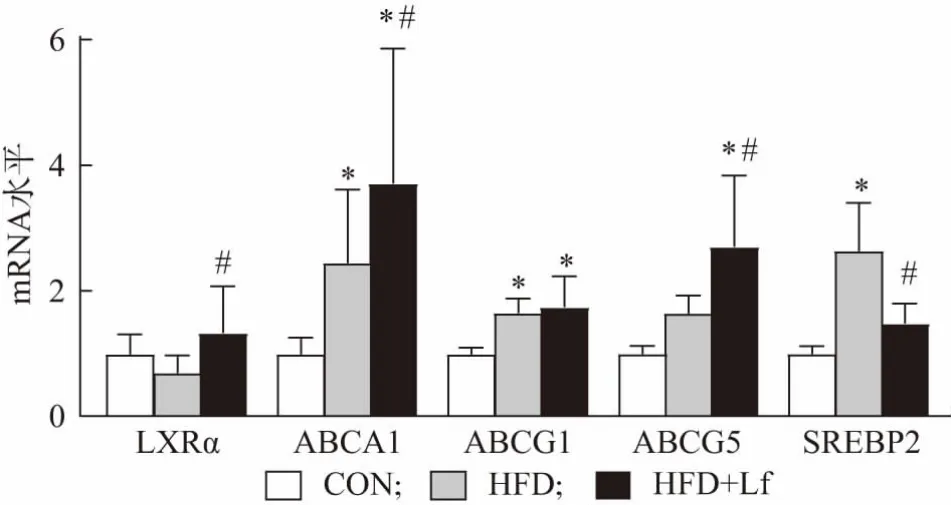
图3 肝脏胆固醇代谢相关基因的表达
2.4 Lf 对肠道胆固醇代谢相关基因表达的影响
在小肠中,LXRα 的激活通过基底侧ABCA1 增加高密度脂蛋白合成,并通过ABCG1 及ABCG5 促进胆固醇外排和经肠道的胆固醇分泌。与CON 组相比,HFD 组大鼠回肠末端LXRα 的mRNA 表达水平有下调趋势,但是HFD+Lf 组LXRα 的表达则显著高于HFD 组。与HFD 组比较,ABCA1、ABCG1 和ABCG5的表达水平则显著上调,如图4 所示。因此,Lf 上调小肠LXRα、ABCA1、ABCG1 和ABCG5 的mRNA 水平,从而促进胆固醇外排。另外,HFD 组大鼠肠道胆固醇吸收相关蛋白NPC1L1 的mRNA 表达水平显著高于CON 组,HFD+Lf 组的表达水平显著低于HFD 组,如图4 所示。LXRα 能通过抑制NPC1L1 直接抑制胆固醇吸收[9]。同时,Lf 下调了NPC1L 的基因表达,从而抑制了胆固醇吸收。Lf 是乳清蛋白的重要组成成分,我们前期的研究也发现乳清蛋白能显著上调HFD 喂养小鼠的肠道LXRα 和ABCG1 蛋白表达,增加胆固醇外排[16]。
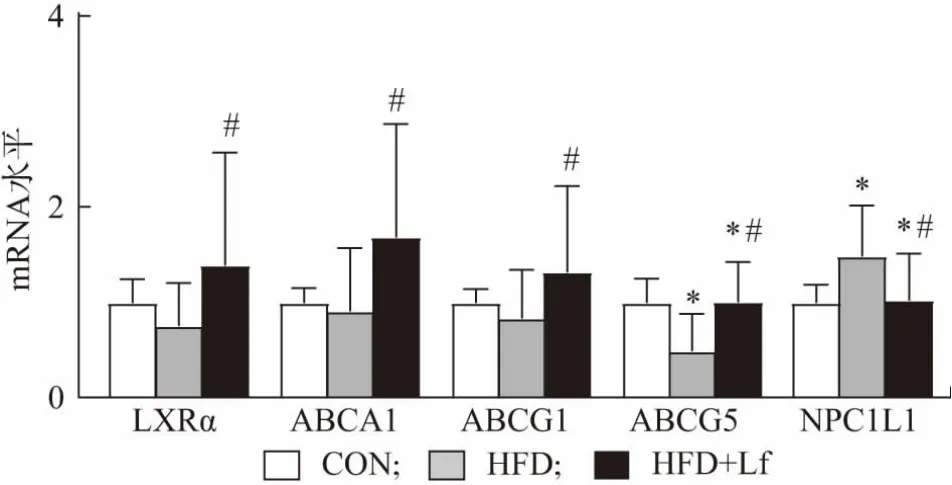
图4 肠道胆固醇代谢相关基因的表达
3 结 论
综上所述,Lf 干预缓解了HFD 导致的肝脏脂肪积累,这可能与Lf 上调肝脏和肠道的LXRα、ABCA1和ABCG5 的mRNA 水平,下调肝脏SEBP2 及肠道NPC1L1 的mRNA 表达水平,从而促进胆固醇的外流,并减少肠道胆固醇的吸收有关。

