低聚半乳糖植物乳杆菌发酵乳的代谢组学分析及其肠道菌群调节活性研究
户行宇,赖田甜,刘同吉,薛瑞,陈雅璐,杨贞耐
(北京工商大学北京老年营养与健康教育部重点实验室北京食品营养与人类健康高精尖创新中心北京市食品添加剂工程技术研究中心,北京 100048)
0 引 言
低聚半乳糖(Galacto-oligosaccharide,GOS)是一类通过β-半乳糖苷酶的水解和转半乳糖基活性,将水解乳糖得到的多个半乳糖单元以β-(1-4)、β-(1-6)或β-(1-3)等糖苷键连接在半乳糖或葡萄糖单元,得到聚合度(DP)在2~8 之间的寡糖混合物[1-2]。GOS 通常被称为“双歧杆菌生长因子”,其不但可以促进肠道内有益菌的增殖,还可以抑制大肠杆菌、致病性梭状芽胞杆菌等有害菌的繁殖,起到平衡肠道菌群的作用[3-4]。研究发现,食用GOS 会在结肠中产生短链脂肪酸(SCFA),包括丙酸、乙酸和丁酸等酸性物质。这些代谢物,尤其是丁酸,在结直肠癌的治疗中发挥着重要的保护作用[5]。
传统发酵乳一般由嗜热链球菌(Thermophilus)、德氏乳杆菌保加利亚亚种(Lactobacillus)或双歧杆菌(Bifidobacterium)发酵生成,相比于鲜牛乳因其含有大量的益生菌,可以改善肠道健康,备受消费者青睐[6],植物乳杆菌能够产生乳酸菌素、过氧化氢、双乙酰等多种天然活性物质,具有维持肠道内菌群平衡的作用[7]。但是,目前关于GOS 对植物乳杆菌发酵牛乳的代谢产物的影响以及GOS 发酵乳调节肠道菌群活性研究较少[8]。因此,本文利用课题组前期制备的GOS 以及分离自内蒙古传统奶酪的植物乳杆菌NMGL2 制备GOS 发酵乳[9-10],采用代谢组学方法分析该发酵乳的差异代谢物,并采用体外人体粪便共培养模型,探究GOS 植物乳杆菌发酵乳的肠道菌群调节活性,为进一步了解GOS 对发酵乳功能性的影响提供参考。
1 材料与方法
1.1 实验材料与试剂
鲜牛乳,北京三元股份有限公司;植物乳杆菌(Lactobacillus plantarum)NMGL2(保藏编号为CGMCC No. 18495),-80 ℃甘油管保存;低聚半乳糖(GOS,90.17%),实验室制备;MRS 培养基,北京奥博星生物技术有限公司;甲醇、L-2-氯苯丙氨酸、乙腈、异丙醇、甲酸、丙醇,赛默飞公司;氯化钠、酵母提取物、蛋白胨、胆盐、磷酸缓冲液(PBS),索莱宝生物科技有限公司;血红素、维生素K1、牛胆盐、半胱氨酸,国药集团化学试剂有限公司。
1.2 仪器与设备
UHPLC -Q Exactive HF-X 超高效液相色谱串联傅里叶变换质谱,赛默飞公司;HSS T3 色谱柱,Waters 公司;JXDC-20 氮气吹扫仪,上海净信实业发展有限公司;LNG-T88 台式快速离心浓缩干燥器,太仓市华美生化仪器厂;Wonbio-96c 高通量组织破碎仪,上海万柏生物科技有限公司;SBL-10TD 超声波清洗机,宁波新芝生物科技股份有限公司;厌氧培养盒,三菱化学公司;HZQ-Q 数显pH 计,哈尔滨市东联电子有限公司。
1.3 方法
1.3.1 GOS 植物乳杆菌发酵乳的制备
将-80 ℃甘油管保存的植物乳杆菌NMGL2 以3%(V/V)的接菌量接种至冷却后的MRS 液体培养基中,37 ℃条件下静置培养48 h;活化2 代后,获得菌悬液(菌悬液的菌浓度为1010CFU/mL)。向鲜牛乳中分别添加0、2%、4%、6%(m/V)的GOS,90 ℃下巴氏消毒杀菌10 min,然后冷却至37 ℃,将活化好的菌悬液接种至巴氏杀菌奶中,37 ℃静置发酵24 h。发酵后的样品于-80 ℃冷冻保存。
1.3.2 GOS 植物乳杆菌发酵乳非靶向代谢组学分析
将-80 ℃保存的4 组不同GOS 添加量的样品取出,室温解冻,分别命名为GOS_0、GOS_2、GOS_4、GOS_6。取100 μL 发酵乳样品加入400 μL 提取液(V甲醇∶V水=4∶1)含0.02 g/L 的内标(L-2-氯苯丙氨酸)进行代谢产物提取。冷冻组织研磨仪研磨,然后低温超声提取。将样品静置于-20 ℃,离心30 min 后取上清液,采用超高效液相色谱串联傅里叶变换质谱UHPL-Q Exactive HF-X 系统进行LC-MS 上机分析[11]。
色谱条件:HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm),柱温设为40 ℃。流动相A 组成:95%水+5%乙腈(含0.1%甲酸),流动相B 组成:47.5%乙腈+47.5%异丙醇+5%水(含0.1%甲酸)。分离梯度:流动相B 从0 逐步升至100%,流速从0.4 mL/min 升至0.6 mL/min;再逐步将流动相B 从100% 降至0,流速调整为0.4 mL/min。质谱条件:选用正负离子的扫描模式,质量扫描范围m/z:70~1 050。正离子电压选用3 500 V,负离子电压选用2 800 V,MS1 分辨率70 000,MS2 分辨率17 500[12]。
质控样本(Quality control,QC)是通过将所有样品的等体积混合制成混合样品。在整个分析过程中,间隔插入,以提供一组可评估重复性的数据[11]。完成上机之后,对LC-MS 原始数据进行处理。将MS 和MSMS的质谱信息与代谢公共数据库HMDB 和Metlin 数据库进行匹配整理,从而得到代谢物的相关信息[12]。将整理后的数据上传至美吉生物云平台(https://cloud.majorbio.com)进行相关的数据分析。采用人类代谢组数据库(HMDB)进行代谢物分类,通过KEGG 数据库进行代谢通路的注释,从而筛选得到差异代谢物所参与的通路[14]。
1.3.3 GOS 植物乳杆菌发酵乳对肠道菌群的影响
(1)发酵乳体外模型消化处理。参照郝晓娜等[8]的方法稍作修改。将10 mL 发酵乳与10 mL 的NaCl(35 mmol/L)水溶液混合制成发酵乳溶液,模拟胃液环境水解1 h,然后模拟肠道环境消化1 h,最终得到体外模拟消化后的样品。
(2)BCM 培养基的配制。参照郝晓娜等[8]的方法稍作修改。依次称取酵母提取物、蛋白胨、胆盐等培养基组成成分,用蒸馏水定容至2 L,用蒸馏水定容至2 L,用1 mol/L 乙酸调pH 至7.0,灭菌(121 ℃,15 min)后取出备用。
粪便共培养。实验当天需要收集健康成人(2 男1女,年龄20~28 岁,BMI 值均在20.0~23.5 之间)的粪便,志愿者无饮酒和吃药的情况,近期内未服用过抗生素等药类,且未患有慢性肠道类疾病。将中段粪便与PBS 缓冲液震荡混匀,在厌氧培养箱中,利用PBS缓冲溶液将粪悬液浓度配制成20%(m/V),过滤收集滤液,2 h 内完成粪悬液的处理。将体外模拟消化后的样品与粪悬液以1∶2 的比例混合,加入BCM 培养基,将其置于厌氧工作站中培养,培养4、12 h 取样,最终的样品分组如表1 所示。将培养液于10 000g、4 ℃下离心20 min,从而去除上清液,获得沉淀的菌体,利用16S rRNA 测定菌群组成的多样性。将测序筛选获得的有效序列进行OUT 的划分聚类,对粪便样本中菌群组成的多样性及样本之间的差异进行分析。
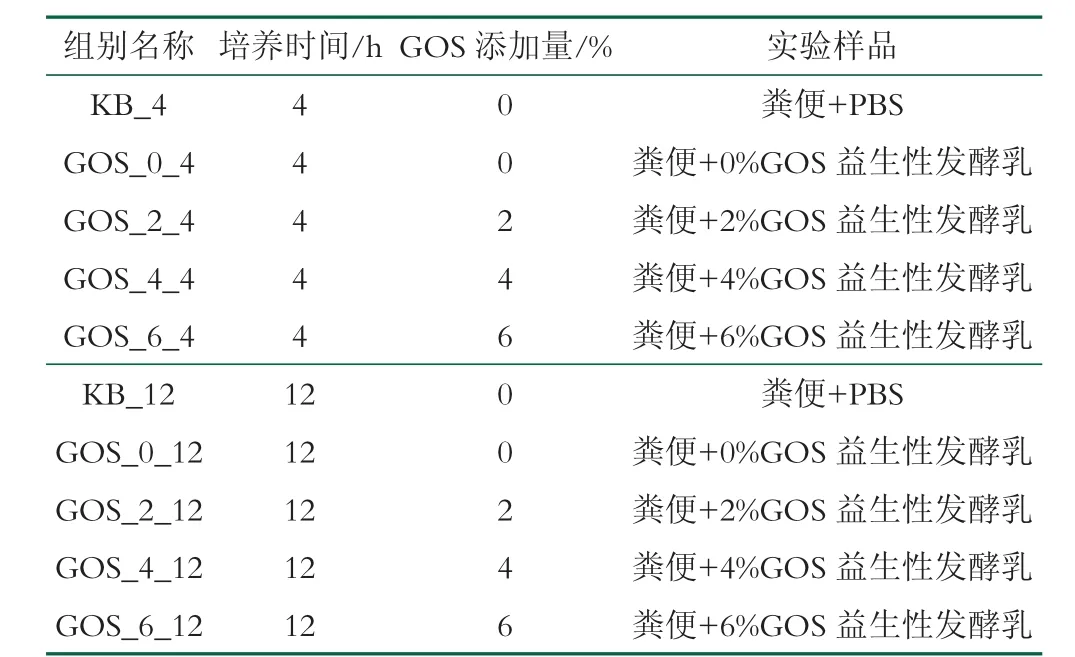
表1 实验分组
1.3.4 数据分析
每个样品平行测试3 次,数据以平均值±标准误表示,采用Excel、IBM SPSS Statistics 25 和origin 8.5 软件进行处理。P<0.05 表示具有统计学差异。
2 结果与分析
2.1 代谢组学结果分析
2.1.1 代谢产物的主成分分析
PCA 分析(Principal Component Analysis),即主成分分析,是一种对大量实验数据进行降维简化分析的技术,得分图中各点相距越近说明样本之间越相似,2样本相距越远说明样本之间差异性越高[13]。本研究利用LC-MS 对GOS 不同添加量的益生性发酵乳中的代谢产物组成进行分析。由图1 可知,在正负离子扫描模式下全部QC 样品聚集成一簇,且与受试样品的区分明显,说明该数据采集过程中仪器稳定性非常好,所得数据准确可靠。在阳离子、阴离子模式下,第1、2 主成分的累计解释量分别为78.5%、83.8%。且不同样品组间区分较明显,距离较大,说明随着GOS 添加量的增加,发酵乳体系内代谢物组成具有明显的差异性[14]。
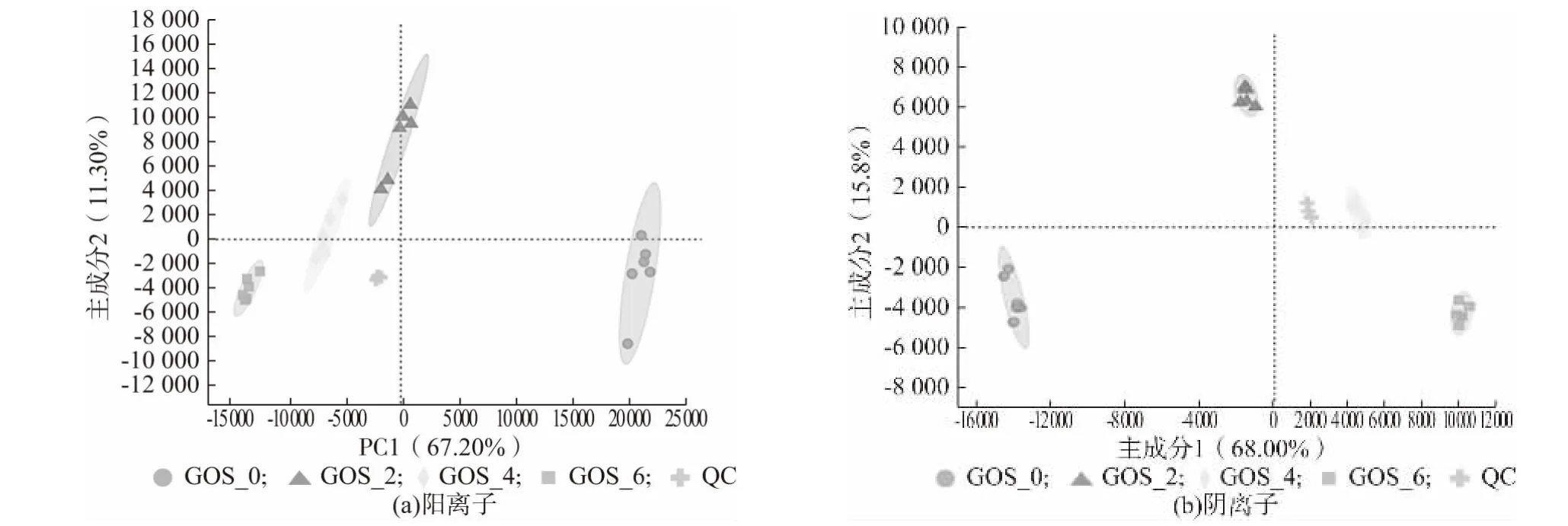
图1 发酵乳代谢产物PCA 分析
2.1.2 代谢产物的OPLS-DA 分析
OPLS-DA 是一种在PCA 的基础上再进一步计算分析的方法,该方法能够尽可能地去除未控制变量对数据的影响,更好对组间差异进行区分[15]。图2、图3、图4 分别为GOS_0 与GOS_2、GOS_0 与GOS_4、GOS_0 与GOS_6 代谢产物的OPLS-DA 分析图。由图可知,添加GOS(2%、4%、6%)的益生性发酵乳与未添加GOS 的发酵乳在OPLS-DA 图上的距离较大,都能够实现组间的完全区分,同时在阳离子、阴离子模式下第一、二主成分的解释度较高,说明添加GOS的益生性发酵乳与未添加GOS 的发酵的代谢产物存在着明显的差异。添加GOS 的益生性发酵乳与未添加GOS 的发酵乳OPLS-DA 判别分析的参数结果如表2 所示,R2X、R2Y和Q2分别表示模型的解释率和预测率,数值越是接近于1,表示该模型越为理想,对样本的解释率和预测率越好[16]。由表2 可知GOS_0 与GOS_2、GOS_0 与GOS_4、GOS_0 与GOS_6 这3 个模型的解释率和预测率均在0.8 以上,进一步证实3种实验模型的区分程度较好。
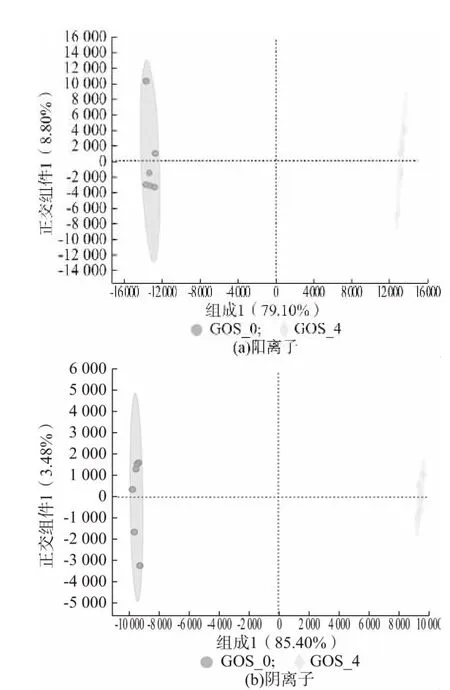
图3 GOS_0 与GOS_4 代谢产物的OPLS-DA 分析

图4 GOS_0 与GOS_6 代谢产物的OPLS-DA 分析

表2 OPLS-DA 统计结果
2.1.3 发酵乳的差异代谢物筛选
代谢组学是对生物样本中存在的小分子的综合研究,是一种更好地理解宿主-微生物相互作用的新方法,也是对样本潜在益生性的一种探究[17]。为了明确不同GOS 添加量的益生性发酵乳之间的代谢物差异,以P<0.05、VIP值>1 为筛选标准,将GOS 添加量为2%、4%、6%的益生性发酵乳分别与未添加GOS(0%)的发酵乳进行两两分组比较,并分析各差异组之间代谢物数目的异同。图5 反映了GOS_0 与GOS_2、GOS_0 与GOS_4、GOS_0 与GOS_6 差异代谢产物的数目。从图5 中可以看到,GOS_2 与GOS_0有139 种差异代谢物,GOS_4 与GOS_0 有147 种差异代谢物,GOS_6 与GOS_0 有149 种差异代谢物。

图5 差异代谢物数目
结合KEGG 数据库对这些差异物质中的功能性代谢产物进行进一步筛选,结果如表3 所示,筛选出24种功能性代谢产物影响代谢过程。图6 为KEGG 化合物的分类,由图6 可知,筛选出来的功能性差异代谢产物主要包括氨基酸、有机酸、核苷酸及碳水化合物。其中,氨基酸是生命体的物质基础,是生命体正常生长代谢至关重要的营养物质,也能增加机体抵抗力[18],若摄入其不足会导致低血糖[19]。氨基酸不仅可以缩短发酵时间,其作为风味化合物的前体物质,能够进一步转化成醛类、酯类和醇类等物质,从而影响发酵产品的风味[13]。有机酸除了调味以外,还具备杀菌和抑菌等作用,可以调节宿主免疫功能[19]。核苷酸几乎参与了生物体内的所有反应过程,可以为生物体核酸合成提供材料,并且在能量代谢上具有重要功能,缺乏核苷酸会损害肠道、肝脏和免疫系统[20]。碳水化合物是生命体的重要供能物质,可以起到调节生命体日常活动的作用。其中异柠檬酸盐、乌头酸、肌醇、2-脱氧-D-核糖、β-羟基丁酸等含量显著增加,1-磷酸葡萄糖、尿酸含量降低。
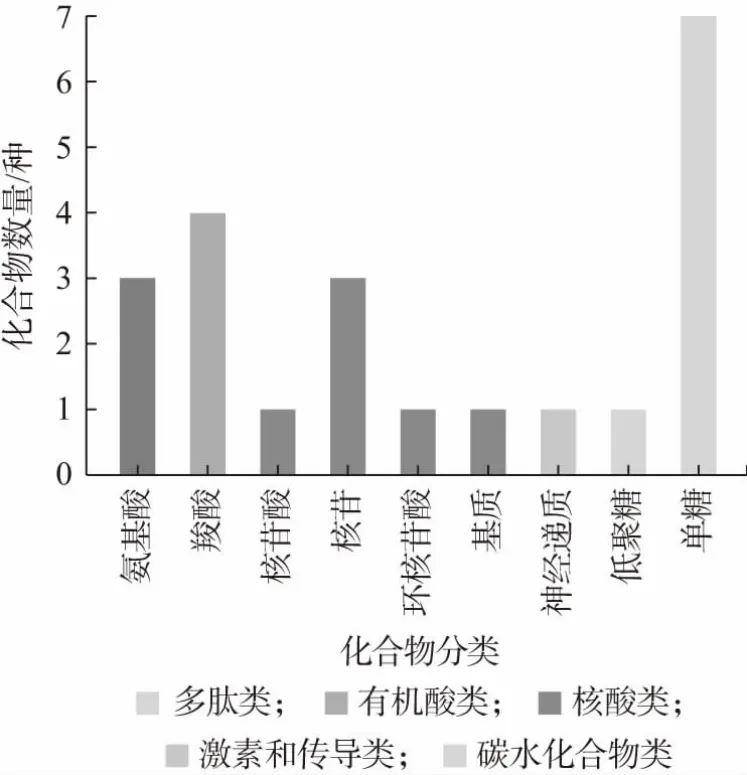
图6 KEGG 化合物分类
2.1.4 代谢通路分析
GOS 植物乳杆菌发酵乳的差异代谢物的代谢途径分析结果如图7 所示。由图7 可知,通路分析结果显示共得到26 个途径,以P<0.05 为标准对关键代谢途径进行筛选,其中有4 条存在显著性差异,分别为氨基糖和核苷酸糖代谢途径、半乳糖代谢途径、TCA 循环、嘧啶代谢途径。胞嘧啶核苷、异柠檬酸盐、乌头酸、肌醇、β-羟基丁酸等显著增加,1-磷酸葡萄糖、尿酸含量降低。胞嘧啶核苷参与嘧啶代谢途径,是抗病毒与抗肿瘤类药物的生产过程中的重要中间体[21]。代谢途径与功能性差异代谢产物联合分析如图8 所示,异柠檬酸盐与乌头酸作为有机酸,参与三羧酸(TCA)循环,TCA 循环是生物体内营养物质氧化供能的共同途径,异柠檬酸、乌头酸含量增加,说明能够提高生物体内营养物质的“逐步释能”[22]。β-羟基丁酸在机体内含量较低,但其以信号分子、能量底物等多种物质形式广泛参与到机体健康成长过程中,β-羟基丁酸经脱氢酶作用被氧化形成乙酰乙酸,乙酰乙酸经酮体氧化,而后通过硫解酶催化得到乙酰CoA[23],通过乙酰CoA 连接糖酵解途径与TCA 循环,其作为具有生物活性的小分子物质,具有保护神经、心血管等组织器官的作用,对缓解骨质减少有保护功能。尿酸是人体嘌呤代谢的终产物,磷酸戊糖途径属于嘌呤代谢的一种[19],嘌呤代谢异常会引发多种疾病,尿酸主要由肾脏排泄,尿酸积聚可能会导致痛风。肌醇参与半乳糖代谢途径,其常作为营养强化剂被应用于功能性食品中,可以保护肝脏,对骨骼肌代谢和骨骼生长具有积极作用,并且可以加快脂肪的消耗,有效预防脂肪堵塞心血管症状[24]。

图8 代谢途径与功能性差异代谢产物关联分析
因此,GOS 的添加能够促进发酵乳次级代谢的合成与积累,使GOS 植物乳杆菌发酵乳具有保护心血管、增强骨骼密度、供给人体能量等潜在功效,是一种能潜在降低痛风风险的发酵乳产品。
2.2 GOS 植物乳杆菌发酵乳对肠道菌群的调节作用
2.2.1 物种α-多样性分析
α-多样性常用来指示某个特定的区域或者生态系统内的物种或种群的多样性,其中ace 指数常用来反映群落的丰富度,ace 指数越高,群落的丰富度越大,如图9(a)所示,ace 指数无显著变化(P>0.05),说明群落中含有的物种总数无显著变化;simpson 指数常用来反映群落物种多样性,群落多样性是对群落丰富度与均匀度的综合分析,simpson 指数越大,物种多样性越小,由图9(b)可知,GOS 植物乳杆菌发酵乳降低了群落多样性,可能是部分益生菌成为了优势菌群,因此使得群落的均匀度降低。Arnold 等用含益生元的食物喂食动物2 周后,动物微生物组成的α-多样性显著降低,有益微生物的相对丰度增加,包括Bifidobacterium和Bacteroides等[25]。此外,有研究发现GOS 降低了整体菌群多样性,增加了拟杆菌属与乳酸杆菌属的丰度。
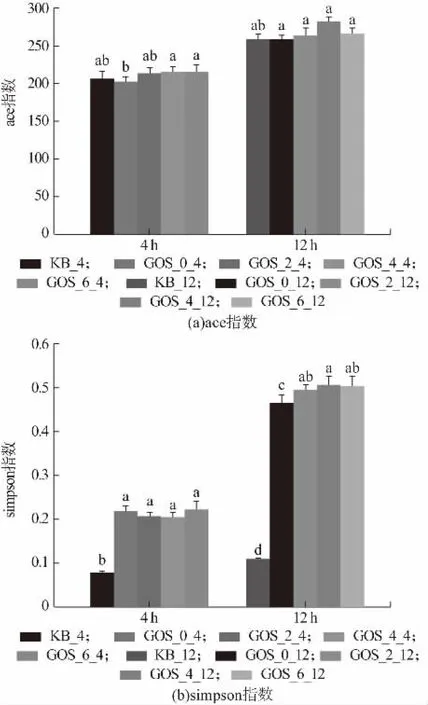
图9 物种多样性分析
2.2.2 GOS 益生性发酵乳对肠道菌群群落的组成分析
益生菌通过多种途径影响人体健康,微生物群落组成失衡(失调)会导致冠心病、脂肪肝、类风湿性关节炎、炎症性肠病等多种疾病[1]。图10 反映的是门水平上肠道菌群的物种组成。由图10 可知,肠道菌群主要由放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)组成,添加GOS 的益生性发酵乳和粪便共培养4、12 h 后,在门水平上,Actinobacteria 和Bacteroidetes 的相对丰度有所提高,而Firmicutes 的相对丰度降低;图11 反映的是属水平上肠道菌群的物种组成。由图11 可知,在属水平上,GOS 益生性发酵乳增加了群落中Bifidobacterium, Bacteroides,Koalas等有益菌的丰度,抑制了Shigella等有害菌的繁殖。在人体肠道环境中,Bifidobacterium属于Actinobacteria 的主要菌属,Bifidobacterium的增殖可代谢产生乳酸、乙酸、丁酸等这类酸性物质,这些酸性物质可降低机体肠道环境的pH,对有害菌的生长起到抑制作用[26]。Koalas可以产生短链脂肪酸,其属于Firmicutes,Koalas相对丰度增加,而Firmicutes 整体丰度下降,说明GOS益生性发酵乳对Firmicutes 起到一定的调节作用[8]。因此,GOS 益生性发酵乳虽然降低了菌群多样性,但是提升了有益菌的相对丰度,降低了有害菌的相对丰度,有益于调节人体健康。
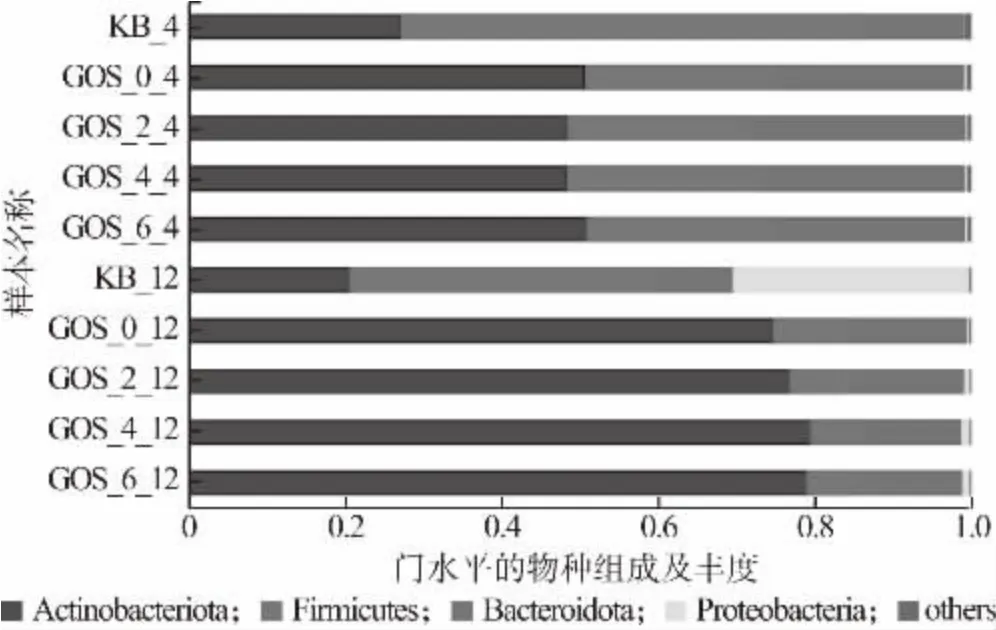
图10 肠道菌群在门水平的物种组成及其丰度
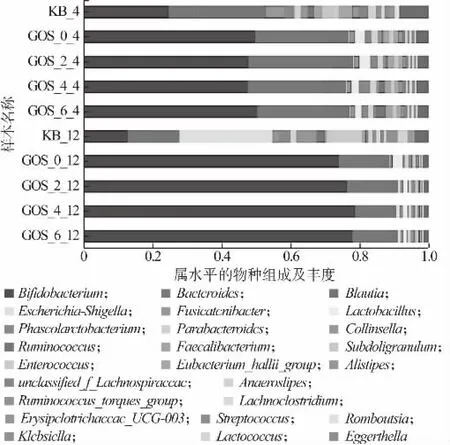
图11 肠道菌群在属水平的物种组成及其丰度
2.2.3 物种β-多样性分析
采用β-多样性分析探究不同样本间微生物群落物种组成的相似度及差异性。PCoA 分析(Principal co-ordinates analysis),即主坐标分析,其与PCA 分析相类似。结果如图12(a)所示,同种颜色的点代表来自同一分组的样本,培养4 h 与12 h 后,添加GOS 的益生性发酵乳与空白对照组空间距离较远,说明菌群组成相似性低,表明添加GOS 的益生性发酵乳对肠道菌群组成的影响较大。
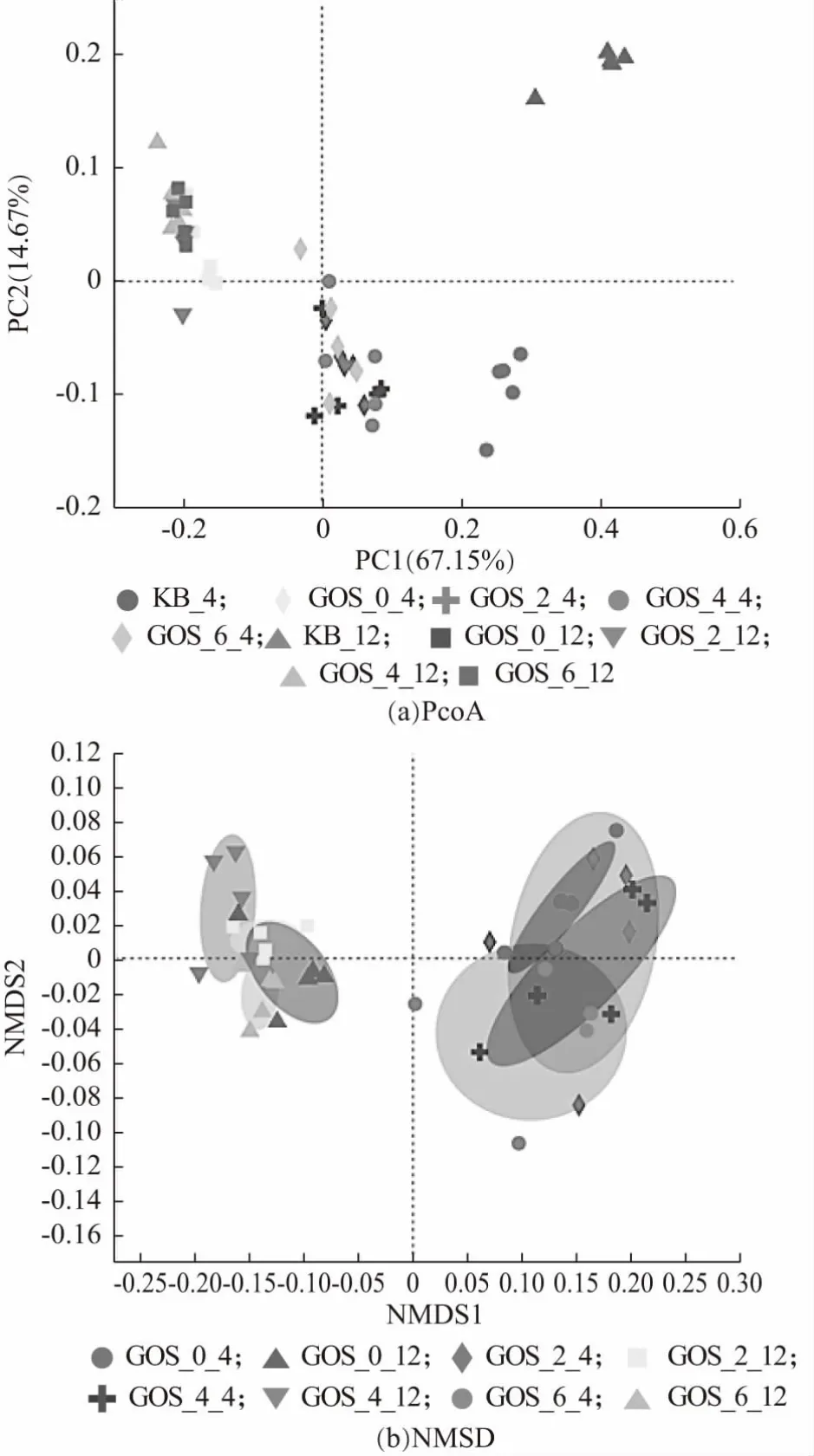
图12 肠道菌群β-多样性分析
非度量多维尺度分析(NMDS 分析)是可以在保留原始样本的关系基础之上,降维分析比较不同样本组之间的差异。stress 值为0.042,低于0.05,表明NMDS结果具有很好的代表性,反映添加GOS 的益生性发酵乳所导致的群落结构差异。如图12(b)所示,图中每一个样本都用一个点来表示,同组样本的颜色一样,两点之间相距越紧密表明两者的菌群结构组成越相近。由图12(b)可见,培养4 h 后,在属水平上,GOS 添加量为4%与6%的益生性发酵乳与未添加GOS 的发酵乳对肠道菌群的影响有较大差异,而GOS 添加量为2%的益生性发酵乳对肠道菌群的影响差异较小。培养12 h 后,在属水平上,GOS 添加量为4%的发酵乳对肠道菌群的影响具有显著差异。说明GOS 添加量为4%时,该GOS 益生性发酵乳对肠道菌群物种组成影响最大。
3 结 论
代谢组学研究表明,植物乳杆菌发酵乳中添加GOS 后,其中氨基酸、有机酸、核苷酸及碳水化合物等代谢物显著增加(P<0.05),同时发现了4 条具有显著性差异的代谢产物代谢途径,分别是氨基糖和核苷酸糖代谢途径、半乳糖代谢途径、TCA 循环、嘧啶代谢途径,正好同显著增加的代谢产物相对应。说明GOS的添加可以加快植物乳杆菌代谢蛋白质、核酸和乳糖,其原理推测是因为GOS 的添加首先激活植物乳杆菌体内半乳糖代谢途径,提高植物乳杆菌对GOS的利用,加快植物乳杆菌的生长,进一步催化体内的氨基酸和核苷酸糖代谢途径、TCA 循环和嘧啶代谢途径,促进植物乳杆菌对蛋白质、核酸和乳糖的代谢。人体肠道菌群在GOS 益生性发酵乳中培养后,增加了双歧杆菌、拟杆菌属、考拉菌属等有益菌的丰度,抑制了大肠埃希氏菌等有害菌的繁殖。DA SILVA 等[27]在对低聚果糖(FOS)的体外粪菌发酵实验中发现FOS 可以显著促进发酵液中拟杆菌和双歧杆菌的增殖,并促进了肠道细菌有益代谢产物短链脂肪酸的产生,ZHANG Y A 等[28]在对比果聚糖和FOS 对猪肠道菌群的影响中发现两者对肠道微生物组成和代谢存在不同动态影响,果聚糖比FOS 具有更强的促进回肠中微生物氨基酸发酵和粪便中碳水化合物发酵的能力。由此说明肠道菌群的种类与氨基酸、碳水化合物、有机酸等代谢物含量息息相关,GOS 通过促进植物乳杆菌代谢生成大量的氨基酸、碳水化合物和有机酸等代谢物从而改善肠道菌群中有益菌和有害菌的比例。

