布氏杆菌周质蛋白 EipB优势T-B联合抗原表位预测及其免疫应答特点
苟 伟,陈 山,何 薇
布氏杆菌病(brucellosis)是一种由布氏杆菌属细菌引起的疾病,是由动物传播的最广泛的人兽共患病之一。人类通常通过直接接触被感染动物、食用或饮用被污染的动物产品或吸入空气中病原体而感染[1-2]。大多数病例由食用来自感染山羊或绵羊的未经高温消毒的羊奶或奶酪引起。宁夏也是主要的高发区,严重威胁着当地人民的健康[3]。目前临床上主要采取三联的方式治疗布氏杆菌,服药周期长,副作用明显,亟特研发有效的疫苗用于布氏杆菌病的防治。
布氏杆菌质蛋白是细胞包膜完整性和毒力的分子决定因素。布氏杆菌周质蛋白(Brucellaperiplasmic protein,EipB)的缺失会导致布布氏杆菌细胞膜完整性的受损以及影响布氏杆菌在小鼠脾脏的定植[4],还有研究报道EipB蛋白参与布氏杆菌稳态的维持[5]。但关于EipB作为疫苗候选分子的研究鲜有报道。本研究拟利用生物信息学方法分析,预测EipB蛋白的抗原表位,选出抗原性较高的2条T、B细胞表位通过血蓝蛋白进行连接,探讨T-B联合细胞表位诱导小鼠产生的免疫效应,为研制基于EipB的布氏杆菌病疫苗提供依据。
1 材料与方法
1.1 实验材料 小鼠脾脏淋巴细胞分离液购自于天津灏洋生物有限公司;流式抗体购自于美国BD公司(货号:15978);ELISA二抗(辣根过氧化物酶标记山羊抗小鼠IgG)均购自于美国Abcam公司;胎牛血清购自于四季青公司;PBS购自于武汉赛维尔公司。
1.2 实验方法
1.2.1 氨基酸序列的获取 使用NCBI数据库检索并获得EipB蛋白质的氨基酸序列,结果如表1,其登录号为WP_021585242.1。
1.2.2 EipB蛋白的理化性质分析 使用在线网站Expasy网站中的ProtParam (https://web.expasy.org/protparam/)程序,分析EipB蛋白的理化性质。
1.2.3 EipB蛋白信号肽序列和跨膜结构域的预测 使用在线预测网站SignalP-5.0 (https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测蛋白质的信号肽序列;使用在线预测软件TMHMM-2.0(https://services.healthtech.dtu.dk/service.php? TMHMM-2.0)预测蛋白质的跨膜结构域。
1.2.4 蛋白质空间结构的预测 使用在线预测网站预测(https://www.novopro.cn/tools/secondary-structure-prediction.html)EipB蛋白质的二级结构。使用在线预测网站SWISS-MODEL分析EipB的三维结构。
1.2.5 蛋白质亲/疏水性预测 使用在线预测软件ProtScale(https://web.expasy.org/protscale/)网站中的Hopp&woods算法预测EipB蛋白的亲/疏水性。
1.2.6 EipB蛋白抗原表位的预测 使用ABCpred数据库预测EipB的B细胞表位;使用IEDB数据库预测EipB的CD4+T和CD8+T细胞表位肽。使用Vaxijen在线网站对表位肽的抗原性进行预测。
1.2.7 T-B优势表位和CpG的合成 委托上海生工进行合成,连接方式为EVRGDAKLEGGKTVVE-KLH-TTTFEGADGKNFRFV,纯度为95%,两条细胞表位肽与KLH之间通过巯基连接。CpG ODN是一种佐剂,其氨基酸通过氢键相连接。CpG佐剂与EVRGDAKLEGGKTVVE-KLH-TTTFEGADGKNFRFV之间无需连接,免疫时,将20 μg联合表位与20 μg溶解后的CpG混匀后即可使用。
1.2.8 实验分组及免疫方式 20只6~8周雌性C57小鼠,随机分成4组:PBS组、KLH+CpG组、CpG佐剂组、T-B+CpG组;PBS组小鼠腹部皮下注射100 μL PBS;KLH+CPG组小鼠腹部皮下注射20 μg KLH蛋白和20 μg CpG佐剂;CPG组小鼠腹部皮下注射20 μg CpG佐剂; T-B+CpG组小鼠腹部皮下注射20 μg T-B联合表位和20 μg CpG、所有小鼠均采用腹部皮下多点免疫方式进行免疫,总共免疫3次,隔周免疫1次。
1.2.9 ELISA检测 10μg/mL T-B联合表位肽包被酶标板,置于4 ℃过夜,PBST洗板5次。5%的脱脂牛奶封闭1 h,PBST洗板5次;按照1∶500稀释血清,每孔100 μL加入酶标板中,在37 ℃烘箱孵育2 h,PBST洗板5次;按照1∶10 000稀释二抗,每孔100 μL,在37 ℃烘箱孵育1 h,PBST洗板7次,进行DAB显色,在450 nm处读取数值。
1.2.10 流式细胞术检测 将1×106个淋巴细胞置于流式管中,使用含10%血清的PBS洗涤2次,加入CD3、CD4、CD8和IFN-γ流式抗体各1 μL,在4 ℃冰箱染色30 min,用含10%血清的PBS洗涤2次,重悬后上机检测。
2 结 果
2.1 EipB蛋白的理化性质 该蛋白是由279个氨基酸组成,等电点为6.03,呈弱碱性,分子量为31 067.12,蛋白质的不稳定系数为11.8,为稳定蛋白,见表1。
2.2 EipB蛋白信号肽序列和跨膜结构域的预测 经过预测分析,表明该蛋白在26-27氨基酸之间含有1个信号肽序列,结果如图1A。在1-30氨基酸之间含有1个跨膜结构域,如图1B所示。
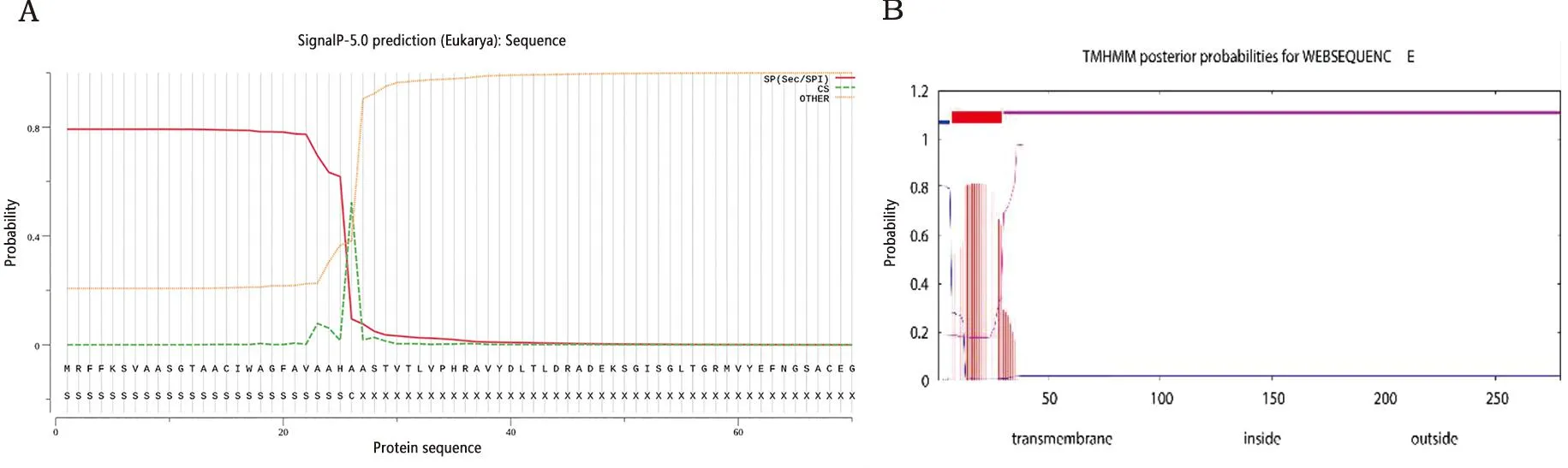
A:EpiB蛋白信号肽预测;B:EpiB蛋白跨膜结构预测
2.3 EipB蛋白空间结构的预测
2.3.1 EipB蛋白二、三级结构的预测 EipB蛋白二级结构中含有α-螺旋(Alpha helix)、β-转角(β-turn)、延伸链(Extended strand)、无规则卷曲(Random coil)等结构,以α-螺旋为主 (图2A)。EipB蛋白的三维结构是在二级结构的基础上进一步盘曲折叠形成的三维空间结构(图2B-D)。
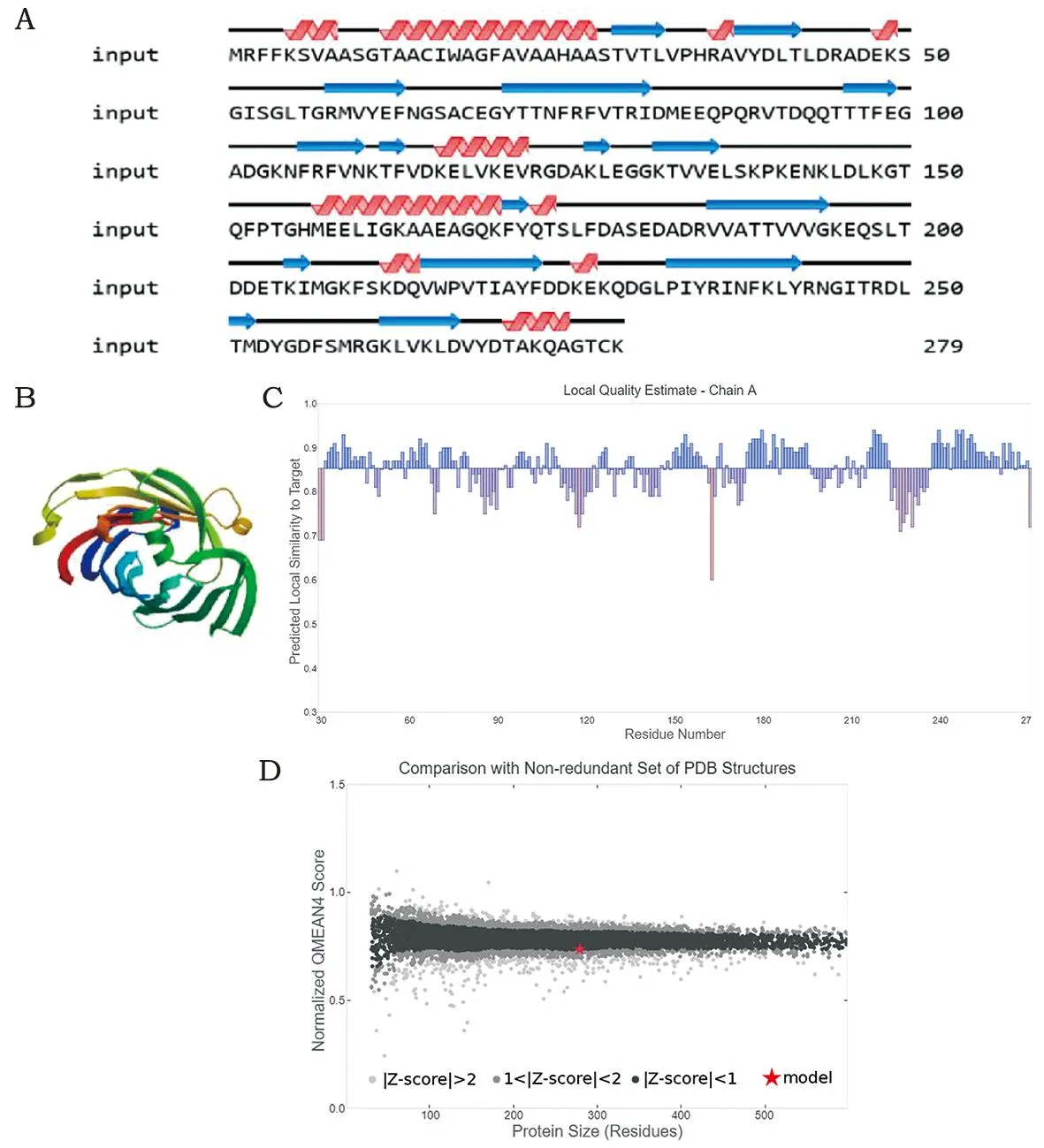
A:EipB蛋白质二级结构预测;B-D:EipB蛋白质三维结构示意图
2.4 EipB蛋白亲/疏水性预测 经过在线软件预测EipB蛋白含有较多的疏水结构域,位于40-52,80-93、98-108、111-148、157-167、177-186、192-213、223-232、244-254、256-275。含有多个亲水结构域,分布在5-39、53-79、149-156、168-176、187-191、214-221、233-243,这些部位是形成抗原表位的关键区域。该蛋白在第228位赖氨酸处取得最大值1.822,即该蛋白在此处疏水性最强;在第219个苏氨酸处取得最小值-1.544,即该蛋白在此处亲水性最强,见图3。
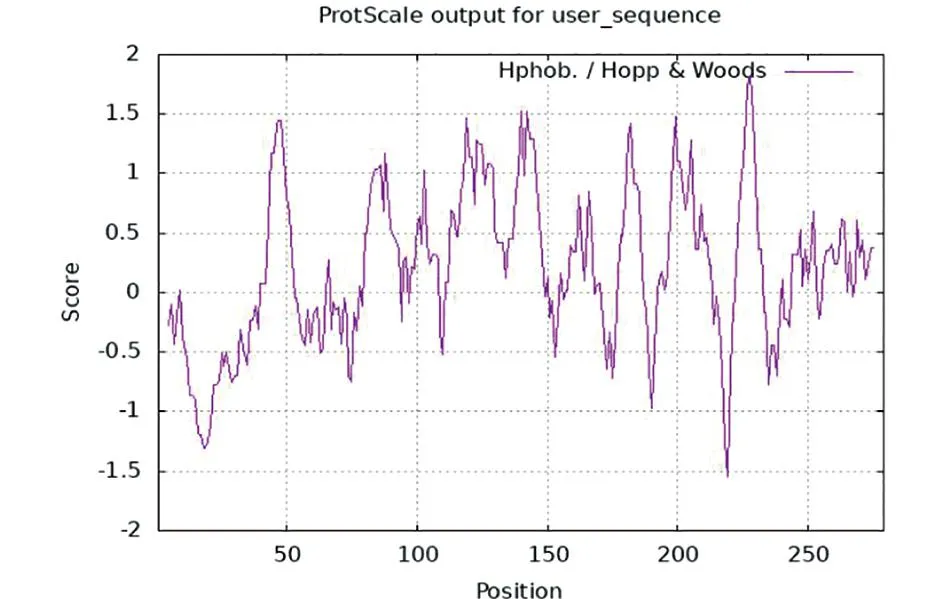
图3 EipB蛋白亲疏水性预测
2.5 EipB抗原表位的预测
2.5.1 EipB蛋白B细胞表位的预测 利用ABCpred在线数据库预测了阈值大于0.5且氨基酸长度位16aa的B细胞表位肽,总共有21条,所在氨基酸区域为54-60、243-259、77-93、121-137、174-190、158-174、64-80、230-246、202-218、148-164、91-107、133-149、13-29、35-51、168-184、98-114、194-210、257-273、23-39、250-266、112-128、185-201、224-240、83-99、263-279、105-121,结果见表2。

表2 EipB蛋白B细胞表位预测
2.5.2 CD4+T细胞表位的预测 使用在线预测网站SYFPEITHI预测EipB蛋白HLA-DRB1*0401限制性(15 aa)辅助性T细胞(helper T cell,Th)表位,筛选出预测分值>15的肽段,其序列见表3。

表3 EipB HLA-DRB1*0401限制性Th表位
2.5.3 CD8+T细胞表位的预测 利用在线预测网站SYFPEITHI预测EipB蛋白的HLA-A0201限制性(9 aa)细胞毒性T细胞(cytotoxic T cell,CTL)表位,筛选出预测分值>15的表位肽总共有39条,其序列见表4。
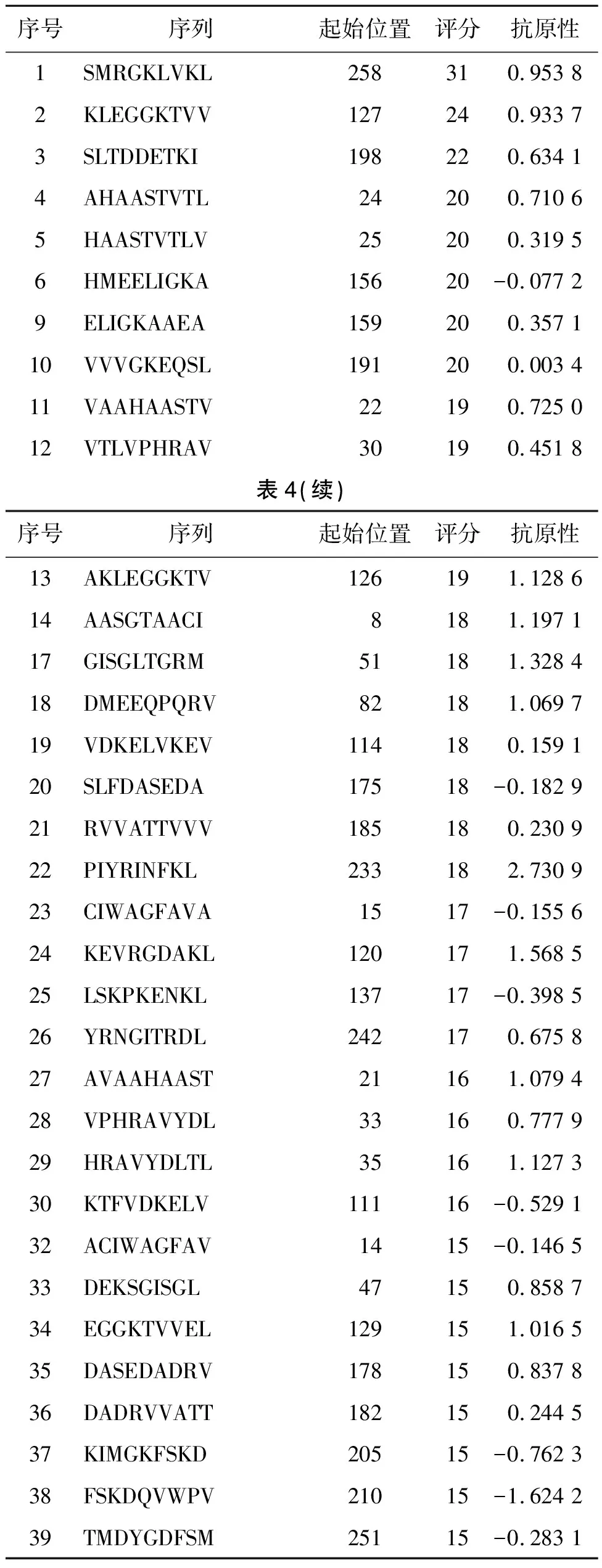
表4 EipB蛋白CD8+T细胞表位的预测
2.6 T-B联合表位诱导小鼠产生体液免疫应答水平 ELISA检测免疫小鼠血清中IgG、IgM、IgA及IgE抗体的变化,结果表明,PBS组、CpG组和KLH+CpG组免疫小鼠血清中无法检测到T-B联合细胞表位特异性抗体的含量;与PBS组相比,T-B+CpG组小鼠血清中IgG、IgM、IgA及IgE显著上升(PIgG=0.001,PIgM=0.001,PIgA=0.003,PIgE=0.004),见图4。

A:IgG抗体的变化;B:IgM抗体的变化;C:IgA抗体的变化;D:IgE抗体的变化。①P<0.05,②P<0.01,③P<0.005,④P<0.001,ns:P>0.05。
2.7 T-B联合表位诱导小鼠产生细胞免疫应答水平 给予各组淋巴细胞10 μg/mL T-B细胞表位肽刺激培养1 d,流式细胞术检测细胞因子的产生情况。结果表明,PBS组、CpG组和KLH+CpG组小鼠淋巴细胞给予T-B表位刺激,无法产生IFN-γ细胞因子;T-B+CpG免疫组小鼠给予T-B联合表位刺激后,IFN-γ表达显著上升(P=0.003),见图5。
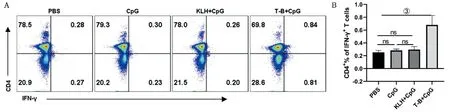
A:CD4+T产生IFN-γ的流式图;B:IFN-γ表达的变化。①P<0.05,②P<0.01,③P<0.005,④P<0.001,ns:P>0.05。
3 讨 论
布氏杆菌病是一种严重危害人类健康的人兽共患寄生虫病。临床上主要采用“三联”的方式治疗,该种治疗方式给患者带来了严重的副作用。免疫预防认为是控制传染病的有效方法[6]。目前已经发现的具有保护力的候选分子已有多种[7],但均未进入临床试验,因此亟待研发有效的布氏杆菌疫苗。EipB蛋白是细胞包膜完整性和毒力的分子决定因素。研究表明EipB的缺失会使布氏杆菌胞膜完整性遭到破坏,易于布氏杆菌感染。同时EipB蛋白参与维持布氏杆菌胞内稳态,为其提供一个相对稳定内环境[4-5]。
抗原表位是疫苗分子中发挥主要作用的功能基团,根据功能的不同分为能被TCR识别的T细胞表位和能够被BCR识别的B细胞表位[8-9]。抗原分子B细胞表位一般分布在亲水性较高且位于转角和无规则卷曲区域[10-11]。本研究利用ABCpred等软件预测了EipB蛋白含有21条B细胞优势表位肽。利用在线预测网站SYFPEITHI预测了EipB蛋白的细胞毒性抗原表位(CTL)细胞表位和CD4+T细胞表位,CTL细胞表位主要由人类白细胞抗原I类分子(HLA-I,主要为HLA-A0201)识别[12],总共有39条;CD4+T细胞表位主要是由人类白细胞抗原II类分子(HLA-II,主要为HLA-DRB1*0401和HLA-DRB1*0701)所识别,主要有56条。因此,预测蛋白T细胞表位时常综合分析HLA-A0201、HLA-DRB1*0401和HLA-DRB1*0701限制性表位。但是这些表位肽是否能够诱导机体产生免疫应答尚不明确。KLH是存在于节肢动物和软体动物血淋巴中的含铜蛋白[13],广泛的作为载体用于表位肽疫苗的研究。本研究选取了2条抗原性最高的抗原表位通过KLH进行连接,与CpG佐剂联用免疫小鼠,结果表明T-B免疫小鼠后能够诱导小鼠产生高水平的IgG、IgM、IgA以及IgE抗体,并能够诱导CD4+T细胞分泌IFN-γ细胞因子,这就表明T-B能够诱导小鼠产生体液和细胞免疫应答,这也为后续EipB表位肽疫苗的转化奠定基础。
细胞膜是细胞内外交换的通道,同时也维持细胞形态。EipB是布氏杆菌周质中发挥主要作用的蛋白质,其缺失能够使细胞膜完整性遭到破坏。但关于EipB作为疫苗候选分子的研究上鲜有报道。本研究拟利用生物信息学方法分析,预测EipB蛋白的抗原表位,选取2条抗原性较高的T、B抗原表位通过KLH进行连接,免疫小鼠后验证其免疫学效应,为研制基于EipB的布氏杆菌疫苗提供依据。
利益冲突:无

