结核分枝杆菌ESX-1分泌系统与宿主巨噬细胞相互作用的研究进展
余海燕,杨国平,2
作为人类结核病的主要致病病原体,结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)的强毒力和高致病性,严重威胁到人们的身体健康,当Mtb感染机体时,Mtb可通过分泌系统、分泌蛋白等与宿主树突状细胞(dendritic cell,DC)、巨噬细胞(Macrophages,Mø)等相互作用,并调节宿主细胞的免疫功能,介导Mtb在宿主细胞内的存活,引起疾病。ESX/T7SS 分泌系统,即Ⅶ型分泌系统作为Mtb的独有分泌系统通过一种接触依赖性机制裂解宿主细胞并分泌毒力因子[1],减弱Mø的炎症反应,阻止吞噬溶酶体的融合、成熟及酸化,抑制氧化应激反应和反应性氮中间产物的毒性效应,干扰Mø抗原呈递,抑制宿主Mø凋亡和自噬以逃避和破坏宿主免疫系统并在宿主Mø中持续存活。比较基因组学研究显示Mtb基因与减毒牛分枝杆菌卡介苗(BacillusCalmette-Guerin,BCG)相比,BCG基因组中缺失一种存在于Mtb的esx-1基因座[2],从Mtb中删除 esx-1基因座时其毒力会明显降低[3-5],将esx-1基因座转移到BCG 中时会恢复BCG的部分毒力[6-7],表明ESX-1分泌系统对Mtb的毒力至关重要。
ESX-1分泌系统除存在于Mtb中,亦存在于其他致病性和非致病性分枝杆菌种属中。在致病性海分枝杆菌(Mycobacteriummarinum,Mm)中,ESX-1的毒力因子可下调其感染的Mø中miR-147-3p[8],促进其在Mø内存活;还可介导吞噬体膜透化,影响Mø膜完整性,导致细胞外分枝杆菌DNA扩散到Mø胞质溶胶中,通过cGAS/STING 途径感知到杆菌,从而驱动I型干扰素(Interferon,IFN)的产生[9],促进分枝杆菌感染。研究还发现Mm ESX-1 负责将杆菌从吞噬溶酶体转移到Mø胞质溶胶[10],促进杆菌扩散。Mm ESX-1系统可以在体外促进红细胞(Erythrocyte/Red Blood Cell,RBC)裂解,引起溶血[11]。已有研究表明Mtb和非致病性耻垢分枝杆菌(Mycolicibacteriumsmegmatis,Ms)的差异区域1(region of difference-1,RD1)具有高度同源性,在功能上是等效的,ESX-1基因簇位于RD1区,可调节Ms的DNA转移[12]。
因此,我们就ESX-1分泌系统与宿主Mø相互作用的过程及机制进行综述,以期为Mtb的发病机制、临床治疗、疫苗研发靶点的寻找提供基础。
1 ESX-1分泌系统的组成
ESX分泌系统参与Mtb的毒力和致病过程,由ESX-1,ESX-2,ESX-3,ESX-4 和 ESX-5组成,且各系统相互独立存在,其中ESX-1分泌系统是Mtb中最重要及研究最多的蛋白分泌系统,负责Mtb侵入宿主细胞,调节机体防御系统,是Mtb发挥毒力作用的主要分泌系统。研究显示多种蛋白质参与ESX-1分泌系统的组成,包括Mtb中重要毒力因子即早期分泌抗原靶蛋白6(early secreted antigenic target of 6 kDa,ESAT-6)和培养滤液蛋白10(culture filtrate protein of 10 kDa,CFP-10),通过特殊的分泌机制作用在细菌表面,参与病原菌与宿主细胞的相互作用。对宿主细胞能产生较强的毒力作用和免疫调节作用的ESX-1分泌相关蛋白EspA、EspB、EspC、EspD、EspE、EspF、EspR和PE/PPE家族蛋白PE35、PPE68等,以及尚在研究中的其他ESX-1分泌相关蛋白EspM、EspJ、EspK、EspI。此外,5种膜相关的ESX-1保守核心成分 (EccB1、EccCa1、EccCb1、EccD1、EccE1) 及胞质辅助成分 (EspG1、EccA1和EspH)共同构成Mtb的跨细胞质膜通道,并通过几个保守的AAA ATPase结构域提供能量以将底物蛋白运输穿过细胞膜,发挥毒力作用和免疫调节作用。除这些成分之外,膜结合真菌蛋白酶MycP1可处理特定的ESX-1底物并稳定膜复合物,并调节具ESAT-6和CFP-10的分泌以平衡Mtb毒力,对维持Mtb感染至关重要。ESX-1分泌系统的组成见图1及表1。
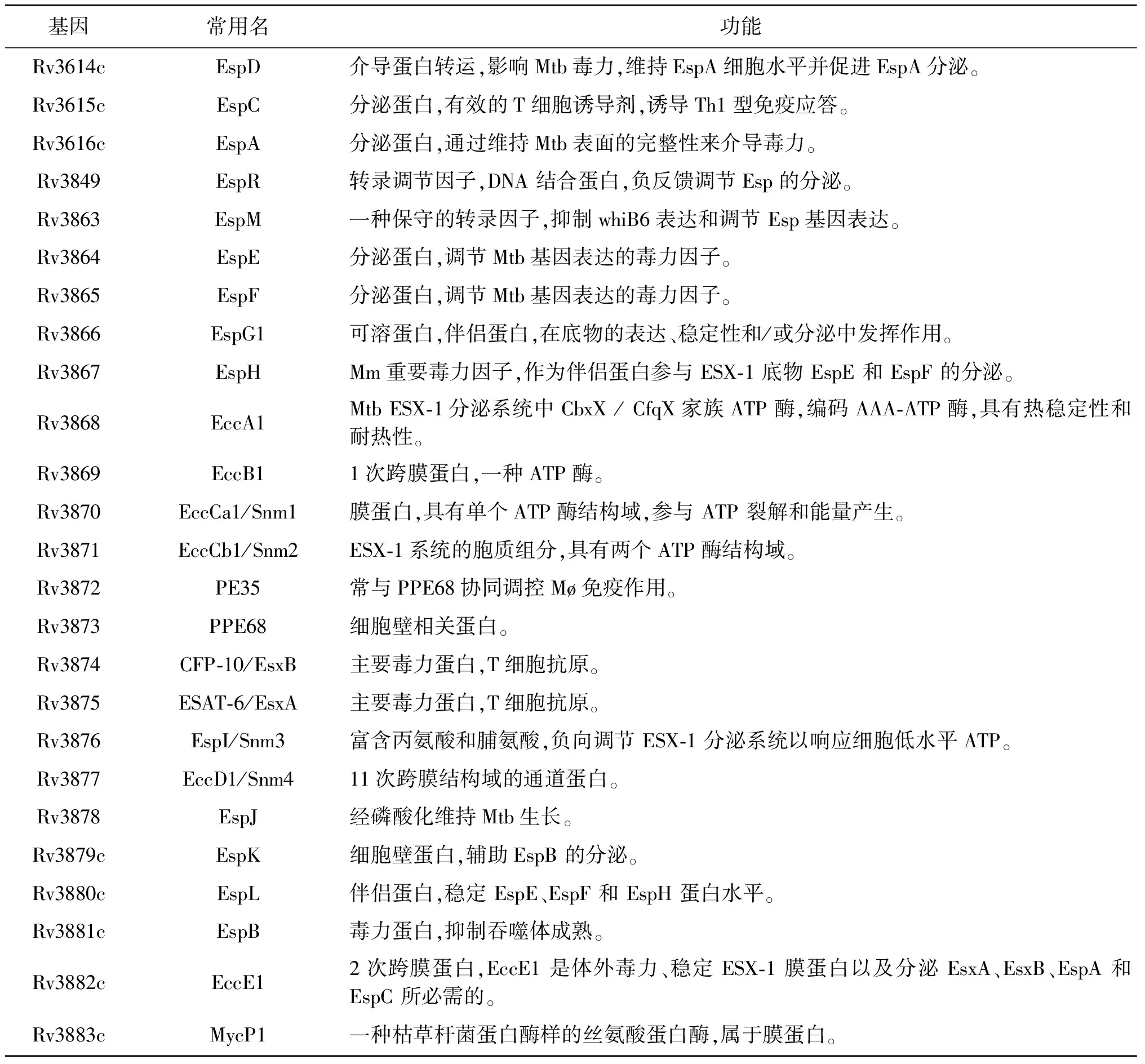
表1 Mtb的ESX-1分泌系统相关蛋白

图1 Mtb的ESX-1系统的基因结构
2 Mtb ESX-1分泌系统的分子机制
Mtb需要专门的分泌机制跨越内膜和外膜分泌毒力因子。其ESX-1分泌系统由EccB1、EccCa1、EccCb1、EccD1和EccE1 5个保守的核心膜成分组成膜蛋白和ESX-1分泌的核心组件,5个保守的核心成分在中心孔周围采用六聚体排列,组装成一个稳定的分泌孔复合物,推动ESX-1底物通过分泌通道[13]。通过寡聚体建模和ATP对接发现,EccB1可能是形成底物转运通道的六聚体ATP酶,通过水解ATP为ESX-1毒力因子转运提供能量,其N末端跨膜域可能参与跨质膜和菌膜通道的形成[14]。此外,EccB1具有细长的伪对称形状和连续的疏水性的核心参与其形成跨越 ESX 分泌系统内膜和外膜结构的一部分;EccC 是 FtsK/SpoIIIE 样 ATP 酶家族的成员,可为跨分枝杆菌膜转运蛋白质提供能量;EccD的C端紧密连接11 个跨膜螺旋,参与分泌底物蛋白的跨膜通道的形成[15]。研究表明EccB1、EccCa1、EccD1分别有1、3、11个转膜位点,可与含有ATP结合位点的细胞质蛋白EccCb1共同形成ESX-1分泌复合体,通过水解ATP产生能量驱动ESAT-6和CFP-10的易位,且EccD1也参与了CFP-10 的分泌[16]。
ESX-1中EccA1是具有AAA+ATP酶结构的胞质伴侣蛋白,能与EccB1、EccCa1、EccCb1相互作用促进ESAT-6和CFP-10蛋白的分泌。EspC的C端在 Mtb细胞包膜中形成丝状结构[17-18],可作为ESX-1分泌蛋白的分泌通道,介导相关蛋白的分泌。
Mtb的EspB可通过其N螺旋末端与其伴侣EspK的C末端结构域相互作用,以维持其分泌能力强的单体形式,并防止过早寡聚化[19],表明EspK可促进EspB的分泌。
Mtb反应调节的双组份系统PhoR/PhoP对Mtb ESX-1毒力因子分泌有着重要影响。研究发现Mtb的减毒株H37Ra的PhoP的C末端DNA结合域发生点突变导致ESAT-6分泌缺陷,将H37Rv PhoP引入H37Ra可恢复ESAT-6的分泌;PhoP-EspR-espACD调节回路参与调控ESAT-6的分泌,PhoP-EspR 蛋白质-蛋白质相互作用控制的 espACD 调节区的PhoP 和 EspR同时募集可促进 espACD 激活,进而调节 ESAT-6 分泌[20]。
3 Mtb ESX-1分泌系统的效应蛋白及功能
3.1 Mtb ESX-1分泌系统的毒力作用 ESX-1分泌系统作为Mtb发挥毒力作用的主要分泌系统,其毒力的发挥,需要多种蛋白的参与、介导及相互作用,主要包括ESAT-6、CFP-10、EspA、EspB、EspC、EspE、EspF等。
ESAT-6和CFP-10是Mtb 的ESX-1分泌系统最先发现的两种小分泌蛋白,是Mtb重要的毒力因子,对Mtb的毒力发挥和免疫调节起关键作用。研究发现ESAT-6可调节宿主细胞膜的离子通道,在酸性环境下(pH≤5)会发生构象转变并插入脂质体膜,进而导致细胞溶解[3],介导吞噬体损伤,还可通过抑制Mø活化、诱导Mø凋亡、抑制自噬体形成等干扰宿主细胞的免疫应答。对ESAT-6 结构分析表明 C末端的完整性是Mø吞噬体损伤,肉芽肿形成和介导毒力作用所必需[21]。已有研究证明ESAT-6 可能通过Toll样受体4-Trif(Toll-like receptor 4-Trif,TLR4-TRIF) 信号通路诱导Mø中 IFN-β 基因表达以促进Mtb感染[22]。ESAT-6还可通过激活STAT3诱导Mø产生白细胞介素6(interleukin 6,IL-6)[23],抑制1 型辅助 T(T helper type 1,Th1)细胞型保护性反应,介导Mtb毒力的发挥。
从图2(b)中的4幅图像可以看出:对于室内环境拍摄的油菜3种类型叶片图像和户外堪环境拍摄的叶片图像,本文方法不仅可以把主叶脉和部分侧叶脉提取出来,还可将叶面上的污点和虫咬痕迹同时分离出来(图2(b)第3幅图像圈出部分)。
EspA在分泌后可形成二硫键的同型聚体,二硫键形成对Mtb 的毒力必不可少,是Mtb 在宿主体内生存和致病所必需。研究发现EspA二硫键断裂不会影响ESX-1系统相关蛋白质分泌及Mtb诱导的IFN-β 反应和强烈CD4+和 CD8+T 细胞反应,但抑制EspA 二硫键形成则会破坏Mtb细胞壁完整性,使 Mtb 在动物和Mø中毒力明显减弱[24],研究还发现Mtb细胞壁结构被破坏会损害其与宿主细胞的界面,引起Mtb毒力降低,导致其在宿主体内存活能力也随之减弱,而Mtb的EspA 可通过维持Mtb表面完整性来介导毒力,这些研究表明EspA介导Mtb感染过程中的毒力作用。
EspB属于PE/PPE异二聚体家族,在Mtb 毒力和生长中发挥重要作用,也是MycP1靶点。研究发现EspB在Mtb感染的免疫逃避初始阶段发挥关键作用,可通过ESX-1分泌系统在细胞质蛋白EspK辅助下分泌到细胞质外,寡聚化后与宿主Mø的磷脂结合,在吞噬体内使膜溶解成孔[19,25],抑制吞噬体成熟,使Mø无法发挥先天性免疫调节作用,介导Mtb在宿主内成功存活。
EspC可提高Mtb对氧化应激的抵抗力增加其在Mø内的存活率[26],表明EspC可能是Mtb重要毒力因子,有利于Mtb在感染后的细胞间传播。MAPK 和 核因子κB(nuclear factor κB,NF-κB) 是调节先天免疫反应的两个主要免疫信号通路,Guo Q等人[27]通过将EspC过表达于Ms,并感染Mø和小鼠,发现EspC 是 Mtb ESX-1 系统的一个关键毒力因子,可通过MAPK/NF-κB 级联诱导促炎细胞因子分泌并触发ER应激介导细胞凋亡参与Mtb-Mø的相互作用,并增强杆菌在感染小鼠内生存能力,表明EspC在复杂的宿主-病原体相互作用中发挥重要的功能,在ESX-1 系统介导Mtb发病机制中的复杂性。
EspE和EspF是调节Mtb基因表达的毒力因子,在调节分枝杆菌ESX-1 基因表达和介导裂解活性中具有双重作用。Chirakos AE等人[28]的实验发现EspE 和EspF可通过调节转录因子WhiB6控制 ESX-1 底物产生水平,且EspE 和 EspF促进 ESX-1 系统的裂解活性是不依赖于EsxA 和 EsxB 底物,在没有 EspE 和 EspF 时,EsxA 和 EsxB 以及其他 ESX-1分泌的底物蛋白的膜裂解能力下降,该研究为 ESX-1 系统将裂解活性与蛋白质分泌和基因表达调控联系起来提供研究基础。
以上研究表明,Mtb入侵宿主细胞并引起致病与Mtb ESX-1分泌系统中的不同性质毒力因子、多种毒力蛋白的积累,进而破坏宿主免疫反应能力有关。对其研究有助于理解Mtb毒力蛋白的分泌机制及阐述Mtb入侵宿主、建立独特生态位并在宿主体内繁殖和扩散的致病机理,为寻找抗结核药物的作用靶点奠定基础。
3.2 Mtb ESX-1分泌系统的免疫调节作用 ESX-1分泌系统参与Mtb对宿主的感染、致病过程及分枝杆菌毒力的发挥。在感染过程中,ESX-1分泌系统的效应蛋白同时可激活或阻断宿主的固有免疫和适应性免疫反应,发挥免疫调节作用。
Mtb阻断Mø对 IFN-γ反应的能力是其为逃避细胞介导的免疫在宿主内存活的重要特征。EspB可降低小鼠ANA-1细胞表面IFN-γ受体的表达水平,抑制STAT1磷酸化,下调IFN-γ的分泌,EspB还可以剂量依赖性方式显著抑制ANA-1细胞中IFN-γ诱导的自噬形成,使Mtb可在宿主Mø中持续存在并成功逃避宿主免疫作用[35]。
EspC是一种具有高度免疫优势的 RD1依赖性分泌抗原及有效的 T 细胞诱导剂,含CD4+和CD8+表位,可诱导Th1型免疫应答[17],并且T 细胞对 EspC 反应表现出与对CFP-10和ESAT-6的反应一样,其特异性达93%。研究发现EspC可直接与TLR-4结合并触发依赖性丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路诱导Mø活化促进促炎细胞因子的分泌,从而激活先天免疫反应[26]。
EspL含115个氨基酸,可作为伴侣蛋白稳定EspE、EspF 和 EspH蛋白质的胞质水平。研究发现缺乏 EspL 的Mtb不能在Mø内复制[36],不分泌主要毒力因子EsxA,也不能引发ESX-1依赖性的先天免疫反应,EspL 缺失还可下调ESX-1 基因的氧化还原敏感转录激活因子WhiB6在Mtb中的表达。EsxL 还可通过与TLR2的相互作用激活NF-κB 的核转位来诱导肿瘤坏死因子-α (TNF-α) 产生[37],触发促炎反应。
EspR是一种负反馈调节蛋白,ESX-1 基因表达依赖于EspR的分泌,但当EspR分泌受阻时,ESX-1 基因转录反而增强,呈现出负反馈调节现象。EspR可下调分枝杆菌诱导的炎性细胞因子表达和抑制宿主Mø凋亡,使Mø抗菌活性减弱,增强Mtb的细胞内存活率,并通过与衔接蛋白MyD88相互作用,抑制TLR 和 IL-1R 介导的信号传导激活[38],阻断下游Mø炎症反应和凋亡。
PE/PPE家族蛋白PE35和PPE68,编码的基因在Mtb复合体RD1 基因座中保守且彼此相邻,PE35 是CFP-10 和 ESAT-6 表达所必需。PPE68 主要与细胞壁相关,与 RD1 基因座蛋白 Rv3866、Rv3868、CFP-10 和 ESAT-6 形成复合物。研究证明Mtb的 PPE68在感染早期促进宿主细胞坏死,有助于Mtb从Mø中逃逸[39]。PE35-PPE68 基因在Mtb中可协同操作,在Mtb对Mø的调控中具有重要的免疫调节作用。研究还发现单独或联合使用重组纯化PE35和PPE68蛋白能与TLR2结合诱导THP-1 细胞分泌抗炎细胞因子IL-10和趋化因子单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1),并降低促炎细胞因子IL-12水平[40]。PE35和PPE68诱导的MCP-2分泌还可用于区分活动性肺结核和潜伏性肺结核病人,在Mtb感染中显示出良好的诊断价值。
MycP1与ESX-5分泌系统的MycP5 共同维持ESX膜复合物的稳定,对Mtb的ESX-1 功能至关重要。研究发现,MycP1在Mtb感染Mø期间可过度激活 ESX-1 分泌,增强先天性免疫信号传导,却不会改变离体Mø中Mtb复制,MycP1 也是Mtb感染小鼠时的急性期间生长所必需[41];在调节 ESX-1 系统分泌活性方面发挥着双重作用,抑制其蛋白酶活性使ESX-1底物分泌增加。
Mtb作为胞内寄生菌,与宿主细胞的相互作用过程决定了Mtb感染的发生和结核病发展的建立。Mtb侵入宿主可激活其固有免疫反应,引起一系列的抗Mtb感染作用,然而Mtb可通过ESX-1系统效应蛋白调控及干预宿主免疫功能的发挥,从而逃避其免疫杀伤作用,实现其在宿主体内的长期存活。对Mtb ESX-1系统与宿主细胞间的动态免疫过程及调节机制的研究可为抗结核治疗、药物研发等提供新思路和特异性靶点。
3.3 Mtb ESX-1分泌系统在抗结核病药物靶标及疫苗靶抗原中的应用 Mtb的esx-1基因座位于RD-1区,在所有BCG菌株中缺失[42-43],Mtbesx-1基因区编码蛋白质诱导的免疫应答被认为可能会填补BCG诱导的保护性免疫的部分缺陷,表明Mtb ESX-1系统的分泌蛋白是抗结核药物靶标和疫苗靶抗原研发的潜在靶点。
目前已开发的基于ESAT-6和CFP-10的诊断试剂,是基于T细胞在体外用ESAT-6和CFP-10肽刺激并检测IFN-γ产生的阳性反应性,被用于识别潜伏性Mtb感染和活动性结核病患者,显示良好的应用前景。人类和动物 TB 模型实验表明ESAT-6 和 CFP-10 的疫苗制剂可保护宿主免受Mtb的攻击,被认为是潜在候选疫苗的抗原成分之一[44]。
Mtb的espB基因中存在高度保守的潜在G-四链体基序(potential G-quadruplex motifs,PGQs),研究发现用GQ稳定剂 TMPyP4处理Mtb可导致espB基因转录降低,EspB蛋白表达受到抑制将恢复吞噬体成熟过程并减少 CFP-10和ESAT-6分泌,进而成功向宿主免疫细胞呈递抗原,表明GQs在espB毒力基因表达和Mtb存活中具有抑制作用,可作为开发有效抗Mtb感染疗法的潜在药物靶标[45]。
espA-espC-espD基因簇的EspD蛋白在ESX-1介导蛋白转运和Mtb毒力中发挥作用,可调节毒力因子 ESAT-6、CFP-10分泌和Mtb感染肺实质组织损伤,并可维持细胞EspA水平和促进EsxA分泌[46]。编码espD蛋白的基因还是一种保守、特异性、稳定的基因,可作为开发活动性肺结核诊断的潜在特异性靶标及确定活动性肺结核病理过程的潜在生物标志物[47]。
胞质辅助成分EccA1是Mtb ESX-1分泌系统中CbxX/CfqX家族的ATP酶,对Mtb中EsxA分泌至关重要,具有热稳定性和耐热性,研究表明EccA1可通过与霉菌酸生物合成酶相互作用调节霉菌酸脂质合成[48],将致病性分枝杆菌的两个最重要的毒力机制即ESX-1 介导的分泌和疏水细胞包膜的合成联系在一起,是抗Mtb药物开发的靶点。
Mtb的多重耐药是全球公共卫生领域的重大威胁,疫苗接种是最有效的防控措施。筛选免疫优势抗原已被广泛应用于疫苗制备、药物研发和疾病诊断等多个领域。以上研究表明,深入了解Mtb的ESX-1 分泌系统,有助于发现具有良好抗Mtb活性的新靶点,为新型抗Mtb药物和疫苗提供思路,改善目前Mtb感染率不断上升的现状。
4 小结与展望
Mtb进入肺部建立自己的生态位,接触宿主后分泌多种毒力因子破坏宿主的防御系统,逃避宿主免疫反应,进而成功建立感染并扩散传播。Mtb ESX-1分泌系统是Mtb重要的分泌系统,通过分泌底物蛋白进入宿主Mø,干扰和调控宿主细胞的多方面功能,长期以来备受关注。本文简要总结ESX-1分泌系统的组成和分泌机制,重点描述该分泌系统所分泌的底物蛋白对Mø的调控作用。虽然在已有的研究中对ESX-1分泌系统分泌蛋白的组成、相关基因以及在分枝杆菌毒力上都进行了大量研究和突破,但仍有许多问题存在。
目前,基于EAST-6与CFP-10的减毒活疫苗MTBVAC正进行临床试验[49];含Ag85B-ESAT-6-Rv3620c融合蛋白的重组BCG在小鼠体内可诱导比BCG更强的Th1免疫反应和体液反应,具有成为结核病候选疫苗的潜在优势[50];含ESAT-6、CFP-10和Rv3615c三种优势抗原的诊断物在检测Mtb感染时具有比单独作为T细胞抗原的ESAT-6和CFP-10更高的灵敏度,可用于Mtb感染的诊断[51],表明Mtb ESX-1系统的分泌系统蛋白可为寻找新的治疗靶点提供思路。在未来的研究中,可通过对ESX-1分泌系统相关成分、识别机制、跨膜转运及其调控机制进行研究,寻找新的治疗靶点以干扰ESX-1分泌系统的功能,干扰细菌的毒力作用,对抗Mtb感染提供新的模式。
利益冲突:无

