汉黄芩素促进自身免疫性肝炎模型大鼠Th17/Treg细胞平衡
邓 娟,王秀芳,孙瑞青
空军军医大学第一附属医院 消化内科,陕西 西安 710032
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种复杂的免疫介导的肝病,患者大多数需要终身治疗,以防止肝硬化和终末期肝病的发展[1]。目前,关于AIH的治疗主要以糖皮质激素和硫唑嘌呤治疗,但治疗效果有限。汉黄芩素(wogonin,WG)是一种黄酮类物质,是从黄芩根(scutellarin radix)中分离得到的天然成分,是一种常用的用于过敏和癌辅助治疗的药材[2-3]。WG的抗氧化作用已在多种疾病中得到证实,特别是与炎性反应有关的疾病,如非酒精性脂肪性肝炎[4]。WG不仅能够激活小鼠肝细胞(AML12)中转录因子4(transcription factor 4,ATF4)-成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)表达,改善代谢性疾病,还能通过核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf 2)介导的核转录因子(kappa B,NF-κB)信号缓解脓毒症肝损伤[5-6]。AIH与自身免疫紊乱直接相关,辅助性T细胞17(Th17)和调节性T细胞(Treg)失衡会导致免疫系统紊乱促进AIH的发生[7]。Notch信号的持续失调会促进肝脏炎性反应和肿瘤发展产生[8]。下调Notch信号轴会促进肝卵圆细胞分化为肝细胞进而缓解肝损伤[9]。本研究旨在探究WG对AIH大鼠Th17/Treg细胞平衡和Notch信号通路的影响。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性SD大鼠(200~220 g)[贵州医科大学实验动物中心,生产许可证号:SCXK(黔)2018-0001]。本研究已获得本院动物伦理委员会的批准。
1.1.2 试剂及试剂盒:汉黄芩素(WG)(北京伊塔生物科技有限公司);伴刀豆球蛋白A(concanavalin A,ConA,上海源叶生物科技有限公司);Notch信号通路激活剂丙戊酸(valproic acid,VPA)(北京百奥莱博科技有限公司);丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒和肿瘤坏死因子-β(tumor necrosis factor-β,TNF-β)试剂盒[博辉生物科技(广州)有限公司];白介素10(interleukin 10,IL-10)试剂盒、白介素17(interleukin 17,IL-17)试剂盒和白介素-23(武汉伊莱瑞特生物科技股份有限公司);CD4-APC、IL-17-PE抗体、抗-类视黄酸相关孤儿受体γt(retinoid acid-related orphan receptor γ t,RORγt)、-叉头框蛋白P3(forkhead box protein P3,Foxp3)、-Notch、-hes家族bHLH转录因子1(hes family bHLH transcription factor 1 gene,HES1)和-含YRPW基序的bHLH转录因子hes相关家族1(hes related family bHLH transcription factor with YRPW motif 1,HEY1)抗体(Abcam公司)。
1.2 方法
1.2.1 大鼠的分组及处理: 随机选择10只大鼠作为对照组,其余大鼠参考先前文献[4],通过尾静脉注射ConA溶液12.5 mg/kg,每周1次,连续注射6周,构建AIH大鼠模型。随机选择5只大鼠根据HE染色情况判断造模是否成功,将造模成功大鼠随机分为AIH组、L-WG组、M-WG组、H-WG组和H-WG+丙戊酸(VPA)组,每组10只。L-WG组、M-WG组、H-WG组分别腹腔注射WG 10、20、30 mg/kg[10],每天1次,持续10 d。H-WG+VPA组在注射WG(30 mg/kg)的基础上,随后,注射300 mg/kg VPA[11],每天1次,持续10 d。AIH组和对照组给予等量0.9%氯化钠溶液。
1.2.2 采集标本: 药物治疗结束第2天,通过腹主动脉采血3 mL,经3 000 r/min离心10 min后取上清液,置于-20 ℃保存以备后续ELISA检测。麻醉后处死大鼠,分离肝脏和脾脏组织,一部分肝脏组织固定于4%多聚甲醛中用于HE染色和免疫组化,剩下的肝脏组织和脾脏组织储存于-80 ℃中用于Western blot和流式细胞测量术。
1.2.3 ELISA检测血清中炎性因子及肝功能: 取上述保存的血清,参照ELISA试剂盒步骤检测大鼠血清中肝功能指标(ALT和AST)以及炎性因子(IL-10、TNF-β、IL-17和IL-23)水平。
1.2.4 HE染色观察肝脏组织形态: 取4%多聚甲醛溶液中固定的肝脏组织,经过水洗、脱水、透明、浸蜡、包埋后切成4 μm薄片,随后将切片置于烤箱1 h,脱蜡、脱水后,用苏木精和伊红染色,在光学显微镜下观察肝脏组织形态。
1.2.5 流式细胞测量术检测脾脏Th17/Treg细胞水平: 分离脾脏组织的淋巴细胞,加入缓冲液细胞悬浮液,使每孔细胞浓度稀释到1×109细胞/L,与CD4-APC、IL-17-PE避光孵育20 min,用流式细胞仪检测Th17细胞数量,另外与CD4-APC、FOXP3-FITC避光孵育20 min,检测Treg细胞数量。
1.2.6 Western blot检测脾脏RORγt、Foxp3以及肝组织Notch信号通路蛋白表达 取-80 ℃保存的肝脏和脾脏组织,分别加入RIPA裂解缓冲液后提取总蛋白,将蛋白质进行定量、电泳、转膜,将膜于室温封闭3h后分别加入一抗:抗-RORγt(∶1 000)、-Foxp3(1∶1 000)、-Notch(1∶1 000)、-HES1(1∶1 000)、-HEY1(1∶2 000)和-GAPDH抗体(1∶1 000),于4 ℃孵育一夜,加入HRP标记的山羊抗兔二抗(1∶2 000),室温孵育3 h,加入ECL试剂使蛋白条带显影后。使用Image J软件分析蛋白的吸光度值。
1.3 统计学分析

2 结果
2.1 WG对大鼠血清ALT、AST活性的影响
与对照组相比,AIH组大鼠ALT、AST活性显著上升(P<0.05);与AIH组相比,L-WG组、M-WG组、H-WG组大鼠ALT、AST活性依次显著降低(P<0.05);与H-WG组相比,H-WG+VPA组大鼠ALT、AST活性显著增加(P<0.05)(表1)。

表1 WG对大鼠血清ALT、AST活性的影响Table 1 Effect of WG on serum ALT and AST activity
2.2 WG对大鼠血清炎性因子的影响
与对照组相比,AIH组大鼠IL-17和IL-23含量显著上升(P<0.05),IL-10和TNF-β含量显著下降(P<0.05);与AIH组相比,L-WG组、M-WG组、H-WG组大鼠IL-17和IL-23水平显著降低(P<0.05),IL-10和TNF-β水平显著上升(P<0.05);与H-WG组相比,H-WG+VPA组大鼠IL-17和IL-23含量显著增加(P<0.05),IL-10和TNF-β含量显著减少(P<0.05)(表2)。

表2 WG对大鼠血清炎性因子的影响Table 2 Effect of WG on aerum inflammatory factors in rats pg/mL, n=10)
2.3 WG对大鼠肝脏组织损伤的影响
对照组大鼠肝组织结构正常,染色清晰;AIH组大鼠肝组织细胞出现水肿,细胞体积增大导致肝窦受压变窄,出现炎性细胞浸润及少量细胞坏死现象。L-WG组、M-WG组、H-WG组改善了以上现象;H-WG+VPA组与AIH组结构相似(图1)。

AIH.autoimmune hepatitis; WG.wogonin; VPA.valproic acid; H-WG.30 mg/kg wogonin.图1 HE染色检测肝脏组织病理变化Fig 1 HE staining for pathological changes in liver tissue(×200)
2.4 WG对大鼠脾脏Th17/Treg 细胞水平的影响
与对照组相比,AIH组大鼠Th17细胞水平、Th17/Treg均显著上升(P<0.05),Treg细胞水平显著下降(P<0.05);与AIH组相比,L-WG组、M-WG组、H-WG组大鼠Th17细胞水平以及Th17/Treg依次显著降低(P<0.05),Treg细胞水平显著上升(P<0.05);与H-WG组相比,H-WG+VPA组大鼠Th17细胞水平、Th17/Treg比例显著增加(P<0.05),Treg细胞水平显著减小(P<0.05)(表3)。
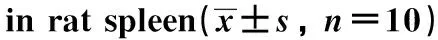
表3 WG对大鼠脾脏Th17/Treg 细胞水平的影响Table 3 Effect of WG on Th17/Treg cell levels
2.5 WG对大鼠脾脏中Foxp3、RORγt水平的影响
与对照组相比,AIH组大鼠RORγt水平显著上升(P<0.05),Foxp3水平显著下降(P<0.05);与AIH组相比,L-WG组、M-WG组、H-WG组大鼠RORγt水平依次显著下降(P<0.05),Foxp3水平依次显著升高(P<0.05);与H-WG组相比,H-WG+VPA组大鼠RORγt水平显著增加(P<0.05),Foxp3水平显著减少(P<0.05)(图2)。
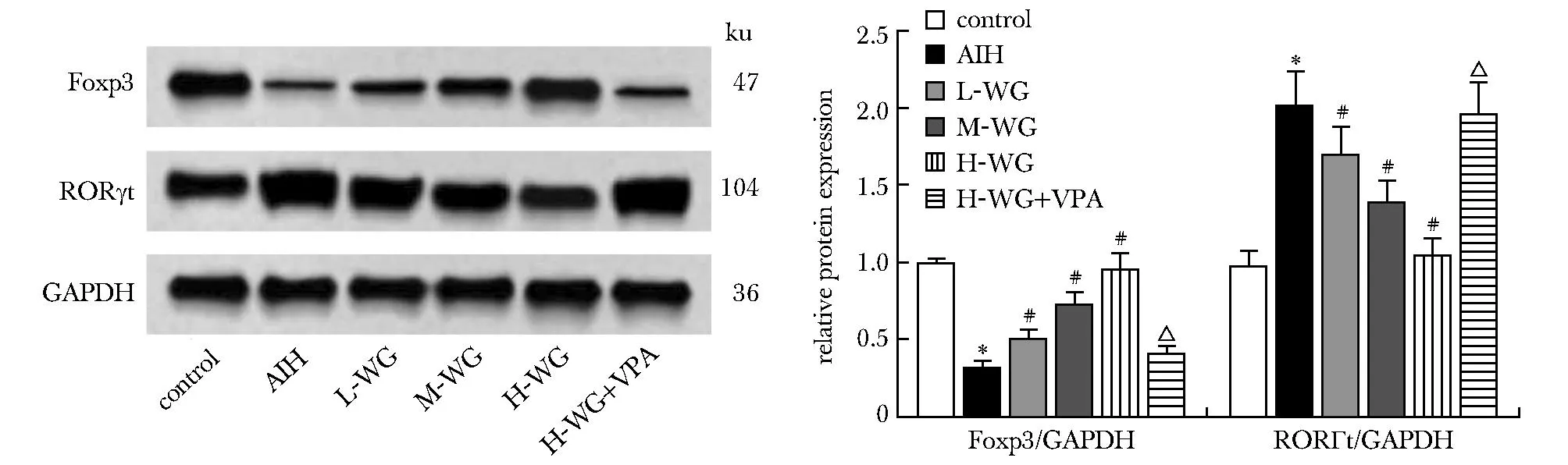
AIH.autoimmune hepatitis; L-WG.10 mg/kg wogonin; M-WG.20 mg/kg wogonin; H-WG.30 mg/kg wogonin; VPA.valproic acid; *P<0.05 compared with control; #P<0.05 compared with AIH; △P<0.05 compared with H-WG.图2 WG对大鼠肝中Foxp3、RORγt水平的影响Fig 2 Effect of WG on Foxp3 and RORγt levels in rat n=10)
2.6 WG对大鼠肝组织Notch信号通路蛋白表达的影响
与对照组相比,AIH组大鼠Notch、HES1、HEY1蛋白表达均显著上调(P<0.05);与AIH组相比,L-WG组、M-WG组、H-WG组大鼠Notch、HES1、HEY1蛋白表达依次显著降低(P<0.05);与H-WG组相比,H-WG+VPA组大鼠Notch、HES1、HEY1蛋白表达显著增加(P<0.05)(图3)。
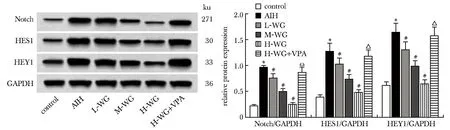
AIH.autoimmune hepatitis; L-WG.10 mg/kg wogonin; M-WG.20 mg/kg wogonin; H-WG.30 mg/kg wogonin; VPA.valproic acid; *P<0.05 compared with control; #P<0.05 compared with AIH; △P<0.05 compared with H-WG.图3 WG对大鼠肝组织Notch、HES1、HEY1蛋白表达的影响Fig 3 Effect of WG on Notch, HES1, and HEY1 protein expression in rat liver n=10)
3 讨论
AIH是一种病因不明的慢性进行性肝病,全球AIH患病率呈上升趋势,特别是在男性中。AIH会导致肝硬化和相关并发症,甚至有发展为肝细胞癌的风险[12]。因此,寻找AIH的潜在治疗药物极其重要。WG可通过调节肝星状细胞的活化和凋亡来减轻肝纤维化,成为治疗和预防肝慢性炎性的潜在药物[13]。WG可以改善氧化应激和炎性反应,从而成为缓解败血症肝损伤的潜在治疗剂[4]。本研究发现,AIH组大鼠肝组织出现明显的病理损伤,同时ALT、AST活性升高,与既往研究[14]一致,表明AIH大鼠造模成功;不同剂量WG的干预不仅改善了肝脏病理损伤现象,还降低了ALT、AST活性,表明WG尤其是高剂量(30 mg/kg)WG可减轻肝损伤,提示WG可能是AIH的潜在治疗靶点。
Th17细胞在多种免疫性疾病中发挥促炎作用,而Treg细胞是维持免疫稳态和诱导免疫耐受的关键因子,Th17/Treg失衡促进了AIH的发生[8]。Th17细胞可以通过产生促炎因子(IL-17、IL-22和IL-23),募集中性粒细胞,进而加重炎性反应;而Treg细胞可以通过产生抗炎因子(IL-10和TGF-β),维持免疫稳态。RORγt与Foxp3分别是Th17细胞和Treg细胞的转录调控因子[15]。本研究发现,WG可通过调节炎性因子水平促进AIH大鼠Th17/Treg平衡。
Notch激活会破坏肝脏稳态,加重小鼠肝纤维化[16]。下调Notch、HES1、HEY1表达可以抑制肝癌的发展[17]。下调Notch信号轴会恢复Th17/Treg平衡进而缓解大鼠自身免疫性葡萄膜炎[18]。在本研究中,Notch、HES1、HEY1蛋白高表达,与相关报道[19]相似,提示AIH大鼠中Notch信号通路处于激活状态;而WG治疗后Notch、HES1、HEY1蛋白水平下降,提示WG可通过下调Notch信号通路,促进Th17/Treg平衡,减轻AIH大鼠肝损伤。为了进一步证实此推测,在H-WG治疗的基础上,注射Notch信号通路激活剂VPA,结果发现VPA可消除H-WG对AIH大鼠肝损伤的治疗作用。
综上所述,WG可能通过下调Notch信号轴来维持Th17/Treg平衡,进而改善AIH大鼠肝脏损伤。且WG治疗效果呈剂量依赖性。然而,WG是否可以通过调控其他通过起到同样缓解肝损伤的效果需要进一步探究。

