LncRNA FEZF1-AS1通过调控EZH2对肺间质细胞增殖、迁移及侵袭的作用
王春燕,王 萍,宋龙飞,刘永全*,满 君*
1.潍坊医学院 临床医学院,山东 潍坊 261035;潍坊医学院附属医院 2.呼吸内科;3.康复医学科,山东 潍坊 261035
特发性肺间质纤维化(idiopathic pulmonary fibrosis, IPF) 是一种病因不明的慢性进行性疾病,以呼吸困难和肺功能进行性恶化为特征,预后差。目前研究认为IPF发病机制主要与上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)有关,EMT指上皮细胞在形态学上发生成纤维细胞表型的转变,细胞极性消失,迁移和侵袭能力增加的现象[1]。长链非编码RNA(long non-coding RNA, lncRNAs)是一类长度超过200 nt的非编码RNA,可通过多种机制调节靶基因的表达[2]。长链非编码RNA FEZ家族锌指1-反义 RNA 1(lnRNA FEZ family zinc finger 1 antisense RNA 1,lncRNA FEZF1-AS1)在肿瘤的发生和进展中发挥着重要作用,研究发现lncRNA FEZF1-AS1通过调控细胞EMT过程相关的多种信号通路参与直肠癌、前列腺癌、胶质母细胞瘤等疾病的病理过程[3-4]。然而lncRNA FEZF1-AS1与肺间质纤维化的相关研究较少,本研究探讨了lncRNA FEZF1-AS1调控zeste基因增强子同源物2(enhancer of zeste homolog2, EZH2)在IPF中作用机制,为其治疗提供了依据。
1 材料与方法
1.1 材料
1.1.1 细胞:人肺腺癌细胞系(human lung adenocarcinoma cell line)A549(上海富衡生物科技有限公司)。
1.1.2 主要试剂:转化生长因子β1(TGF-β1)(CA59,上海近岸生物科技有限公司);DMEM/F12液体培养基(HyClone公司);胎牛血清(赛默飞世尔科技中国有限公司);CCK-8检测试剂盒(CK04,日本DoJinDo公司);Trizol和real-time PCR试剂盒(北京全式金生物技术股份有限公司);引物合成(上海捷瑞生物工程有限公司);FastKing cDNA第一链合成试剂盒、RIP试剂盒(广州白薇生物科技有限公司);Si lncRNA FEZF1-AS1转染质粒和si NC(对照)转染质粒(广州市锐博生物科技有限公司);OE(过表达) EZH2转染质粒及OE vector对照转染质粒(湖南优宝生物科技有限公司);Lipo6000TM转染试剂、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)、EZH2及GAPDH抗体(Proteintech公司);HRP偶联的二抗(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:将A549细胞分为对照组(control)和肺间质纤维化模型组(model,20 ng/mL TGF-β1作用48 h)。转染组细胞分为转染si NC组、si lncRNA FEZF1-AS1+OE vector组及si lncRNA FEZF1-AS1+OE EZH2 组,每孔细胞转染量约为3×105,转染后立即加入TGF-β1,48 h后用于后续实验。
1.2.2 RT-qPCR检测lncRNA FEZF1-AS1和EZH2 mRNA的表达水平:用Trizol试剂根据试剂盒说明从细胞中提取总RNA,按试剂盒说明书操作反转录成cDNA,按试剂盒说明进行RT-qPCR反应,反应条件为95 ℃ 10 min;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。记录Ct值,采用2-△△Ct进行相对定量分析,以GAPDH作为内参计算lncRNA FEZF1-AS1 mRNA和EZH2的表达量。引物序列(表1)。

表1 RT-qPCR 引物序列Table 1 primer sequences of RT-qPCR
1.2.3 CCK-8法检测细胞增殖:将细胞调整至4×104cells/mL,100 μL/well接种于96孔板,12 h后进行转染,同时加入TGF-β1 20 ng/mL,放置在培养箱中培养,在培养0、24和48 h时每孔加入10 μL CCK-8溶液并在培养箱中孵育4 h,使用酶标仪测定450 nm波长下各孔检测的吸光度值。
1.2.4 划痕实验检测细胞迁移:将细胞悬液接种到6孔板中,细胞增殖至铺满孔底后,用 10 μL的无菌微量移液器吸头垂直在消毒后在细胞板上划痕,并将细胞洗涤3 遍,充分洗去漂洗细胞,加入无血清培养基,CO2培养箱中继续培养。倒置显微镜下观察并拍照记录0 h,48 h的划痕面积。划痕愈合率(%)=(0 h划痕面积-48 h划痕面积)/0 h划痕面积。
1.2.5 Transwell小室法检测细胞侵袭:制备细胞悬液,将细胞种入Transwell小室中,调整细胞浓度为2×105/mL,每组细胞数量为1×104个/well。配置Transwell上室液和下室液:上室加无血清培养基,下室是TGF-β 20 ng/mL含血清完全培养基,上室液每孔200 μL,下室液每孔800 μL。将上层小室放入下层小室,细胞计数后将细胞铺在上层小室中。细胞培养箱中培养48 h后,取出上室,用棉签擦去上室底部膜表面上的细胞,PBS缓冲液洗涤后置于800 μL甲醇中固定10 min,采用吉姆萨染色液染细胞,荧光倒置显微镜计数、拍照。
1.2.6 Western blot检测细胞中E-cadherin、N-cadherin、波形蛋白的表达:裂解液裂解每组细胞,于4 ℃下12 000 r/min离心15 min,提取细胞蛋白质,试剂盒测定蛋白质浓度,加入蛋白质上样缓冲液煮沸5 min,放于-80 ℃保存。SDS-PAGE电泳分离后,用湿转法转到PVDF膜,加入一抗4 ℃孵育过夜,TBST充分洗涤PVDF膜后加入二抗37 ℃摇床孵育2 h。TBST洗涤后加入ECL显影,用Image J软件进行吸光度值分析,GAPDH作为内参蛋白,计算目的蛋白表达量。目的蛋白质表达量=目的蛋白质条带吸光度值/GAPDH条带吸光度值。
1.2.7 RNA免疫沉淀(RNA imunoprecipitation,RIP)检测lncRNA FEZF1-AS1与EZH2 相互结合:根据RIP试剂盒说明进行RIP测定。将细胞在RIP裂解缓冲液中裂解,并与EZH2抗体(anti-EZH2)偶联的磁珠或对照组免疫球蛋白G抗体(anti-IgG)在4 ℃条件下孵育过夜。利用特异引物对提取的RNA进行RT-qPCR分析,以此方法检测FEZF1-AS1的丰度。
1.3 统计学分析

2 结果
2.1 模型组细胞E-cadherin、N-cadherin、波形蛋白的表达
模型组(model)细胞中N-cadherin的蛋白和波形蛋白相对表达量高于对照组细胞(P<0.05);而模型组细胞中E-cadherin蛋白相对表达量低于对照组细胞(P<0.05)(图1,表2)。

图1 对照组和模型组细胞E-cadherin、N-cadherin、波形蛋白的表达Fig 1 Expression of E-cadherin, N-cadherin and vimentin in control group and model group
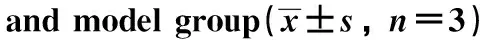
表2 对照组与模型组细胞E-cadherin、N-cadherin、波形蛋白表达水平的比较Table 2 Comparison of expression of E-cadherin, N-cadherin and vimentin in control group
2.2 模型组细胞lncRNA FEZF1-AS1、EZH2 mRNA的表达
模型组细胞lncRNA FEZF1-AS1和EZH2 mRNA的表达高于对照组(图2)。

*P<0.05 compared with control group.图2 对照组和模型组细胞lncRNA FEZF1-AS1、EZH2 mRNA的表达Fig 2 Expression of lncRNA FEZF1-AS1 and EZH2 mRNA in control group and model group
2.3 CCK-8法实验检测细胞增殖
与对照组细胞相比,si NC组细胞增殖明显升高(P<0.05);与si NC组细胞相比,si lncRNA FEZF1-AS1+OE vector组细胞增殖明显降低(P<0.05);与si lncRNA FEZF1-AS1+OE vector组细胞相比,si lncRNA FEZF1-AS1+OE EZH2组细胞增殖明显升高(P<0.05)(图3)。
*P<0.05 compared with control;#P<0.05 compared with si NC;△P<0.05 compared with si FEZF1-AS1+OE vector.图3 各组细胞增殖比较Fig 3 Comparison of cell proliferation in each group
2.4 细胞迁移实验
与对照组细胞相比,si NC组细胞迁移能力升高(P<0.05);与si NC组细胞相比,si lncRNA FEZF1-AS1+OE vector组细胞迁移能力降低(P<0.05);si lncRNA FEZF1-AS1+OE vector组细胞相比,si lncRNA FEZF1-AS1+OE EZH2组细胞迁移能力升高(P<0.05)(图4,5)。

图4 各组中细胞划痕愈合的比较Fig 4 Comparison of cell scratch healing in each group (×100)
2.5 Transwell小室法实验
与对照组细胞相比,si NC组细胞侵袭升高(P<0.05);与si NC组细胞相比,si lncRNA FEZF1-AS1+OE vector组细胞侵袭降低(P<0.05);与si lncRNA FEZF1-AS1+OE vector组细胞相比,si lncRNA FEZF1-AS1+OE EZH2组细胞侵袭升高(P<0.05)(图6,7)。

图6 各组中细胞侵袭的比较(结晶紫染色)Fig 6 Comparison of cell invasion in each group (crystal violet staining, ×100)
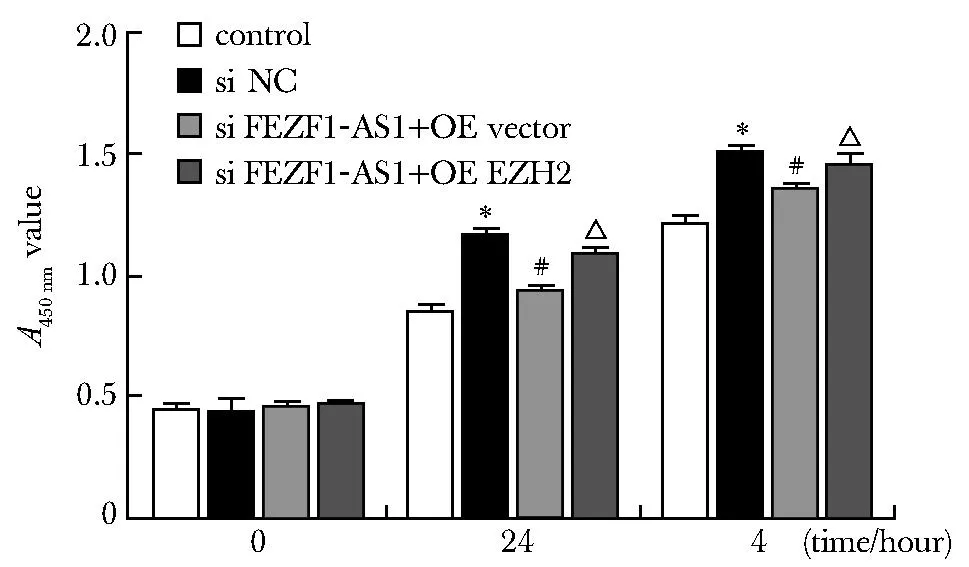
2.6 肺间质纤维化相关蛋白的表达
Si FEZF1-AS1+OE vector组E-cadherin的蛋白表达高于si NC组(P<0.05);Si FEZF1-AS1+OE EZH2组E-cadherin的蛋白表达低于si FEZF1-AS1+OE vector (P<0.05); Si FEZF1-AS1+OE vector组组N-cadherin、vimentin的蛋白表达低于si NC组(P<0.05);Si FEZF1-AS1+OE EZH2组N-cadherin、vimentin的蛋白表达高于si FEZF1-AS1+OE vector组(P<0.05)(图8)。
*P<0.05 compared with control group;#P<0.05 compared with si NC group;△P<0.05 compared with si FEZF1-AS1+OE vector group.图8 各组肺间质纤维化相关蛋白质的表达Fig 8 Expression of fibrosis related proteins in each n=3)
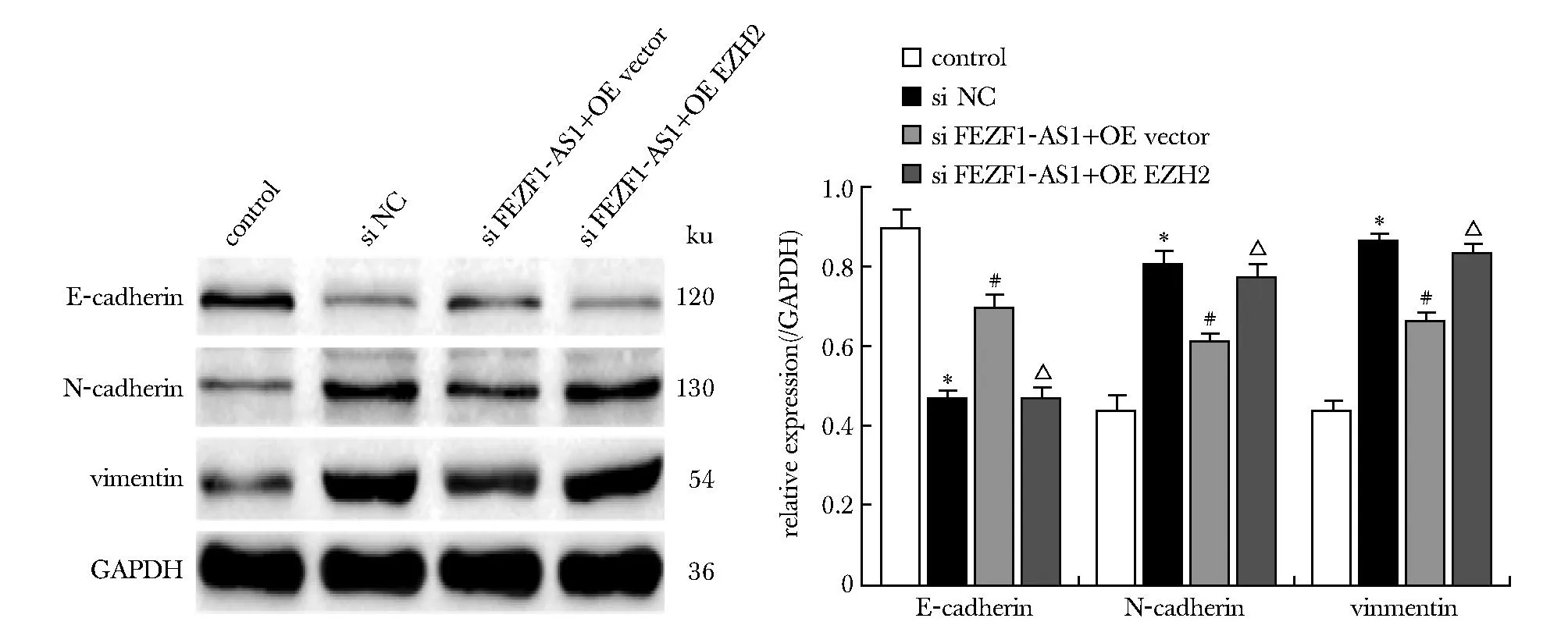
2.7 EZH2蛋白的表达
Si lncRNA FEZF1-AS1+OE vector组EZH2的蛋白表达低于si NC组(P<0.05);Si lncRNA FEZF1-AS1+OE EZH2组EZH2的蛋白表达高于si lncRNA FEZF1-AS1+OE vector组(P<0.05)(图9)。
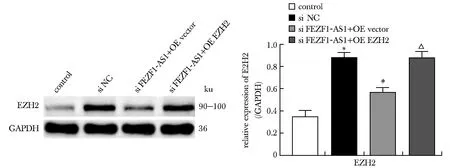
*P<0.05 compared with control group;#P<0.05 compared with si NC group;△P<0.05 compared with si FEZF1-AS1+OE vector group.图9 各组EZH2蛋白的表达Fig 9 Expression of EZH2 protein in each n=3)
2.8 RNA免疫沉淀(RIP)测定
RIP实验结果表明,EZH2抗体lncRNA FEZF1-AS1丰度(6.71±0.17)显著高于对照组丰度(0.07±0.001)(P<0.05),表明了lncRNA FEZF1-AS1与蛋白EZH2具有直接结合作用。
3 讨论
迄今研究认为IPF发病机制主要与EMT有关,TGF-β1诱导因子可通过多种信号通路调节EMT,该方法是目前IPF细胞造模中较为成熟的造模方法。LncRNA由于其广泛的生物调控功能,引起了国内外的广泛关注[5-6]。近年来不断有研究报道,lncRNA在IPF中发挥重要作用,LINC00941/lncIAPF依赖ELAVL1/HuR通路阻断自噬,促进成纤维细胞向肌成纤维细胞转化,从而加速肺纤维化[7]。LncRNA CTD-2528L19.6通过介导纤维化相关基因的表达,促进成纤维细胞向肌成纤维细胞的转变[8]。LncRNA GAS5通过促进KDM5B介导的H3K4me2/3去甲基化抑制PDGFRα/β在IPF中的表达,从而抑制肺间质纤维化的形成[9]。SNHG16通过靶向miR-455-3p调节Notch2通路从而促进肺纤维化[10]。目前研究发现lncRNA FEZF1-AS1在多种肿瘤的EMT过程中发挥着关键作用[11],但lncRNA FEZF1-AS1在肺间质纤维化中的作用研究较少。本研究首次发现lncRNA FEZF1-AS1通过调控EZH2从而促进EMT过程和肺间质细胞增殖、侵袭和转移。
EMT的典型特征是E-cadherin蛋白的抑制导致细胞黏附特性的丧失和间质标志物的获得,如N-cadherin、vimentin、fibronectin蛋白等,这些标志物使细胞黏附能力减弱,侵袭、迁移能力增强。E-cadherin是典型的上皮细胞标志物,介导细胞间的黏附,当E-cadherin表达减少时,细胞间的黏附作用减弱,导致上皮样细胞向间充质样细胞转化,本研究结果也显示了肺间质细胞中lncRNA FEZF1-AS1通过调控EZH2抑制E-cadherin的表达。N-cadherin和vimentin 是间质细胞的重要标志物, 促进细胞黏附和转移,本研究结果证实了lncRNA FEZF1-AS1通过调控EZH2促进N-cadherin、vimentin的表达,因此本研究结果表明了lncRNA FEZF1-AS1通过调控EZH2促进IPF中EMT的发生。
LncRNAs主要通过与蛋白相互作用以及作为microRNAs的海绵,在多种疾病的发病机制中发挥重要作用。LncDACH1通过与基因SRSF1相互作用抑制CTNNB1的积累从而抑制肺纤维化,表明了lncDACH1可能是肺纤维化的潜在治疗靶点[12]。研究发现lncRNA TUG1与CDC27相互作用,lncRNA TUG1的下调通过降低CDC27的表达和抑制PI3K/Akt/mTOR通路来改善肺纤维化[13]。本研究发现lncRNA FEZF1-AS1的下调通过抑制EZH2的表达抑制EMT,从而减轻IPF的进展,且进一步采用RIP实验证实了lncRNA FEZF1-AS1与EZH2具有结合作用。
综上所述,本研究证明了lncRNA FEZF1-AS1通过与EZH2蛋白相互结合促进EMT过程使肺间质细胞具有增殖、侵袭、转移能力。

