miR-139-5p增强二甲双胍抑制正常糖培养下人胰腺癌细胞系PANC-1增殖
余 洁,马明磊,张化冰,平 凡,李 伟,许岭翎,李玉秀*
1.中国医学科学院 北京协和医学院 北京协和医院 内分泌科 国家卫生健康委员会内分泌重点实验室,北京 100730;2.首都医科大学附属北京世纪坛医院 内分泌科,北京 100038
胰腺癌(pancreatic cancer)是一种高度恶性的肿瘤,90%的患者在被发现时已经发生了转移。转移主要发生在胰周和腹腔脏器,导致中晚期病情较为严重,预后非常不好[1]。
据流行病学研究显示,与非糖尿病患者相比,糖尿病患者的肿瘤发生更为普遍[2]。在糖尿病或糖尿病前期人群中,患胰腺癌的相对风险在1.6至2.8之间[3]。一项荟萃分析表明,空腹血糖每升高0.56 mmol/L,患胰腺癌的风险就会增加14%[4]。 二甲双胍(metformin,Met)作为一种降糖药物,近年来越来越多的研究证明它还具有抗肿瘤的潜能[5],然而,不同的葡萄糖水平是否会影响其抗肿瘤作用,结论尚不统一。此外,研究发现二甲双胍可能通过调控微RNAs(microRNAs,miRNAs)表达抑制胰腺癌细胞增殖[6],而一些研究发现miR-139-5p具有抑制细胞增殖的作用[7]。但是,二甲双胍的抗肿瘤作用是否与miR-139-5p相关目前尚无研究报道。
1 材料与方法
1.1 材料
1.1.1 细胞系:人胰腺癌细胞系PANC-1(中国科学院典型培养物保藏委员会细胞库)。
1.1.2 试剂(盒):EdU细胞增殖检测试剂盒、TUNEL试剂盒、DAPI染色液(广州锐博生物技术有限公司);反转录试剂盒、荧光定量PCR试剂盒(Qiagen公司)。
1.2 实验方法
1.2.1 培养细胞:将细胞置于含有25 mmol/L葡萄糖[高糖(high-glucose,HG)组]或5 mmol/L葡萄糖[正常糖(normal-glucose,NG)组]+10%胎牛血清的DMEM培养基中,并在含有5% CO2的37 ℃恒温培养箱中培养。分别加入不同浓度的二甲双胍(0、5、10、20 mmol/L)处理细胞48 h,对细胞的增殖、凋亡、迁移及细胞周期进行检测。重复样本数n=3。
1.2.2 转染siRNA:使用LipofectamineTM3000对细胞进行miR-139-5p模拟物和阴性对照转染。
1.2.3 EdU法检测细胞增殖:取对数生长期的PANC-1细胞,以5×107个/L细胞的浓度接种于96孔板中。24 h后,分别加入不同浓度的二甲双胍(0、5、10、20 mmol/L)处理细胞48 h。接着,使用EdU细胞增殖检测试剂盒来检测细胞的增殖情况。通过使用Acumen X3细胞仪进行图像采集,并且用增殖细胞数除以总细胞数计算出细胞增殖率。
1.2.4 TUNEL检测细胞凋亡:取对数期的PANC-1细胞,以5×107个/L的浓度在96孔板中接种。24 h后,分别加或不加二甲双胍(0/5/10/20 mmol/L)处理48 h。采用TUNEL试剂盒鉴定凋亡细胞中的DNA片段。用Acumen X3细胞仪进行图像采集,用凋亡细胞数除以总细胞数计算细胞凋亡率。
1.2.5 划痕实验检测细胞迁移:将对数生长的PANC-1细胞以浓度5×107个/L接种在带有OrisTM细胞接种限位塞的96孔板(Platypus Technologies)中。利用OrisTM塞子工具谨慎移除硅胶塞子,在板中心创建了一个大约2 mm直径的无细胞区。经过48 h的二甲双胍(浓度为0/5/10/20 mmol/L)处理,使用DAPI染色,Acumen X3细胞仪进行检测。中心的无细胞区域将被从周边区域迁移过来的细胞所填充,体现细胞的迁移能力。
1.2.6 细胞周期的检测:将对数期的PANC-1细胞用胰蛋白酶进行消化,调整到浓度为5×107个/L,接种在96孔板中。进行二甲双胍处理(浓度分别为0/5/10/20 mmol/L),持续48 h。使用DAPI染色法来检测细胞的周期,并通过Acumen X3细胞仪来分析并计算出处于各个细胞周期的细胞的比例。
1.2.7 RT-qPCR定量检测miR-139-5p的表达:使用反转录试剂盒进行cDNA合成,利用荧光定量PCR试剂盒进行RT-qPCR检测。选择小RNAU6作为内参,引物序列如下:miR-139-5p(forward primer):5′-AATAGTAGCCCCTGCCCACC-3′,U6(forward primer):5′-AATAGTAGCCCCTGCCCACC-3′。
1.3 统计学分析
2 结果
2.1 二甲双胍可抑制PANC-1细胞增殖、促进细胞凋亡、抑制细胞迁移,诱导S期和G2/M期阻滞
PANC-1细胞在NG和HG培养环境下,5 mmol/L及以上浓度的二甲双胍均能抑制其生长(P<0.05)(图1A),10 mmol/L及以上浓度的二甲双胍均能促进其凋亡(P<0.01)(图1B),这种作用在NG培养条件下更为显著,高剂量的二甲双胍(10或20 mmol/L)几乎能完全抑制PANC-1细胞的生长,并能导致80%~95%的细胞凋亡(P<0.001)(图1D~E,G)。然而,仅在HG培养条件下中,10 mmol/L及以上浓度的二甲双胍可抑制PANC-1细胞的迁移(P<0.05)(图1C,H)。
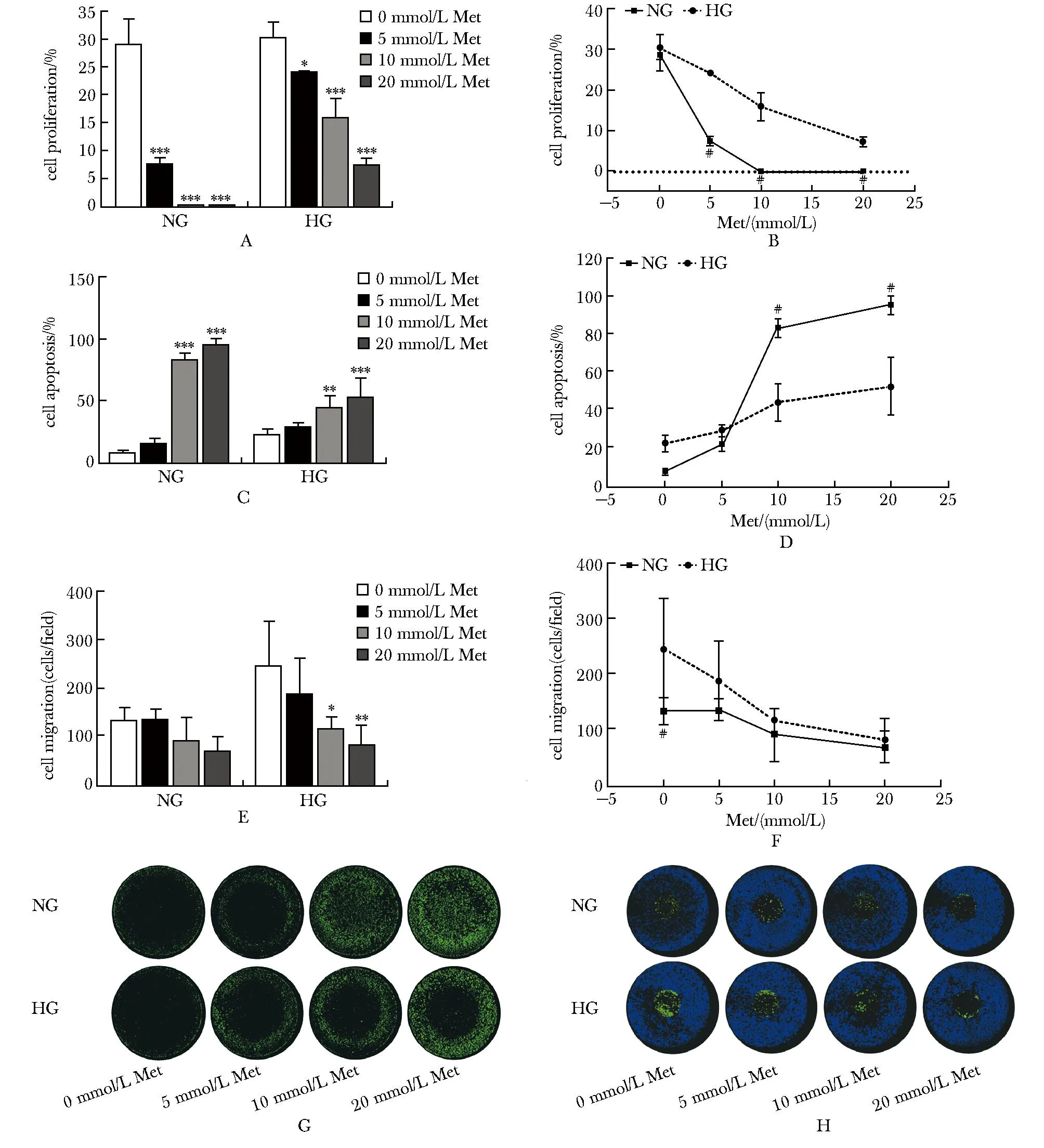
A,B.cell proliferation;C,D.cell apoptosis;E,F.cell migration;G.identification of DNA fragments in apoptosis cells using TUNEL kit;H.cell migration test:Green fluorescence in the central area represented migrating cells, while blue fluorescence in the peripheral area represented non-migrating cells;Met.metformin; NG.normal-glucose; HG.high-glucose group;*P<0.05, **P<0.01, ***P<0.001 compared with Met 0 mmol/L;#P<0.01 compared with HG.图1 二甲双胍对人胰腺癌细胞系PANC-1细胞增殖、凋亡、迁移的影响Fig 1 Effects of metformin on proliferation, apoptosis and migration of PANC-1
在HG组中,10 mmol/L及以上浓度的二甲双胍能降低G1期细胞的比例,提高S期和G2/M期细胞的比例(P<0.05)(图2A);在NG组中,5 mmol/L及以上浓度的二甲双胍能降低G1期细胞的比例,提高S期和G2/M期细胞的比例(P<0.05)(图2B)。二甲双胍对PANC-1细胞周期的作用在NG组比HG组更为显著(P<0.05)(图2C~F)。
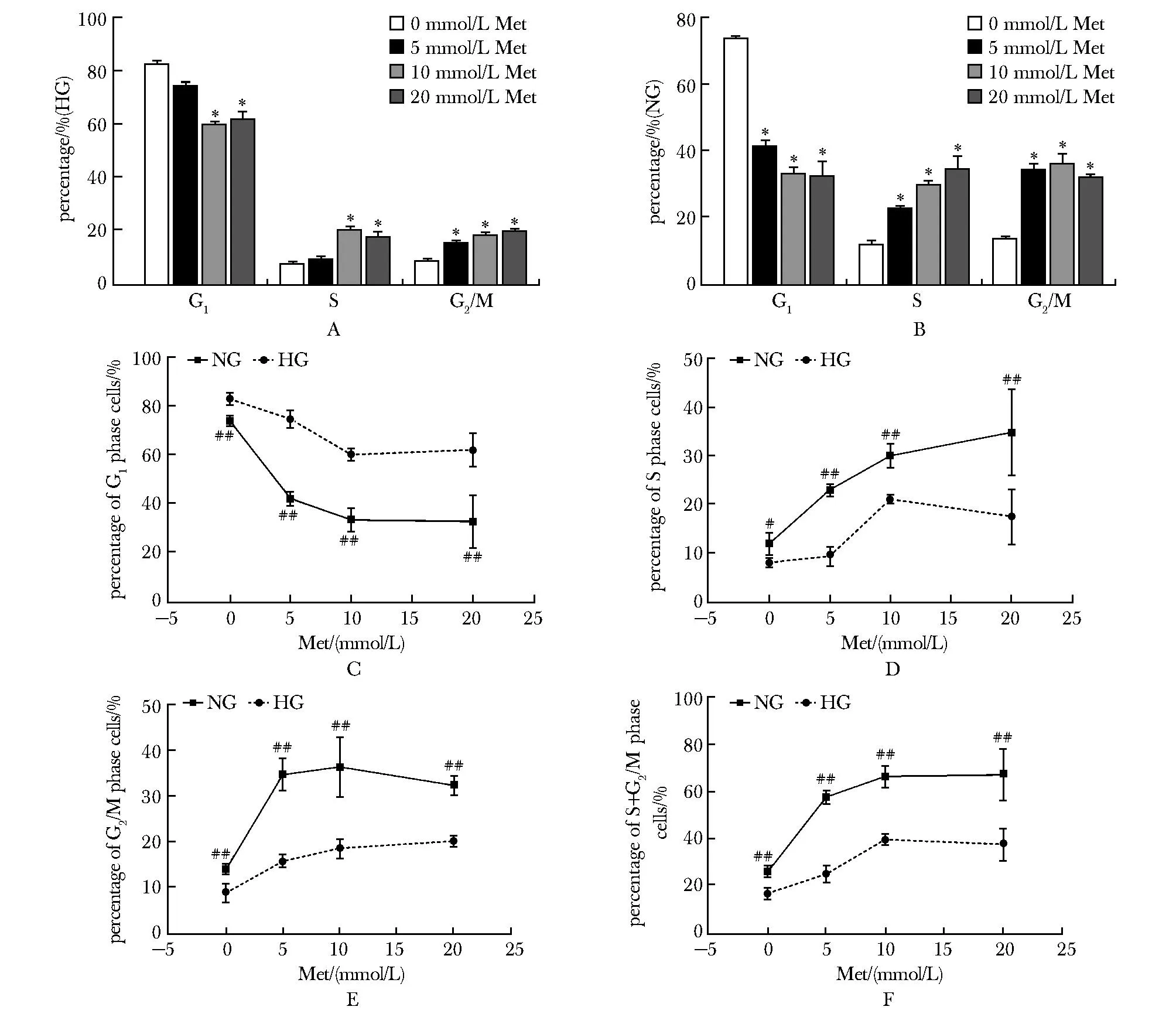
A.effects of metformin on cell cycle in high-glucose(HG) group;B.effects of metformin on cell cycle in normal-glucose(NG) group;C.percentage of G1 phase cells;D.percentage of S phase cells;E. percentage of G2/M phase cells;F.percentage of S+G2/M phase cells;Met.metformin; *P<0.05 compared with Met 0 mmol/L; #P<0.05, ###P<0.001 compared with HG.图2 二甲双胍对PANC-1细胞周期的影响Fig 2 Effects of metformin on cell cycle of
2.2 正常糖培养条件下,二甲双胍干预上调PANC-1细胞中miR-139-5p表达
在无二甲双胍处理下,高糖组和正常糖组中的miR-139-5p表达量差异无统计学意义。在二甲双胍处理后,正常糖组中的miR-139-5p表达量上调,高糖组中的变化则无统计学意义,其中5 mmol/L和10 mmol/L的二甲双胍处理分别使正常糖培养条件下的PANC-1细胞中miR-139-5p表达量增加了0.97倍和0.72倍(图3A,B)。
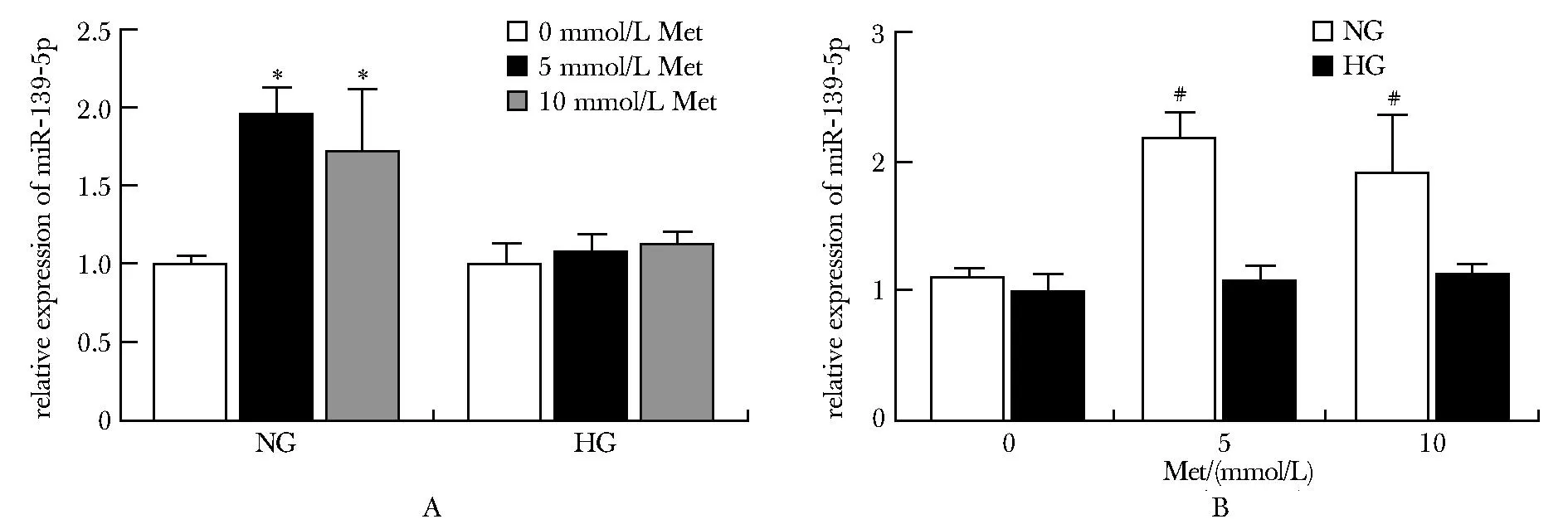
A.effects of different concentrations of metformin on the expression of miR-139-5p in PANC-1 cells; B.expression of miR-139-5p in PANC-1 cells under different concentrations of glucose culture conditions; NG:normal-glucose group;HG.high-glucose group;Met.metformin; *P<0.001 compared with Met 0 mmol/L;#P<0.01 compared with HG.图3 不同葡萄糖培养条件下miR-139-5p在二甲双胍干预前后的表达差异Fig 3 Expression of miR-139-5p in different glucose culture conditions before and after metformin
2.3 正常糖培养条件下,miR-139-5p可增强二甲双胍的抗肿瘤作用
在无二甲双胍干预且处于正常糖培养条件下,相较于NC组,miR-139-5p模拟物组的PANC-1细胞增殖下降,凋亡增加但未达统计学差异,细胞周期无影响。高糖培养条件下,两组之间的上述指标差异均无统计学意义(图4A,C;图5A,C,E)。
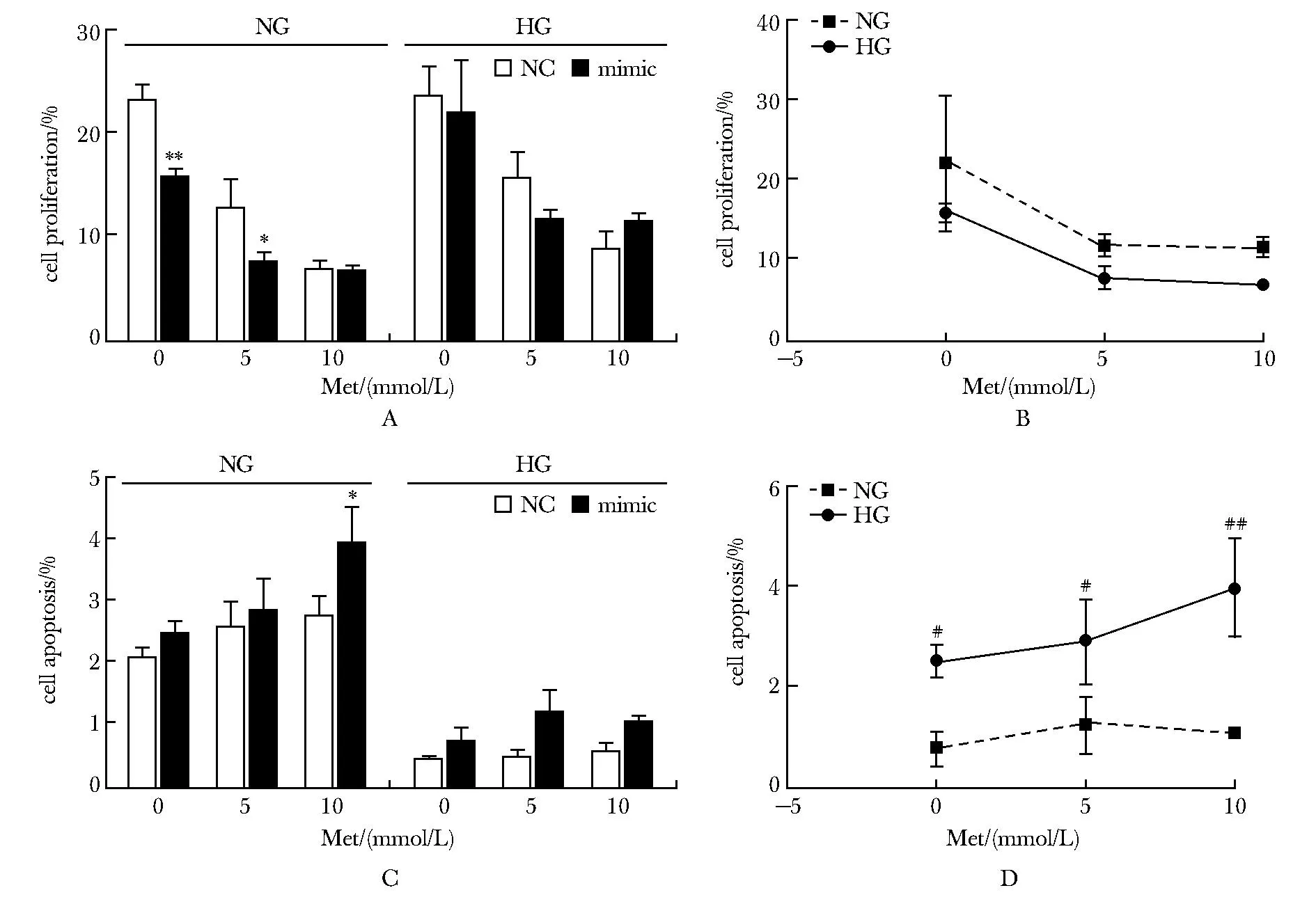
A,B.cell proliferation;C,D.cell apoptosis; NC.negative control;Met.metformin;NG.normal-glucose group; HG.high-glucose group; *P<0.05,**P<0.001 compared with NC;#P<0.05,##P<0.001 compared with HG.图4 miR-139-5p模拟物对高糖或正常糖条件下培养的PANC-1细胞增殖和凋亡的影响Fig 4 Effects of miR-139-5p mimic on proliferation and apoptosis of PANC-1 cells cultured under high or normal glucose
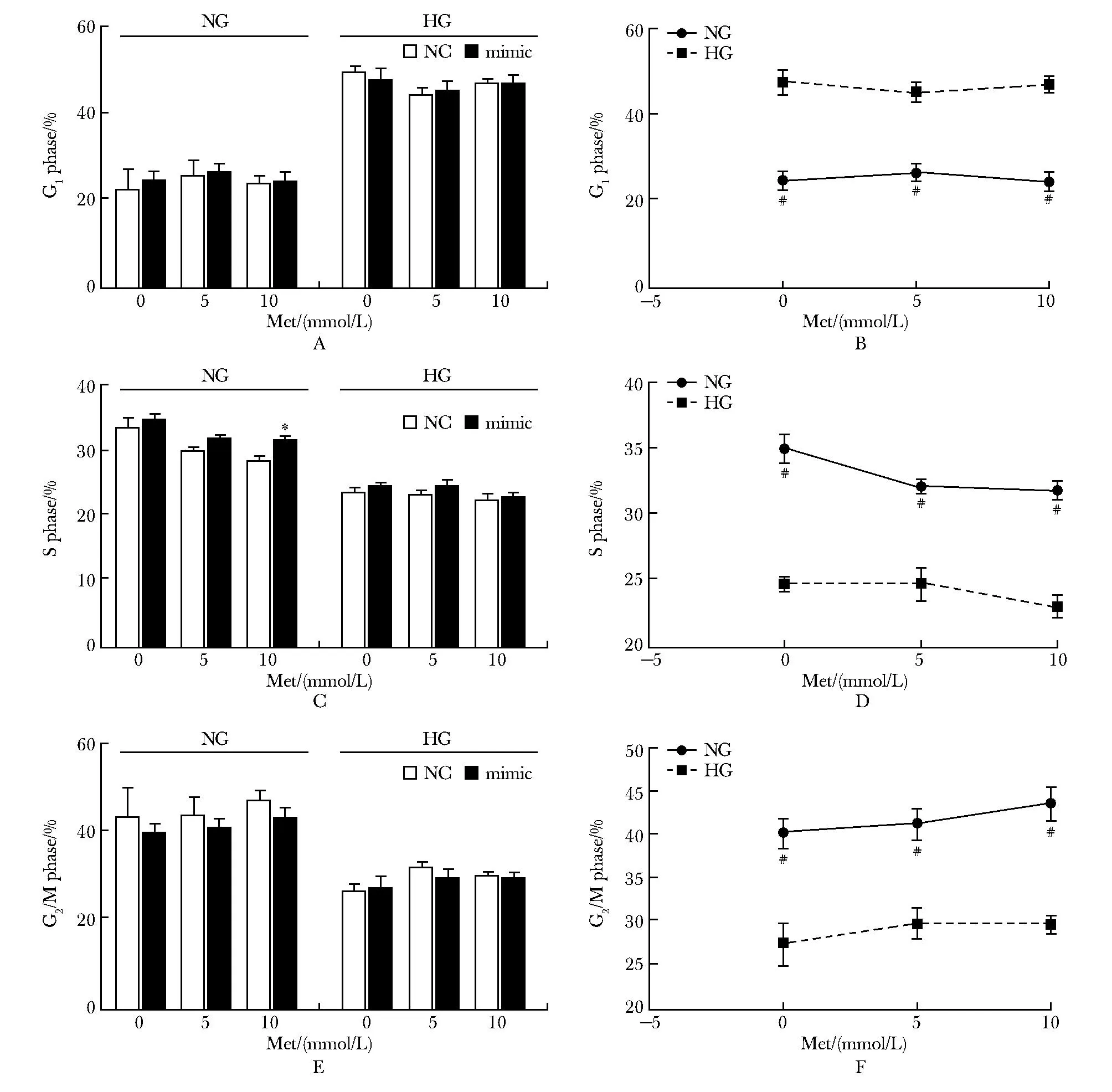
A,B.percentage of G1 phase cells;C,D.percentage of S phase cells;E,F.percentage of G2/M phase cells;NC.negative control;Met. metformin,;NG.normal-glucose group;HG.high-glucose group; *P<0.05 compared with NC; #P<0.001 compared with HG.图5 miR-139-5p模拟物对高糖和正常糖条件下培养的PANC-1细胞周期的影响Fig 5 Effects of miR-139-5p mimic on the cell cycle of PANC-1 cultured under high and normal glucose
二甲双胍干预+正常糖培养条件下,miR-139-5p模拟物组与NC组相比,5 mmol/L二甲双胍抑制增殖作用增强,10 mmol/L二甲双胍促进凋亡作用增强,10 mmol/L二甲双胍对细胞S期阻滞的作用减弱(P<0.01),而在高糖组miR-139-5p模拟物对二甲双胍的作用影响无统计学意义(图4A,C;图5A,C,E)。
无论是否存在二甲双胍的干预,相较于高糖组,miR-139-5p模拟物在正常糖组中对细胞的凋亡诱导作用表现得更为显著,使正常糖组中的PANC-1细胞具有更低的G1期比例和更高的S期以及G2/M期比例(图4B,D;5B,D,F)。
3 讨论
该研究发现二甲双胍可以抑制PANC-1细胞的增殖,诱导其凋亡,并促使细胞周期阻滞在S期和G2/M期。在正常糖培养条件下,这些作用更为显著。另外,只有在正常糖培养条件下,二甲双胍处理的PANC-1细胞中miR-139-5p的表达增加,miR-139-5p模拟物可增强二甲双胍的抗肿瘤作用。
既往研究已证实二甲双胍具有抗肿瘤作用,且在多种肿瘤相关研究中得到证实。然而,关于不同的葡萄糖培养浓度对二甲双胍作用的影响,研究结论仍不一致。部分研究发现,二甲双胍仅在正常葡萄糖培养条件下抑制肿瘤细胞增殖[8-9];另一研究则发现,在高葡萄糖培养条件下,二甲双胍能抑制甲状腺癌细胞增殖,但在正常葡萄糖培养条件下,二甲双胍能够促进甲状腺癌细胞的凋亡[10],部分支持该研究结果。可能的机制是仅在正常糖培养条件下,二甲双胍可以诱导内质网应激和自噬[10],并可通过抑制肿瘤细胞产生ATP进而诱导细胞凋亡[11]。此外,该研究发现二甲双胍仅在正常糖培养条件下诱导PANC-1细胞中miR-139-5p表达上调,且miR-139-5p可增强二甲双胍的抗肿瘤作用,提示miR-139-5p表达上调可能也是二甲双胍在正常糖培养条件下抗肿瘤作用更强的重要机制之一。因此,相对较低的血糖水平可能可以提高肿瘤细胞对二甲双胍抗肿瘤作用的敏感性,提示糖尿病合并胰腺癌患者应积极进行降血糖治疗。
其次,既往的研究显示二甲双胍可以使某些肿瘤细胞停滞在G0/G1期,但本研究发现,二甲双胍导致PANC-1细胞停滞在S期和G2/M期,这与之前的一些研究结果不一致[12-13]。这种差异可能与二甲双胍的干预时长有关,在此前的研究中,二甲双胍的使用时间从24到72 h不等。另外,吉西他滨是一种通过诱导细胞周期S期阻滞来发挥抗肿瘤作用的药物[14],被视为胰腺癌的一线化疗药物。体内外的研究显示,二甲双胍与吉西他滨联合可增强吉西他滨单独使用的效果[15]。因此,二甲双胍与吉西他滨或其他针对细胞周期S期或G2/M期的药物联合使用可能具有协同增强的抗肿瘤效果,有望给患者带来更多的获益。
本研究存在一些局限性,包括:1)未通过沉默miR-139-5p来进行反向验证,以双向确认其作用;2)未进行有或无糖尿病的肿瘤诱导小鼠实验。
综上,在正常糖培养条件下,二甲双胍抑制PANC-1细胞增殖、诱导凋亡和细胞周期阻滞的作用较高糖培养条件下更显著,部分可能与上调miR-139-5p有关。未来还需进行更多的基础与临床研究进一步证实。

