miR-218-5p 通过调控LAYN 抑制结肠癌发展的机制
蔡 冰 ,张 伟 ,刘 静 ,刘 屹
(1)渭南市中心医院病理科;2)普外科,陕西 渭南,714000;3)陕西省人民医院肿瘤内科,陕西 西安,710068)
随着我国经济的快速发展,结直肠癌的发病率和死亡率也在逐年递增。《中国结直肠癌诊疗规范(2023 年版)》[1]报道,我国结直肠癌发病率位列我国恶性肿瘤第二位,死亡率位于第五位。2020 年结直肠癌的新发病例为55.5 万,死亡病例为28.6 万[2]。然而,结直肠癌诊断和治疗中传统的生物标志物(如CEA 和CA199)不够敏感,不能为临床诊断和治疗提供准确的结肠癌筛查信息[3]。因此,寻找便捷有效的早期筛查的生物标志物可以为结直肠癌早期发现和干预提供可靠信息,从而降低其发病率和死亡率。microRNAs(miRNAs)是一类小的非编码RNA,通过结合靶mRNA 序列的3'-非翻译区(rn-translation region,UTR)来阻止翻译或促进mRNA 降解,从而在转录后调节基因表达[4]。大量证据表明,miRNAs 参与了结直肠癌的发生、进展和转移,其中miR-218 下调与结直肠癌患者不良预后相关[5],因此,笔者推测miR-218-5p 在结直肠癌中发挥抑癌作用。Layilin(LAYN)作为一种广泛表达于多种细胞的跨膜蛋白,作为透明质酸的受体在细胞黏附、运动和迁移的生物过程中发挥重要调节作用[6]。此外,LAYN与结直肠癌预后和免疫细胞浸润(CD8+T 细胞、CD4+T 细胞、巨噬细胞、中性粒细胞和DC 细胞)水平相关,提示LAYN 可作为判断结直肠癌预后和免疫浸润的生物标志物[7]。有趣的是,笔者通过生物信息学分析发现miR-218-5p 可以靶向结合LAYN mRNA 3′-UTR。因此,本文通过检测结肠癌组织和结肠癌细胞系中miR-218-5p 和LAYN的表达水平,观察过表达miR-218-5p 和LAYN对结肠癌细胞系的增殖、凋亡和侵袭的影响,探究miR-218-5p 是否通过靶向调控LAYN 影响结肠癌的增殖、凋亡和侵袭,进而影响结直肠癌的发展。
1 材料与方法
1.1 细胞与主要试剂
1.1.1 实验细胞正常人结肠上皮细胞FHC 购自丰晖生物科技有限公司,人胚肾细胞293T 购自于普诺赛,人结肠癌细胞(SW620、HT-29、HCT-116、SW480、LOVO)购自于普诺赛。
1.1.2 主要试剂DMEM 高糖培养基、McCoy’s 5A 培养基、细胞转染试剂、胎牛血清、青链霉素均购自于Thermo Fisher,Ham's F-12K 培养基购自普诺赛生物科技有限公司。pcDNA3.1 质粒和pcDNA3.1-LAYN 质粒由吉满生物科技有限公司合成,miR-218-5p mimic、mimic NC、miR-218-5p 引物、U6 引物均由广州锐博生物定制和合成。用于检测细胞增殖的CCK-8 试剂盒购于MCE,用于检测细胞凋亡的流式凋亡试剂盒购于Solarbio。用于Western blot 检测的LAYN 抗体(货号:ab192610)和cleaved Caspase3 抗体(货号:ab32042)购自Abcam,用于IHC 的LAYN 抗体(货号:20 535-1-AP)购自Proteintech。逆转录试剂盒购于Promega,实时荧光定量PCR 试剂盒购于Takara。miR-218-5p 探针购自生工生物科技有限公司,Transwell 细胞培养板购自Corning 生物,用于双荧光素酶报告基因实验的野生型LAYN载体和突变型LAYN 载体购自吉满生物科技有限公司。
1.2 实验方法
1.2.1 细胞培养与转染(1)细胞培养。向500 mL培养基中加入50 mL的胎牛血清和5 mL 青链霉素,混匀后即为完全培养基。293T 细胞、FHC 细胞、SW480 细胞和SW620 细胞用DMEM 高糖完全培养基培养;HT-29 细胞、HCT-116 细胞用McCoy’s 5A 完全培养基培养;LOVO 细胞用Ham’s F-12K完全培养基培养。将细胞接种到相应的培养基中,轻轻摇晃培养皿进行混匀,并将培养皿放置在细胞培养箱中培养。细胞培养箱的环境条件设置为37℃、5%CO2。(2)细胞转染。选择对数期的HT-29 细胞以60%~70%左右的密度将其接种于6 孔细胞培养板中。待细胞贴壁后,参考转染试剂的操作说明并按照实验分组将pcDNA3.1-NC 质粒、pcDNA3.1-LAYN 质粒、miR-218-5p mimic、mimic NC 转染至HT-29 细胞中。将细胞放置于细胞培养箱中4 h 后更换为完全培养基,48 h 后即可进行细胞相关检测。
1.2.2 CCK-8 检测向96 孔细胞培养板中接种对数期的HT-29 细胞,12 h 后进行按照实验分组进行细胞转染,转染完成后分别于不同时间点(0 h、24 h、48 h)向孔中加入10 µL CCK-8 试剂,将96 孔板放置于细胞培养箱中进一步培养4 h。最后,将96 孔板放置于酶标仪中测量波长450 nm处的吸光度。
1.2.3 流式细胞术检测细胞凋亡HT-29 细胞用0.25%胰酶消化5 min 后终止消化。将细胞收集至离心管中进行离心,1 000 r/min 离心3 min。离心完成后使用PBS 洗涤细胞2 次,PBS 重悬细胞后向细胞中加入5 µL Annexin V FITC 作用10 min,加入5 µL PI 作用5 min。最后使用流式细胞仪对细胞进行检测和数据分析。
1.2.4 Western blot 检测向结肠癌组织或细胞中加入500 µl RIPA 裂解液,使其中的蛋白从细胞中释放。裂解充分后在高速低温离心机转速12 000 r/min 的条件下进行离心5 min,收集裂解液上清并进行蛋白浓度的检测。将蛋白变性后取30 µg 蛋白进行电泳,使用0.45 µm PVDF 膜进行转印。将转印好的PVDF 膜放入5%脱脂牛奶中室温封闭1 h,1 h 后将膜放入配制好的一抗溶液(1∶1 000)中室温孵育3 h。用1%TBST 洗膜完成后将膜在室温环境用羊抗兔的二抗溶液(1∶10 000)孵育1 h。向膜上加入化学发光底物孵育5 min,最后将膜放入化学发光成像仪中进行曝光显色。使用Image J 软件对蛋白条带进行灰度值分析。
1.2.5 RT-qPCR 检测用Trizol 试剂将临床结肠癌组织样本和细胞进行裂解提取总RNA。使用分光光度计测定RNA 的浓度和纯度。检测组织和细胞中的miR-218-5p 的表达水平,使用miR-218-5p 茎环法引物作为反转录引物和PCR 引物。取500 ng RNA,将其进行DNA 酶消化后逆转录为cDNA。将cDNA 作为模板通过实时荧光定量PCR 检测miR-218-5p 的表达。检测到的CT 值用2-ΔΔCt法进行分析。
1.2.6 原位杂交(in situ hybridizsation,ISH)将石蜡包埋的组织切片进行脱蜡和水化,用蛋白酶K 处理切片20 min。向切片上滴加3% H2O2,室温避光孵育15 min。PBS 洗涤后向切片上加入200 µL 的预杂交液放在杂交炉上,65℃下预杂交1 h。将200 µL 浓度为500 ng/mL 的miR-218-5p 探针杂交液滴加到玻片上在55℃孵育1.5 h。将切片在55℃下振荡洗涤25 min。用血清BSA封闭切片30 min 后向切片上滴加地高辛标记HRP,进行DAB 显色反应1 h 后用纯水洗涤终止反应。进行Harris 苏木素复染后脱水处理(按照50%、75%、100%乙醇顺序)。最后,用中性树胶封片,在显微镜下进行观察并拍照。
1.2.7 免疫组织化学检测(immunohistochemistry,IHC)取新鲜组织后用生理盐水洗涤污垢后将其浸泡入4%多聚甲醛中固定、石蜡包埋和切片。用60℃烤箱将石蜡切片脱蜡60 min,然后经过二甲苯和乙醇水化。用通透液浸润玻片30 min 后PBS 清洗。使用柠檬酸钠缓冲液(pH 6.0,0.01M)在微波炉中进行抗原修复4 min,重复2 次。用与二抗同一来源的血清在37℃恒温箱中封闭30 min。向切片滴加稀释好的一抗20 µL 在4℃孵育过夜。向切片中滴加二抗20 µL,在37℃孵育1 h。DAB 显色10 min 后用蒸馏水终止显色。用Mayer苏木素染色30 s,水洗,盐酸酒精分化2 s,流水浸入15 min。然后进行乙醇梯度脱水(由低至高:50%、70%、95%、100%)各2 min,二甲苯5 min使切片透明化,最后加入中性树胶封片,在白光显微镜进行观察并拍照。
1.2.8 Transwell 检测细胞侵袭Matrigel 基质胶均匀平铺在孔径为8 µm 的Transwell 上室,静置凝固。将转染过的HT-29 细胞(细胞数量为5×104个/孔)接种于Transwell 上室,上室培养基为不含血清的McCoy’s 5A 培养基,下室为含血清的McCoy’s 5A 培养基。将Transwell 培养板放入37℃、5%CO2细胞培养箱中培养24 h,然后将Transwell 上室未侵袭的细胞用棉签轻轻擦去,侵袭的细胞用4%多聚甲醛固定30 min。用0.5%结晶紫染液进行染色10 min 后用蒸馏水冲洗,最后在显微镜下对细胞进行观察和计数。
1.2.9 双荧光素酶报告基因实验将LAYN 的3′ UTR 区序列扩增到pmirGLO 载体上,用于构建LAYN 野生型载体LAYN-WT;将靶向结合的序列进行突变,用于构建LAYN 突变型载体LAYN-MUT。将293T 细胞接种于96 孔板中,细胞密度为60%。按照转染方法将mimic NC/miR-218-5p mimic 和LAYN-WT/MUT 共转染至293T 细胞中。细胞转染48 h 后使用荧光素酶报告基因检测试剂盒检测荧光素酶活性,并计算相对荧光素酶活性。
1.3 统计学处理
采用 GraphPad Prism 6.0 进行柱形图绘制及数据统计分析,数据表示为“均值±标准差”(mean ± SD)。2 组间比较使用t检验,多组间比较使用单因素方差分析。以P< 0.05 表示差异具有统计学意义。
2 结果
2.1 miR-218-5p 和LAYN 在结肠癌组织和细胞系中的表达情况。
为了研究miR-218-5p 和LAYN 在结肠癌组织中的表达水平,采用RT-qPCR(P< 0.000 1)和ISH 检测临床结肠癌组织样本中miR-218-5p 的表达情况,结果表明miR-218-5p 在结肠癌组织中表达降低,见图1A、1B;采用Western blot(P< 0.000 1)和IHC(P< 0.05)检测结肠癌组织样本中LAYN 的表达,结果表明LAYN 在结肠癌组织中表达升高,见图1C、1D、1E、1F。
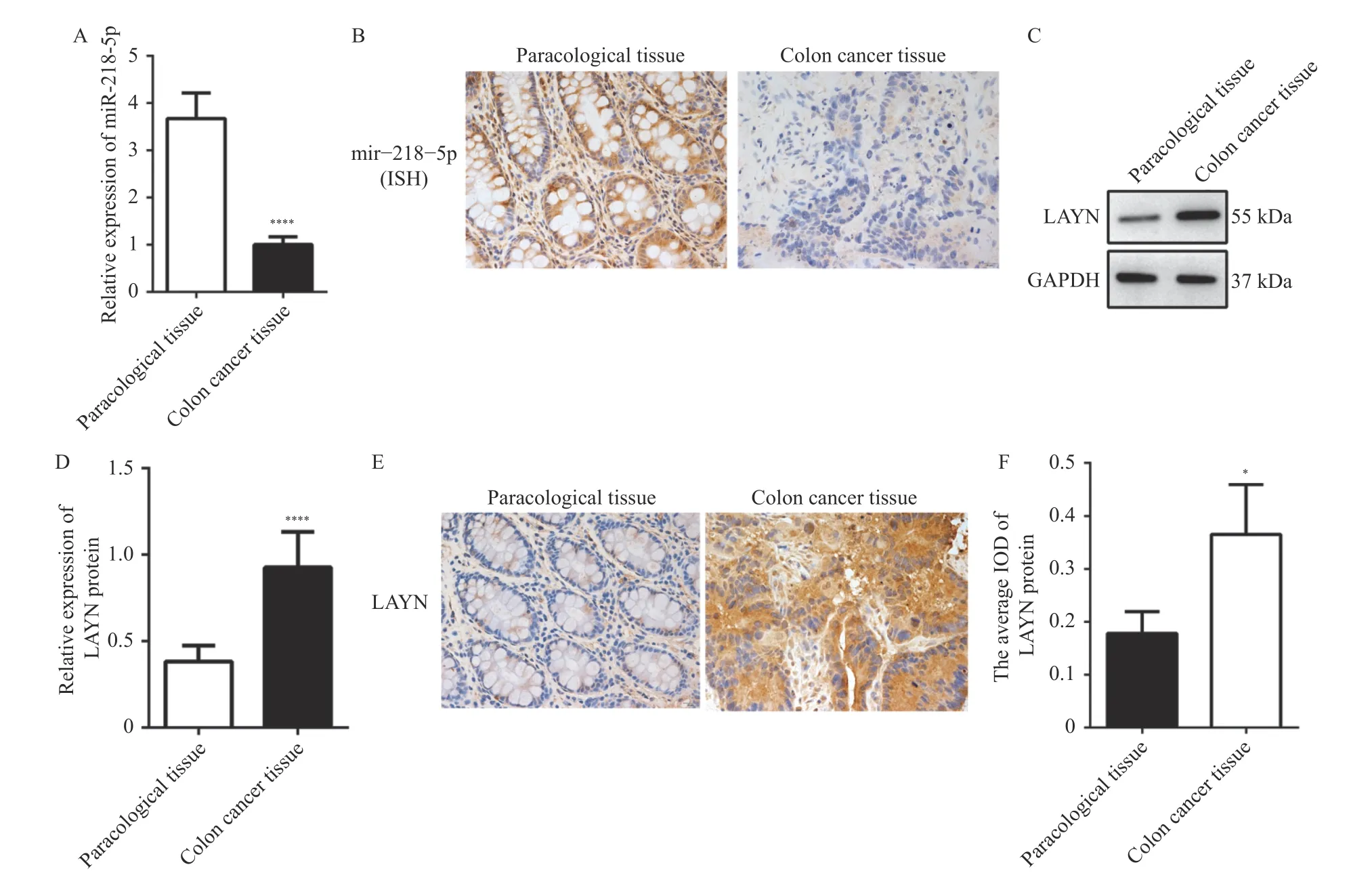
图1 miR-218-5p 和LAYN 在结肠癌组织及癌旁组织中的表达情况Fig.1 The expression of miR-218-5p and LAYN in colon cancer tissues and paracancerous tissues
为了研究miR-218-5p 和LAYN 在多种结肠癌细胞系中的表达水平,采用RT-qPCR 检测临床结肠癌细胞系中miR-218-5p 的表达。结果显示,与FHC 细胞相比,HT-29、SW480、SW620、HCT-116、LOVO 等结肠癌细胞系中的miR-218-5p 表达水平降低,其中HT-29 细胞中miR-218-5p 表达最低(P< 0.000 1),见图2A;采用Western blot 检测结肠癌细胞系中LAYN 的表达,结果显示,与FHC 细胞相比,HT-29、SW-480、SW620、HCT-116、LOVO 等结肠癌细胞系中的LAYN 表达水平升高,其中HT-29 细胞中LAYN 表达最高(P< 0.000 1),见图2B~2C。根据RT-qPCR 和Western blot 检测结果均说明HT-29 在5 种人结肠癌细胞系中miR-218-5p 表达最低并且LAYN蛋白表达最高,因此选择HT29 细胞进行功能实验研究。
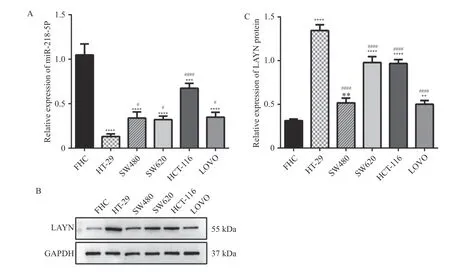
图2 miR-218-5p 和LAYN 在结肠癌细胞系中的表达情况Fig.2 The expression of miR-218-5p and LAYN in colon cancer cell lines
2.2 miR-218-5p 对HT29 细胞的作用
采用细胞转染技术向HT29 细胞中转染miR-218-5p mimic 及其对照,通过RT-qPCR 检测转染后的HT29 细胞中miR-218-5p 表达水平从而验证转染效率。结果显示,与mimic NC 组相比,miR-218-5p mimic 组中miR-218-5p 表达水平升高(P< 0.000 1),见图3A。
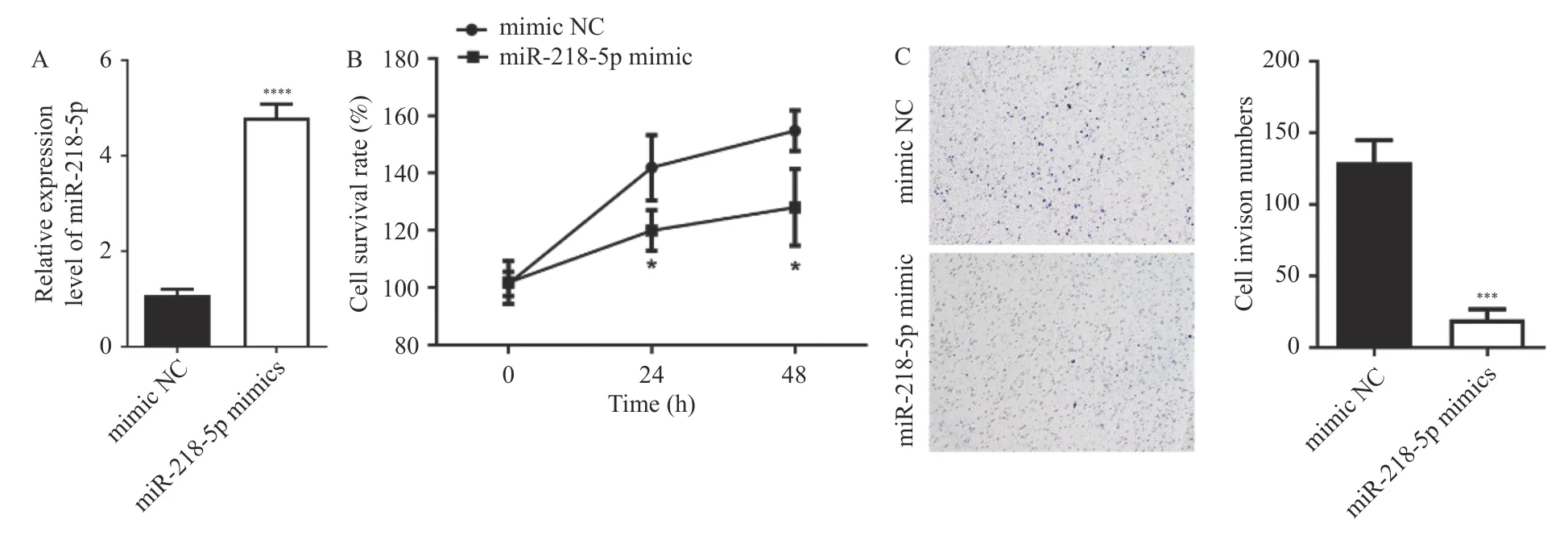
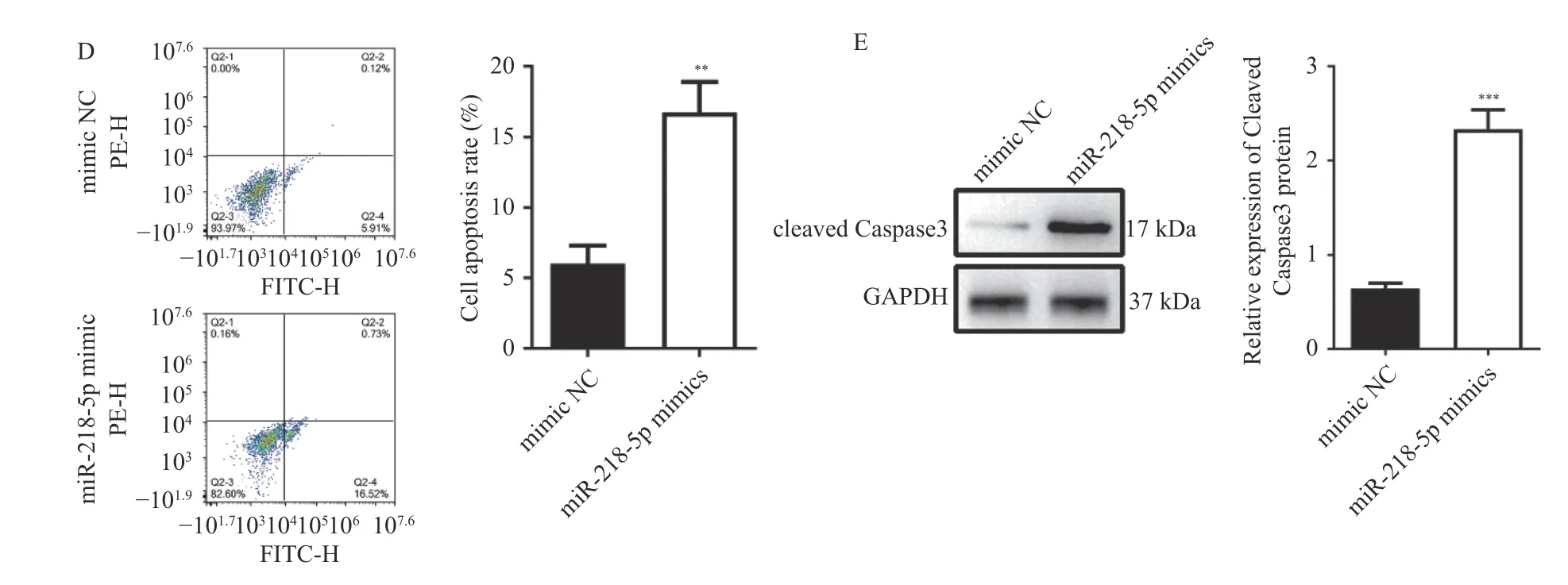
图3 过表达miR-218-5p 抑制HT29 细胞增殖、侵袭并诱导凋亡Fig.3 Overexpression of miR-218-5p inhibits the proliferation,invasion and induces apoptosis of HT29 cells
在miR-218-5p mimic 转染成功后,采用CCK-8 试剂盒检测过表达miR-218-5p 的HT-29细胞在不同时间(0 h、24 h、48 h)的增殖情况,结果显示,与对照组相比,miR-218-5p mimic 组中HT-29 细胞增殖降低(P< 0.05),见图3B。采用Transwell 检测过表达miR-218-5p 的HT-29 细胞的侵袭能力,结果显示,与对照组相比,miR-218-5p mimic 组中HT-29 细胞侵袭能力降低(P<0.001),见图3C。采用Annexin V-FITC/PI 检测过表达miR-218-5p 的HT-29 细胞的凋亡水平,结果显示,与对照组相比,miR-218-5p mimic 组中HT-29 细胞凋亡水平升高(P< 0.01),见图3D。采用Western blot 检测凋亡相关蛋白cleaved Caspase3 的表达情况,结果显示,与对照组相比,miR-218-5p mimic 组中HT-29 细胞中cleaved Caspase3 蛋白表达水平升高(P< 0.001),见图3E。综上所述,过表达miR-218-5p 可以抑制HT-29细胞增殖、侵袭并诱导其凋亡。
2.3 miR-218-5p 与LAYN 的靶向关系
通过Starbase3.0 数据库预测,miR-218-5p和LAYN 具有靶向关系,见图4A。采用双荧光素酶报告基因检测显示miR-218-5p mimic 可以抑制野生型LAYN 质粒的荧光素酶活性(P< 0.01),对突变型LAYN 质粒的荧光素酶活性没有影响,见图4B。通过Western blot 检测过表达miR-218-5p 的HT-29 细胞中LAYN 表达水平,结果显示,与对照组相比,miR-218-5p mimic 组LAYN 表达水平降低(P< 0.01),见图4C~4D,进一步验证了miR-218-5p 靶向下调LAYN。
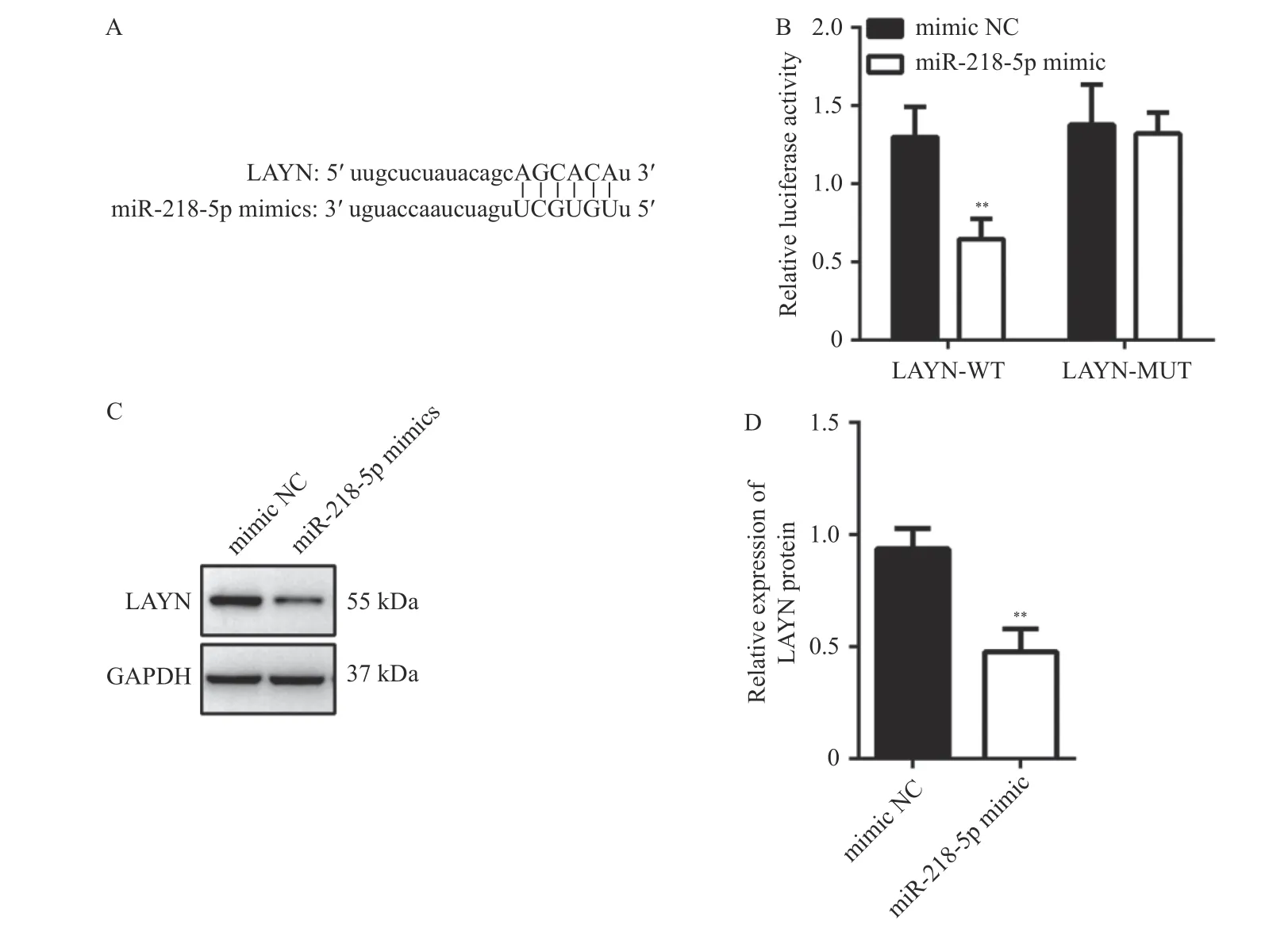
图4 miR-218-5p 靶向LAYNFig.4 miR-218-5p targeted LAYN
2.4 miR-218-5p/LAYN 对HT29 细胞的作用机制
向 HT-29 细胞中分别转染 mimic NC+pcDNA3.1、pcDNA3.1-LAYN+mimic NC、pcDNA3.1-LAYN+miR-218-5p mimic,通 过Western blot 检测HT-29 细胞中LAYN 的表达水平,结果显示,与mimic NC+pcDNA3.1 组相比,过表达LAYN 后LAYN 表达水平升高(P< 0.001),而同时过表达LAYN 和miR-218-5p 可以逆转LAYN 的表达水平(P< 0.01),见图5A~5B。通过CCK-8、Transwell、Annexin V-FITC/PI 检测发现,与mimic NC+pcDNA3.1 组相比,过表达LAYN 后细胞增殖(P<0.01)和侵袭能力升高(P< 0.001),见图5C~5D;细胞凋亡水平降低(P< 0.05),见图6A;而同时过表达LAYN 和miR-218-5p 可以逆转LAYN 过表达引起的细胞增殖(P< 0.05)、侵袭(P< 0.05)、凋亡(P< 0.05)水平的变化,见图5C~5D、图6A。采用Western blot 检测凋亡相关蛋白cleaved Caspase3 的表达情况,结果显示,与mimic NC+pcDNA3.1 组相比,过表达LAYN 降低 HT-29 细胞中cleaved Caspase3 蛋白表达水平(P< 0.001),而同时过表达LAYN 和miR-218-5p 可以逆转cleaved Caspase3 蛋白的表达变化(P< 0.05),见图6B。综上所述,miR-218-5p 靶向调控LAYN抑制HT29 细胞增殖、侵袭并诱导凋亡。
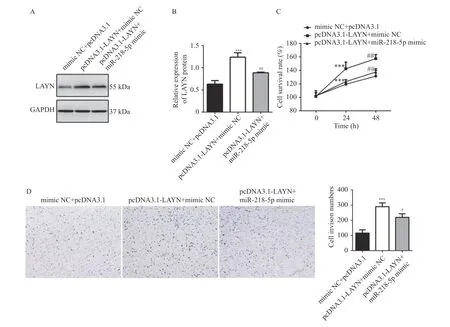
图5 miR-218-5p 靶向调控LAYN 抑制HT29 细胞增殖、侵袭Fig.5 miR-218-5p inhibited proliferation,metastasis of HT-29 cells by targeting LAYN
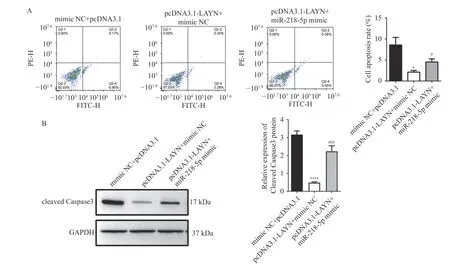
图6 miR-218-5p 靶向调控LAYN 诱导HT-29 细胞凋亡Fig.6 miR-218-5p induced apoptosis of HT-29 cells by targeting LAYN
3 讨论
结直肠癌是全球消化系统中最常见的恶性肿瘤,也是因癌症导致死亡的第二大原因[8]。结直肠癌是由不健康的饮食习惯、缺乏运动、肥胖、吸烟、年龄、遗传易感性和肠道炎症等因素协同作用的结果[9],具有预后差、致死性强、缺乏靶向治疗药物、发病率高等特点。然而,结直肠癌的发病机制尚未完全阐明。因此,研究结肠癌的分子表达特征并寻找诊断和治疗靶点势在必行。
近年来随着miRNAs 在结直肠癌中功能的深入研究,越来越多的证据表明miRNAs 在结直肠癌发生发展的各个阶段(包括增殖、凋亡、免疫反应、迁移、侵袭)均发挥了促癌或抑癌作用[10-13]。miR-218-5p 是包括结直肠癌在内的许多癌症中的肿瘤抑制因子[14-16]。研究报道,miR-218-5p在结肠癌患者的癌组织和结直肠癌细胞(包括HT-29 细胞和HCT116 细胞)中表达下调,同时过表达miR-218-5p 通过下调SKAP1 抑制结肠癌细胞的增殖、侵袭和迁移[17]。miR-218-5p 可以通过调控PUM1 抑制癌细胞恶性增殖和化学耐药[18]。笔者的研究结果显示,在结肠癌组织中miR-218-5p 表达相比于癌旁组织降低,而在多种结肠癌细胞系中,miR-218-5p 的表达水平相比于正常结肠上皮细胞也降低。通过功能获得性实验证实过表达miR-218-5p 表达升高后HT-29 细胞的增殖和侵袭能力降低,凋亡水平升高。因此,笔者的研究也证实了miR-218-5p 可以抑制结肠癌的进展。有研究报道[19],miR-218-5p 通过下调DPH1降低了SW480 细胞的增殖和侵袭能力,与miR-218-5p 在HT-29 细胞中的研究作用一致。
LAYN 的高表达有助于肿瘤相关巨噬细胞、DC 细胞、T 细胞衰竭和Tregs 的调节[7];在多种癌症中也发现LAYN 促进癌细胞的上皮间质转化,促进癌症的转移[20]。以上研究结果均提示LAYN高表达与结肠癌的不良预后正相关。笔者研究也发现,LAYN 在结肠癌组织和结肠癌细胞表达上调。目前,miRNAs 与LAYN 的调控研究尚无报道。通过双荧光素酶报告基因实验证实,miR-218-5p 可以靶向结合LAYN mRNA 3′-UTR。在HT-29 细胞中过表达miR-218-5p 可以抑制LAYN蛋白的表达水平。推测miR-218-5p 可能是通过下调LAYN 影响结肠癌的迁移、凋亡和增殖。本研究结果显示过表达miR-218-5p 可以抑制HT-29 细胞的增殖、侵袭并促进凋亡,而过表达LAYN可以部分逆转miR-218-5p 对HT-29 细胞的作用。总之,miR-218-5p 可以通过靶向调控LAYN 抑制HT-29 细胞的增殖、侵袭并促进凋亡。
综上所述,在结肠癌中miR-218-5p 通过靶向调控LAYN 的表达,从分子机制上影响结肠癌的进展,丰富了miR-218-5p 作为抑癌基因在结肠癌中的作用机制,也为miR-218-5p 成为结肠癌诊断和治疗的生物标志物提供基础实验研究证据。

