正中神经电刺激对缺血性脑卒中大鼠突触可塑性的影响
张成才 ,宁 蓉 ,陈 娜 ,彭艺晨 ,周 丽 ,杨晰宸 ,卢静怡 ,张彭跃 ,李 蕊
(1)云南中医药大学第二临床医学院,云南 昆明 650500;2)昆明市第二人民医院康复医学科,云南 昆明 650032)
脑卒中是一种由于脑出血或脑梗塞导致神经功能缺损的急性脑血管病,其中缺血性脑卒中约占总脑卒中的四分之三以上[1]。缺血性脑卒中发生后会触发一系列的神经功能障碍,包括炎症反应、能量衰竭、兴奋毒性以及神经细胞的凋亡、自噬及坏死等[2],是导致残疾和死亡的主要原因,给患者、家庭、社会带来了沉重的负担。因此,找到促进脑卒中后神经修复的方法至关重要。正中神经电刺激(median nerve electrical stimulation,MNES)是一种具有广泛应用前景的神经调制技术[3],正中神经被认为是联系中枢神经系统的外周门户,作用于正中神经上的电刺激可沿着上行传导通路诱发脊髓和大脑皮层的神经可塑性,从而影响神经网络重塑和功能修复[4]。临床研究发现,MNES 治疗过程中脑双侧前额氧合血红蛋白浓度升高,该部位神经活动发生变化,最终改善脑卒中后患者的认知功能[5],但其作用机制仍尚不明确,且在治疗剂量、频率、疗程的选择上仍缺少临床指南,尚无确切最佳的电刺激治疗处方规范。因此,本研究通过动物实验探讨正中神经电刺激治疗对脑卒中的作用机制,为临床上正中神经电刺激的优化和推广以及缺血性脑卒中的防治提供基础实验依据。
1 材料与方法
1.1 实验动物及分组
由湖南斯莱克实验动物有限公司[SCXK(湘)2019-0004]提供的健康雄性SD 大鼠,体重(250±20)g,于云南中医药大学实验动物中心[SYXK(滇)K2022-0004]适应性喂养,本研究通过昆明市第二人民医院伦理委员会2021(06)号批准,所有实验操作步骤都严格按照动物伦理和相关实验动物的实验要求规范执行。将SD 大鼠随机分成造模组和假手术组(Sham),在造模24 h 后对脑缺血大鼠进行神经行为学评分,剔除死亡及不合格者,然后将造模成功的大鼠按随机数字表法随机分成中动脉闭塞模型组(middle cerebral artery occlusion,MCAO)和正中神经电刺激干预组(median nerve electrical stimulation,MNES),每组各6 只。
1.2 主要试剂耗材
异氟烷:瑞沃德生命科技有限公司(中国深圳);线栓:西浓科技有限公司(中国北京);抗体:艾博抗(Abcam)贸易有限公司(中国上海),BDNF:ab108319,TrkB:187041,synI:ab254349,PSD95:ab238315。
1.3 主要仪器
外周神经电刺激仪(SY-708A,中国江苏);气体麻醉机:众实迪创科技发展有限责任公司(中国北京);转棒疲劳仪:移数信息科技有限公司(中国上海);高速冷冻离心机:Hettich 公司(德国);电泳仪:BIO-RAD;全自动研磨仪:赛维尔生物科技有限公司(中国武汉);化学发光成像系统:勤翔科学仪器有限公司(中国上海);冷冻切片机:赛默飞世尔仪器有限公司(中国上海)。
1.4 实验方法
1.4.1 缺血性脑卒中大鼠模型的建立采用线栓法建立大鼠左侧大脑中动脉脑梗塞模型,假手术组动物除不插入和拔出线栓,其余各步骤均相同。缺血60 min 后取出线栓,缝合好伤口,置于30℃电热毯上维持体温,待大鼠苏醒后,放回鼠笼内饲养。
1.4.2 干预方法造模成功后第3 天对 MCAO 大鼠进行损伤侧前肢 MNES 干预。异氟烷气体麻醉大鼠,使用外周神经电刺激仪(SY-708A,中国,江苏)在前肢距腕关节上5 mm 处两肌腱之间,以45°倾斜角度插入一根毫针,插入深度为 1 mm,接入电极见图1。刺激参数为:刺激参数为:0.6 mA,5 min;1 mA,10 min;1.5 mA,5 min;总刺激时间为 20 min,隔天干预,连续 7 次。干预结束后消毒并放入饲养笼中。MCAO 组在相同位置插入刺激针,但不予与电流,其余操作同干预组。Sham 组不作任何处理。

图1 大鼠脑卒中后正中神经电刺激示意图Fig.1 Median nerve electrical stimulation after stroke in rats
1.5 检测指标
1.5.1 HE 染色干预结束后取干预侧和假手术组右侧正中神经,固定于4%多聚甲醛,OCT 包埋,冰冻切片(10 µm),用苏木精-伊红染色法进行染色,置于显微镜下观察病理变化。
1.5.2 神经功能缺损评分(neurological severity score,NSS)采用7 分制评分法测试动物整体神经功能缺失状况,用于评估神经功能恢复情况,见表1。

表1 神经功能缺损评分Tab.1 Neurological severity score
1.5.3 踏错实验(Foot-fault test)采用踏错实验评估大鼠的运动协调能力,用录像机记录大鼠损伤侧前肢抓住横梯的状态,然后进行评分,见表2。

表2 踏错实验评分Tab.2 Foot-fault test scores
1.5.4 转棒测试(Rota-rod test)转棒实验评估缺血性脑卒中大鼠患侧运动功能以及运动耐力的恢复情况,将大鼠放置在运转的转棒上,共测试3 轮,每2 轮之间间隔5 min,将转棒设置为10 s后匀速增加至10 r/min,持续5 min;记录跑动时间,取3 轮的平均成绩作为最终成绩。
1.5.5 尼式染色干预结束后将大鼠用 3%戊巴比妥钠麻醉后,取出完整大脑,用4%多聚甲醛进行固定后,蔗糖脱水,OCT 包埋,进行冰冻切片(10 µm),根据硫堇染色法染色步骤进行染色,光镜下观察缺血半影区神经元的损伤修复情况。
1.5.6 Western blot在干预结束后1 h,使用3%戊巴比妥钠麻醉大鼠,取出大脑,分离损伤侧大脑皮层,立即于干冰中速冻后转入-80℃冰箱保存至检测。样品收集完成后进行总蛋白提取、定量,然后依次进行80 V 电压下 SDS-PAGE 凝胶电泳40 min 后换电压为120 V 至溴酚蓝即将跑出分离胶、电流300 mA 转膜85 min、5%脱脂奶粉封闭2 h、一抗孵育(BDNF 1∶3 000、TrkB 1∶1 000、synI 1∶3 000、PSD95 1∶3 000)4℃冰箱过夜、二抗孵育(goat anti-rabbit IgG 1∶5 000)1 h 后进行显影和结果分析。
1.5.7 透射电镜大鼠深度麻醉后处死,取右侧半球额顶区皮质(缺血周边区),大小约1 mm×1 mm×2 mm,经2.5%戊二醛、1%锇酸固定,用酒精和丙酮脱水,用环氧树脂包埋后,进行半薄切片定位,超薄切片(60 nm),以醋酸铀、枸橼酸铅染色后,置透射电镜下观察目标区域轴突结构、突触连接状况及突触数量变化。
1.6 统计学处理
采用GraphPad Prism 9 进行统计分析并作图,所有实验数据均采用“均数±标准误”(Mean±SEM)表示,2 组间比较使用单因素方差分析(oneway ANOVA)后进行事后多重比较(Followup tests),P< 0.05 为差异有统计学意义。
2 结果
2.1 正中神经电刺激对脑卒中大鼠的正中神经未造成损伤
干预结束后,取干预组右侧和假手术组右侧正中神经进行HE 染色,见图2。与假手术相比,正中神经电刺激干预后,对正中神经并未造成损伤,其神经被膜结构完整,无明显炎性细胞浸润。

图2 正中神经电刺激对脑卒中大鼠的正中神经未造成损伤Fig.2 Median nerve electrical stimulation did not cause damage to the median nerve in rats after stroke
2.2 正中神经电刺激改善缺血性脑卒中大鼠的神经功能和患侧前肢的运动协调能力
干预结束后通过神经功能缺损评分、Footfault test、Rota-rod test 对大鼠的神经功能、运动协调能力及运动耐力进行评估,见图3。与Sham组相比,MCAO 组表现出严重的神经功能缺损(P<0.001);与MCAO 组相比,MNES 组的神经功能缺损表现明显改善(P< 0.05)。与Sham 组相比,MCAO 组大鼠的运动协调功能明显下降(P< 0.05);与MCAO 组相比,MNES 组大鼠的运动协调能力明显改善(P< 0.05)。Rota-rod test 的结果表明:与Sham 组MCAO 组大鼠的运动时间明显减短(P<0.05);与MCAO 组相比,MNES 组大鼠的运动时间明显增加(P< 0.05)。
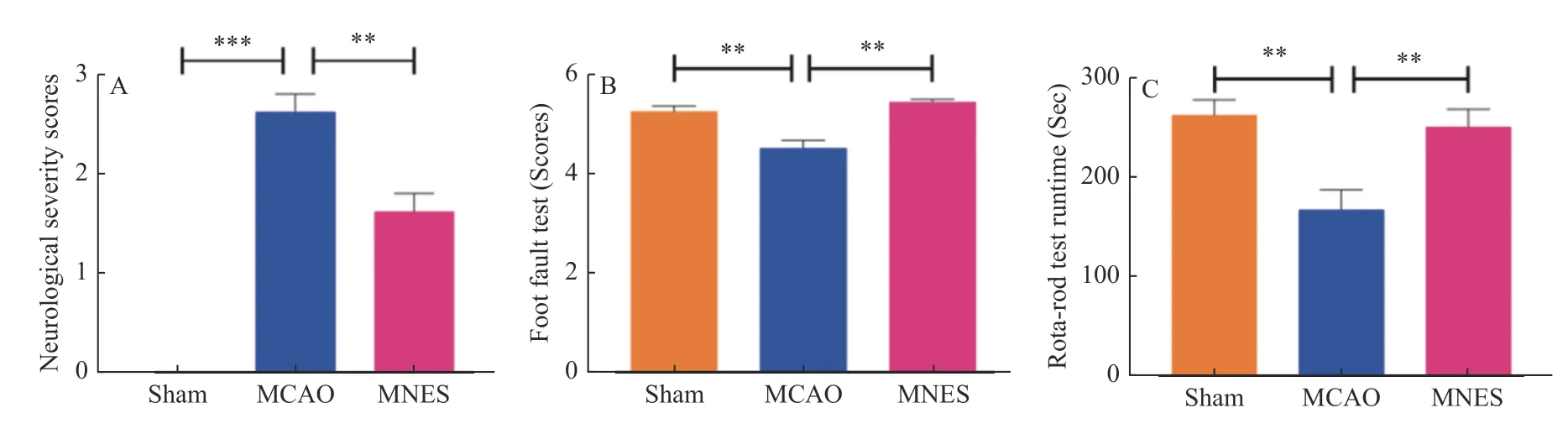
图3 正中神经电刺激改善缺血性脑卒中大鼠受损的神经功能和运动协调能力Fig.3 Median nerve electrical stimulation improves nerve function and motor coordination in ischemic stroke rats
2.3 正中神经电刺激减轻缺血性脑卒中大鼠脑梗死体积
干预结束后,取各组脑组织进行冰冻切片尼式染色以评估脑缺血损伤情况,染色结果和梗死体积统计结果,见图4。与Sham 组相比,MCAO组大鼠脑梗死明显(P< 0.001),且尼式小体核固缩现象增多,染色较深;与MCAO 组相比,MNES组大鼠的梗死体积明显减小(P< 0.05),尼式小体核固缩现象减少,染色变浅。
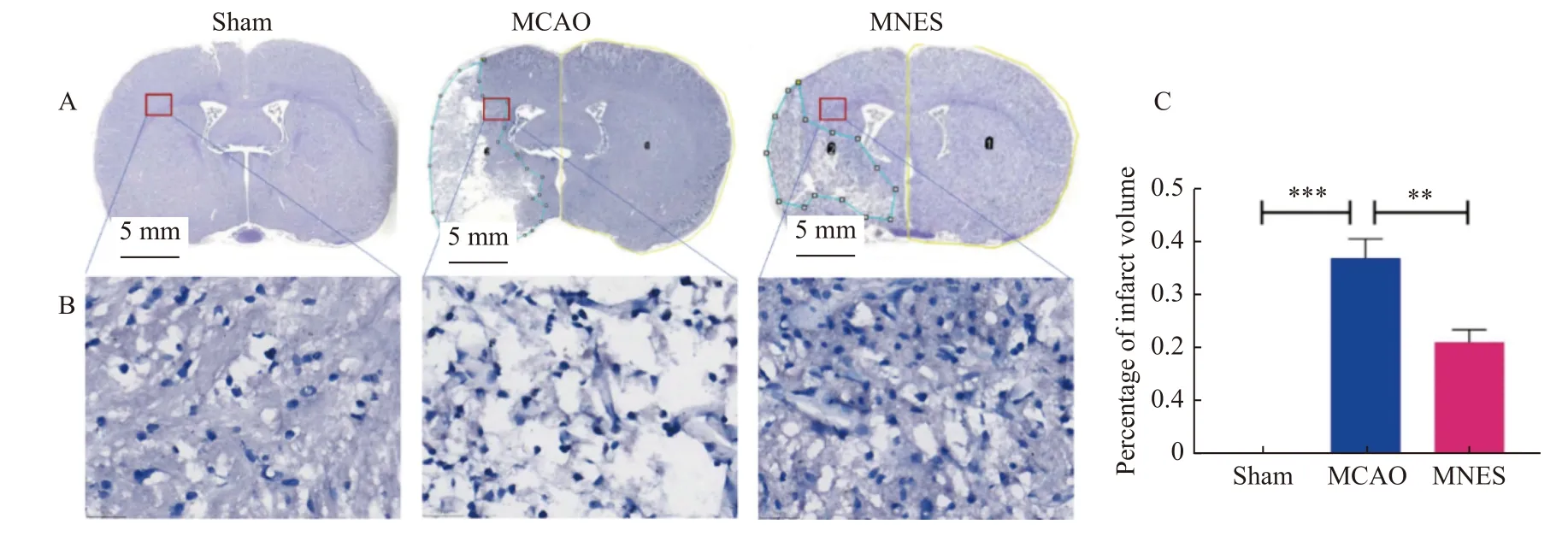
图4 正中神经电刺激减轻缺血性脑卒中大鼠的脑梗死体积Fig.4 Median nerve electrical stimulation reduced volume of cerebral infarction in ischemic stroke rats
2.4 正中神经电刺激上调缺血性脑卒中大鼠大脑皮层中与神经可塑性相关蛋白的表达水平
Western blot 实验检测损伤侧大脑皮层中与神经可塑性相关蛋白:脑源性神经营养营养因子(BDNF)、络氨酸激酶受体(TrkB)、突触素相关蛋白I(synI)、突触后致密蛋白(PSD95)的表达水平。与MCAO 组相比,MNES 组大鼠大脑皮层中BDNF、TrkB、synI、PSD95 的表达水平均明显上调(P<0.05),见图5。
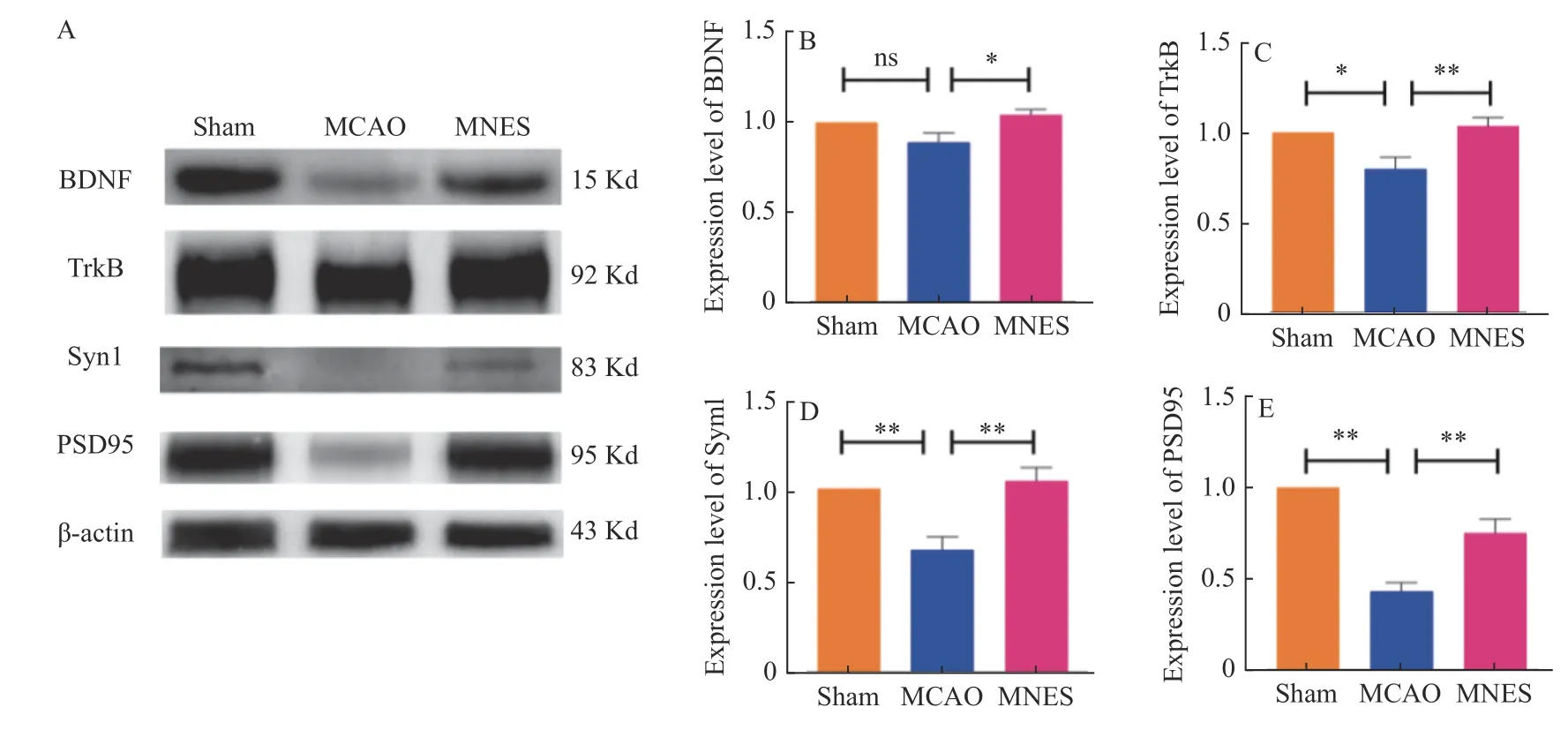
图5 正中神经电刺激上调缺血性脑卒中大鼠大脑皮层中与神经可塑性相关蛋白的表达水平Fig.5 Median nerve electrical stimulation up-regulated the expression level of neuroplasticity-related proteins in cerebral cortex of ischemic stroke rats
2.5 正中神经电刺激对缺血性脑卒中大鼠突触可塑性的影响
通过电镜观察损伤侧大脑皮层突触结构的变化。与Sham 组相比,MCAO 组突触数量变少(P<0.05),密度变低,与MCAO 组相比,MNES 组突触数量增多(P< 0.01),密度增高,见图6。
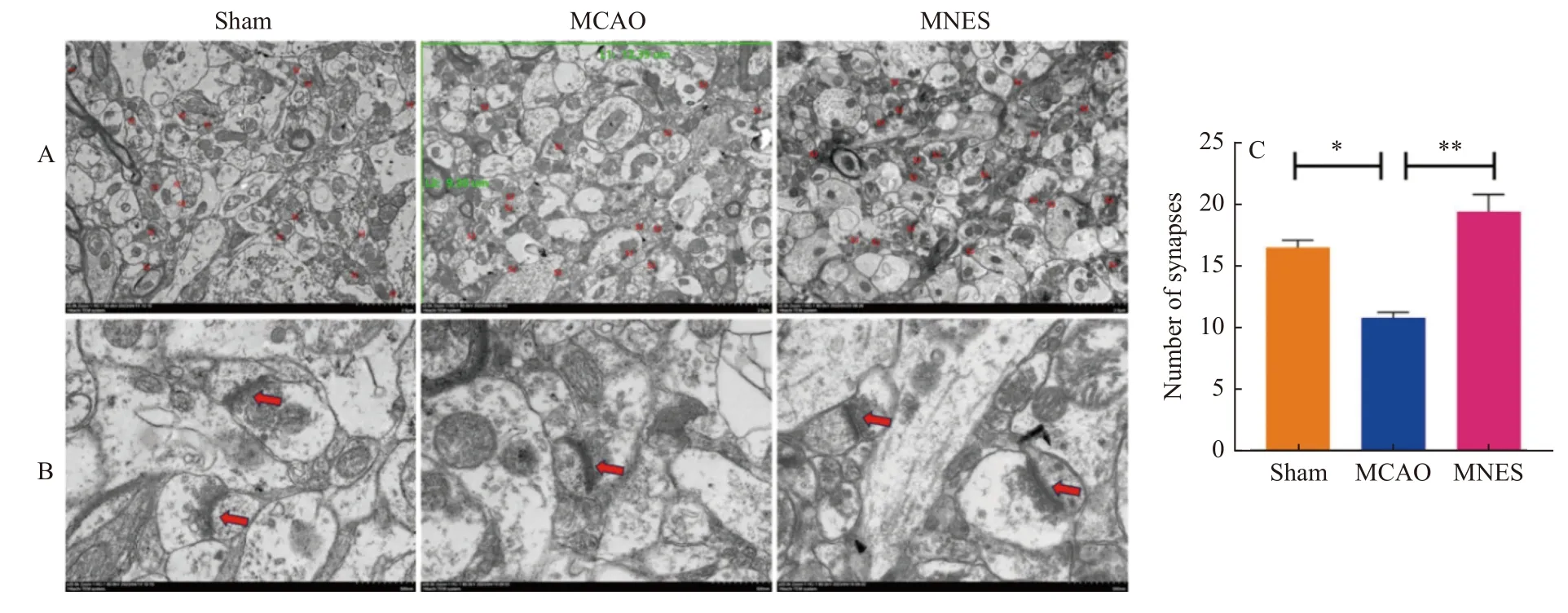
图6 正中神经电刺激对缺血性脑卒中大鼠突触可塑性的影响Fig.6 Effect of median nerve electrical stimulation on synaptic plasticity in ischemic stroke rats
3 讨论
脑卒中是由于脑血管发生急性血流中断或血管性病变引起的,尽管在脑卒中发作后的几个小时内通过静脉溶栓或机械取栓可及时恢复血流,但许多患者因错过治疗时间窗而导致严重的神经功能障碍[6]。由于神经系统具有可塑性,大脑有能力在残留的神经元之间重组新的连接,以补偿或修复受损的神经元[7]。研究发现,在脑卒中后3 个月内对患者及时进行康复训练可显著增强神经系统可塑性并促进神经功能修复[8]。本研究在大鼠脑缺血再灌注损伤后第3 天开始进行正中神经电刺激治疗,治疗后脑卒中大鼠受损的神经功能及运动功能显著改善,由此可见,在早期制定有效的康复方案以促进神经系统可塑性对脑卒中患者的功能修复具有重要意义。同时,笔者发现在治疗7 次后即大鼠脑缺血损伤后第17 天,MCAO 组损伤侧皮层中脑源性神经营养因子的表达量与Sham 组相比差异无统计学意义(P> 0.05),这也提示,在缺血损伤后,神经系统具有自我修复能力。
突触是神经细胞间进行电信号和化学信号传递的关键部位,是学习、记忆等高级神经功能的生物学基础。当神经系统受到损伤后,突触会在结构和功能上发生变化,从而维持神经功能的相对稳定,这些变化也被称为突触可塑性[9]。研究发现,百会穴和神庭穴电针可通过调节海马CA1区突触-树突可塑性,来改善缺血性脑卒中大鼠的认知障碍,并控制树突棘的数量、大小和形状[10]。突触可塑性相关蛋白的表达异常与脑卒中后神经功能的修复密切相关,在分子水平研究突触可塑性的改变,对深入了解脑卒中的发病机制以及探寻有效治疗脑卒中的关键靶点具有重要意义。在兴奋性突触的成熟和突触接触的稳定过程中,突触素相关蛋白I(SynI)和突触后致密蛋白(PSD95)发挥了关键作用,它们被认为是突触可塑性的重要指标[11]。在本研究中,SynI 和PSD95的表达在给予脑卒中大鼠正中神经电刺激治疗后显著上调,同时半影区的突触数量增多,提示缺血性脑卒中后正中神经电刺激促进了部分神经网络的重新连接。
正中神经电刺激是一种在周围神经系统施加电流的物理因子治疗技术,具安全性高、简便易操作、经济易推广等的优点,已广泛应用于临床上颅脑外伤昏迷促醒、脑卒中认知功能改善、帕金森病治疗等[12]。众所周知,手部特别是大拇指在大脑皮层运动代表区的面积远大于躯体其他部位,而支配大拇指的神经就是正中神经,正中神经也被认为是与中枢神经系统联系的外周门户[13],因此对正中神经进行电刺激,可以在大脑皮层引发广泛的神经反应,进一步产生明显的治疗效果。正中神经电刺激在治疗脑卒中上展现出巨大潜力,临床研究发现,对脑卒中后认知功能障碍患者进行正中神经电刺激治疗后,患者的神经功能和认知功能显著改善,患者的生活质量显著提高[14]。另有学者将正中神经电刺激与中医理论结合起来,从解剖位置上看,内关穴在正中神经的走形上,Lee 等[15]将内关穴作为插入针灸针进行正中神经电刺激标准位置,建立了内关穴正中神经电刺激的动物模型,并发现其治疗神经性疼痛方面的效果强于单独内关穴刺激组和通过内关穴并未刺激正中神经组。本课题组前期临床研究也发现,在B 超引导下直接对正中神经进行电刺激是安全有效的,可促进脑卒中患者上肢运动功能的恢复,同时检测到患者血清中的 BDNF 表达上调[16],但其作用机制仍不清楚,且在治疗剂量、频率、疗程的选择上仍有待探索。
综上所述,本研究通过大脑中动脉闭塞动物模型证明了正中神经电刺激是改善脑卒中后受损神经功能安全有效的治疗措施,其作用机制与促进突触可塑性有关。但本实验主要从动物行为学检测及脑组织形态学检测进行验证,后续仍需深入探究正中神经电刺激促进缺血性脑卒中大鼠突触可塑性的相关分子机制,以期为临床上正中神经电刺激改善脑卒中患者功能障碍及正中神经电刺激的应用推广提供理论依据。

