蟾毒灵联合索拉非尼通过RhoA/ROCK/HIF1α通路抑制肝癌HepG2细胞增殖、迁移及侵袭的机制
王一同,尹 玲,勾春燕,张丽丽,汪晓军
(1. 首都医科大学附属北京佑安医院,北京 100069;2. 中国中医科学院广安门医院,北京 100053)
原发性肝癌起病隐匿,复发转移率和病死率高。2020年GLOBOCAN数据显示,原发性肝癌发病率居所有恶性肿瘤的第6位,是第3大癌症死亡原因[1]。索拉非尼为一种小分子多激酶抑制剂,是第一个批准用于治疗晚期肝细胞癌的靶向药物,其作用靶点为血管内皮细胞生长因子受体、血小板衍生生长因子受体等,通过直接抑制肿瘤生长和肿瘤血管新生达到抗肿瘤的作用。尽管索拉非尼可使晚期肝癌患者生存获益,但在临床实践中,耐药及病情进展仍不可避免[2]。因此,寻求靶向药物的联合治疗方案,延缓病情进展是临床工作的重中之重。蟾毒灵是中药蟾酥的提取物,具有清热解毒、化瘀溃坚、利水消肿等作用,对肝癌、胃癌、膀胱癌等多种恶性肿瘤具有显著抗癌作用[3]。目前研究发现, Ras同源基因蛋白A(RhoA)/含Rho关联卷曲螺旋蛋白激酶(ROCK)/缺氧诱导因子1α (HIF1α)信号通路是肿瘤缺氧微环境激活的关键通路,该通路的激活可促进肝癌的侵袭、转移[4-7]。而华蟾素注射液可通过抑制 HIF1α 的表达逆转肿瘤缺氧微环境[8],蟾毒灵作为华蟾素注射液中的主要抗肿瘤活性成分,结构明确,更利于研究开发。故本研究基于Rho/ROCK/HIF1α信号通路探讨了蟾毒灵与索拉非尼对肝癌HepG2细胞增殖、迁移及侵袭的协同抑制作用及机制,以期优化中晚期肝癌联合治疗方案,提高临床疗效。
1 实验材料与方法
1.1细胞株 人肝癌HepG2细胞株,购于中国医学科学院基础医学研究所细胞资源库。
1.2药品与主要试剂 蟾毒灵,AbMole公司,货号:M11138;索拉非尼,AbMole公司,货号:BAY 43-9006。H-DMEM 基础培养基、青链霉素双抗,美国Hyclone公司;胎牛血清(FBS)、胰蛋白酶消化液(0.25%),美国Gibco公司;CCK-8试剂盒,日本同仁化工有限公司;RIPA裂解液、蛋白酶抑制剂、BCA蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒、ECL超敏发光试剂盒,北京普利莱基因技术有限公司;兔抗一抗RhoA、ROCK1、ROCK2、HIF1α,Proteintech公司。
1.3常规细胞培养方法 肝癌HepG2细胞接种于H-DMEM完全培养基(含10%FBS、100 IU/mL青霉素、100 μg/mL链霉素),37 ℃、5% CO2体积分数细胞培养箱中培养。细胞贴壁生长,每2d传代1次。
1.4CCK-8细胞增殖实验 取对数生长期的HepG2细胞,消化、重悬,以1×104/孔浓度将细胞接种于96孔板中;设置调零组、空白对照组、不同浓度给药组(蟾毒灵1,2,4,8,16 μg/mL;索拉非尼1,5,10,20,40 μmol/L),板四周的孔不种细胞,加入PBS减少培养液挥发;96孔板在细胞培养箱中过夜,待细胞贴壁,分别向各组细胞加入相应培养基200 μL,培养24 h,弃掉各组培养液上清,重新加入100 μL含有10% CCK-8溶液的完全培养基,培养箱避光培养2 h后,酶标仪测定450 nm的吸光度(OD值),绘制增殖曲线。
1.5Transwell细胞迁移、侵袭实验
1.5.1细胞迁移实验 将肝癌HepG2细胞分为空白对照组(不进行任何处理)、蟾毒灵组、索拉非尼组、蟾毒灵联合索拉非尼组,按实验分组每瓶细胞加入5 mL含蟾毒灵、索拉非尼、蟾毒灵联合索拉非尼的DMEM基础培养基,培养24 h。弃去无血清培养基,消化、离心,重悬细胞;取上述细胞悬液200 μL(约含5×104细胞)逐滴加入小室,另取200 μL富含血清的培养基沿孔壁的空隙处加入到孔中,勿误加入小室内。将接种好的细胞常规培养24 h。将小室取出,弃去孔中培养基,上室中加入200 μL 4%多聚甲醛细胞固定液,将小室置于已加入500 μL 0.1%结晶紫染色液的培养孔中,染色20 min。将小室移入新的培养孔,PBS洗3次,湿棉签擦去小室内部未穿过上室膜的细胞。倒置显微镜观察穿过上室膜的细胞数,光镜下计数3个视野的细胞数,取平均值。
1.5.2细胞侵袭实验 将Matrigel基质胶与DMEM基础培养基按1∶8比例混匀,吸取50 μL,平铺于Transwell小室底部聚碳酸酯膜上,小室放入37 ℃培养箱2 h待基质胶凝固。余步骤同细胞迁移实验。
1.6RhoA/ROCK /HIF1α通路相关蛋白表达Western blot检测 将肝癌HepG2细胞分为空白对照组(不进行任何处理)、蟾毒灵组、索拉非尼组、蟾毒灵联合索拉非尼组,按实验分组每瓶细胞加入5 mL含蟾毒灵、索拉非尼、蟾毒灵联合索拉非尼的DMEM基础培养基,培养24 h后,收集各组细胞,加入RIPA细胞裂解液(内含蛋白酶抑制剂)冰上裂解;BCA蛋白浓度测定;取总蛋白量相等的样品进行 SDS-聚丙烯酰胺凝胶电泳;PVD膜电转;5%脱脂牛奶室温封闭1 h;稀释一抗( HIF1α 1∶81 000,RhoA 1∶81 000,ROCK1 1∶85 000,ROCK2 1∶82 000),孵育一抗4 ℃过夜;TBST缓冲液室温清洗3次;加入二抗(稀释比例1∶810 000)室温孵育1 h,TBST室温清洗3次;ECL试剂盒显色;Image J软件进行分析。
1.7统计学方法 采用SPSS 23.0软件进行统计分析。计量资料采用Shapiro-Wilks(W)方法进行正态分布检验,符合正态分布的数据多组间样本均数比较采用单因素方差分析,两两多重比较采用LSD-t方法;不符合正态分布的数据组间差异采用对应的非参数检验;检验水准α=0.05(双尾)。
2 结 果
2.1肝癌HepG2细胞增殖情况 蟾毒灵及索拉非尼单药均可抑制肝癌HepG2细胞的增殖。蟾毒灵作用24 h的IC50为3.866 μg/mL,索拉非尼作用24 h的IC50为20.173 μmol/L。为避免药物浓度过高对细胞活力的影响,后续实验干预浓度蟾毒灵为4 μg/mL、索拉非尼为20 μmol/L。见图1。
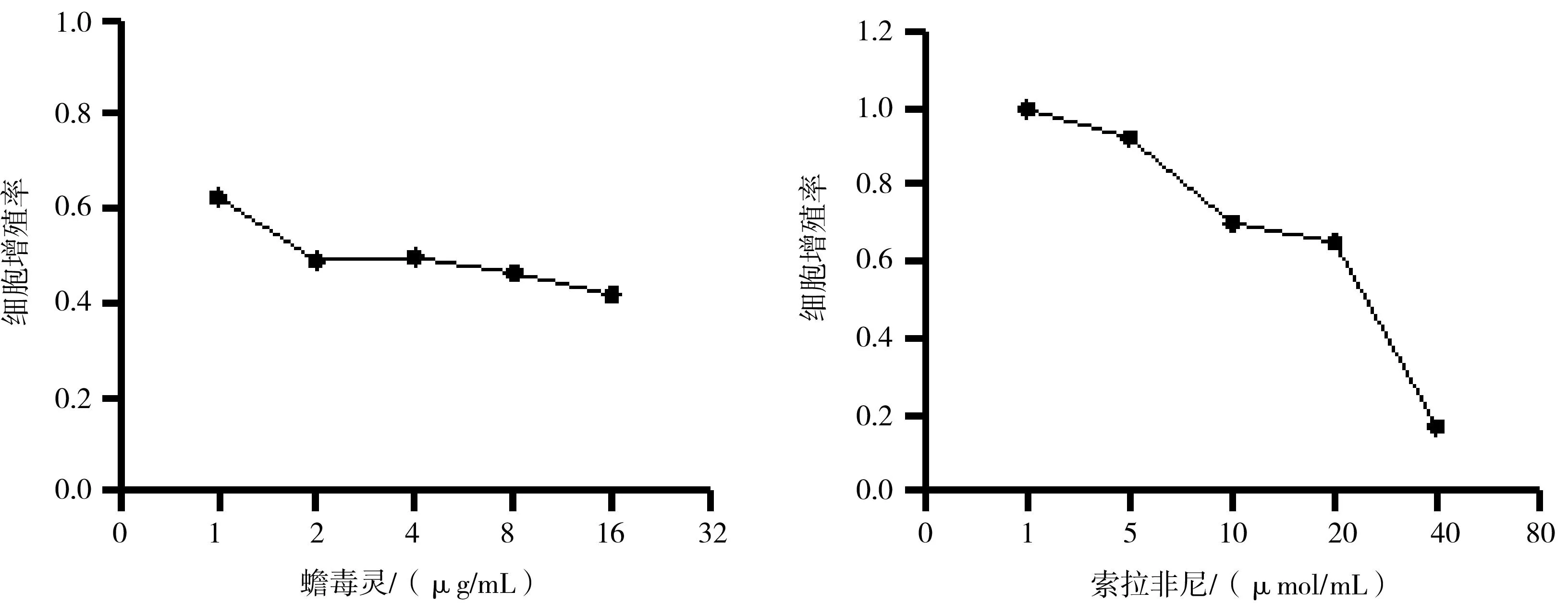
图1 蟾毒灵及索拉非尼对肝癌HepG2细胞增殖的影响
2.2肝癌HepG2细胞迁移、侵袭情况 培养24 h后,蟾毒灵组、索拉非尼组及蟾毒灵联合索拉非尼组肝癌HepG2细胞的迁移与侵袭率均明显低于空白对照组(P均<0.05),且蟾毒灵联合索拉非尼组肝癌HepG2细胞的迁移与侵袭率均明显低于蟾毒灵组和索拉非尼组(P均<0.05)。见图2。

图2 空白对照组和各药物干预组肝癌HepG2细胞迁移、侵袭情况
2.3RhoA/ROCK /HIF1α通路相关蛋白表达情况培养24 h后,索拉非尼组和蟾毒灵联合索拉非尼组肝癌HepG2细胞中RhoA、ROCK1、ROCK2、HIF1α蛋白相对表达量均明显低于空白对照组(P均<0.05),且蟾毒灵联合索拉非尼组各蛋白相对表达量均明显低于蟾毒灵组和索拉非尼组(P均<0.05);蟾毒灵组各蛋白相对表达量与空白对照组比较差异均无统计学意义(P均>0.05)。见图3。
3 讨 论
蟾毒灵是从中药蟾酥中提取的主要活性单体之一。《本草纲目》记载:“蟾酥治发背疔疮,一切恶肿。”《本草汇言》记载:“蟾酥疗疳积,消臌胀,解疔毒之药也,能化解一切瘀郁壅滞诸疾,如积毒、积块、积脓、内疔痈肿之证,有攻毒拔毒之功也。”可见在古时人们就意识到蟾酥抗恶性疮疡、癌肿的作用。基础研究发现,蟾毒灵可抑制鸡胚尿囊膜模型的血管生成,抑制内皮细胞参与的芽生性血管新生[9]。Wang等[10]研究发现,蟾毒灵能够通过调控Akt/VEGF信号增强索拉非尼的抗内皮细胞参与的血管生成。可见,抗血管生成是蟾毒灵与索拉非尼发挥协同抗肿瘤作用的重要机制。
肿瘤缺氧微环境是促进肿瘤血管新生的重要激发因素,HIF1α在肿瘤细胞对缺氧微环境的适应性反应中起到重要作用。既往研究发现,缺氧环境培养显著增强了HepG2细胞的成管能力,同时增加了Notch1和血管内皮钙黏蛋白的表达,还可诱导 Bcl-2和Twist1共表达,在体外和体内均能增强肝癌细胞的上皮间质转化(EMT)过程和促进血管新生[11-12]。任光明[13]研究发现,华蟾素联合放化疗治疗晚期肺癌患者,可显著降低血清HIF1α水平,抑制肿瘤血管新生。本研究发现,蟾毒灵联合索拉非尼对HIF1α的表达亦有明显抑制作用,逆转肿瘤缺氧微环境可能是蟾毒灵联合索拉非尼协同抑制肝癌细胞侵袭、转移的机制之一。
ROCK1、ROCK2是RhoA的下游靶点,ROCK是肿瘤细胞血管生成拟态形成的关键因子[14]。杨锦秀[15]研究发现,RhoA/ROCK信号通路能通过干预AngⅡ的表达发挥对体外血管形成的抑制作用;奚娇娇[16]报道,黄酮类化合物能通过抑制RhoA/ROCK信号通路改善脑缺氧缺血损伤;梅晓峰[17]研究发现,麝香乌龙丸能通过干预RhoA/ROCK信号通路,减轻机体微血管屏障的损伤。ROCK2作为HIF1α的上游,参与HIF1α在缺氧条件下的调控,RhoA/ROCK2信号通路通过HIF1α稳定和EMT激活p-Vimentin (Ser72和56)参与缺氧诱导的肝癌血管新生[4],抑制RhoA/ROCK信号通路,能够抑制肝癌细胞的生长、转移及血管生成拟态的形成[18-19]。本实验结果显示,蟾毒灵单独用药时并未表现出对RhoA/ROCK/HIF1α通路相关靶点的抑制作用,联合索拉非尼后则表现出显著的抑制作用,且比索拉非尼单药用药抑制作用增强。提示蟾毒灵联合索拉非尼抑制肝癌细胞增殖、迁移及侵袭的机制可能为通过下调RhoA、ROCK1、ROCK2表达,抑制HIF1α的激活,从而逆转肿瘤缺氧微环境对肝癌细胞的影响,最终抑制肝癌的复发转移。
综上所述,蟾毒灵联合索拉非尼抗肝癌HepG2细胞增殖、迁移及侵袭的作用与调控RhoA/ROCK/HIF1α信号通路有关,为中晚期肝癌联合诊疗提供了基础研究依据,然而尚需开展体内实验研究,对蟾毒灵联合索拉非尼抑制肝癌复发转移的机制进行进一步验证。
利益冲突:所有作者均声明不存在利益冲突。

