桃红四物汤对糖尿病视网膜病变引起的细胞损伤及HIF-1α表达的影响
王 磊,俞 莹,陆 萍,程燕妮,李沭岩
(1. 上海中医药大学附属第七人民医院,上海 200137;2. 上海中医药大学附属曙光医院,上海 201203;3. 上海广德中医门诊部,上海 200125)
糖尿病视网膜病变(DR)是糖尿病引起的微血管并发症之一,也是糖尿病患者致盲的主要原因[1]。DR的主要病理过程是视网膜微血管内皮细胞功能障碍[2]。研究认为,视网膜微血管内皮细胞是糖尿病诱导血管损伤的主要细胞靶点,其在不同血糖控制情况、不同糖尿病持续时间、有无DR的糖尿病患者中,数量和功能均存在差异[3]。因此,减轻视网膜微血管内皮细胞损伤将有助于延缓或阻止DR的病理进程。桃红四物汤出自清代吴谦所著的《医宗金鉴》,由桃仁、红花、川芎、当归、白芍、熟地黄组成,是活血化瘀之经典名方,被广泛应用于血瘀诸证的治疗,近年来也有很多医者将其用于DR的治疗,取得了良好的疗效[4-7],但其作用机制尚不清楚。前期本课题组根据网络药理学分析发现,桃红四物汤可能通过调节缺氧诱导因子-1(HIF-1)信号通路来改善DR疾病状态[8]。在本研究中,课题组利用高糖诱导人视网膜微血管内皮细胞(hREMCs)构建DR模型,考察了桃红四物汤对hREMCs的保护作用,同时探讨了其是否通过调节HIF-1α的表达来发挥这一作用。
1 实验材料与方法
1.1动物 SPF级雄性SD大鼠20只,体重200~220 g,购于维通利华实验技术有限公司,动物生产许可证号:SCXK(京)2016-0006。动物饲养环境维持12 h光照/12 h黑暗的昼夜节律,温度(25±2)℃,自由摄食、饮水。
1.2药物 桃红四物汤,正常成年人(60 kg)每剂桃红四物汤方药组成为熟地黄12 g、白芍12 g、当归10 g、川芎8 g、桃仁9 g、红花6 g。取10倍量的桃红四物汤煎煮2次,合并收集滤液,旋转蒸发仪浓缩制备成桃红四物汤提取液(含生药量约为2 g/mL)。根据大鼠与人之间药物用量等比计算方法,大鼠剂量(g/kg)=人剂量(g/kg)×(人的转换因子/大鼠的转换因子)。SD大鼠是人剂量的6.3倍,即SD大鼠每天等效剂量下应服用6 g/kg桃红四物汤生药。据此,以6 g/kg为中剂量,以3 g/kg和12 g/kg为低、高剂量。
1.3细胞及试剂 hRMECs,上海富衡生物科技有限公司。胎牛血清,美国GIBCO公司;DMEM培养基,美国Hyclone公司;青链霉素混合液(100X)、胰蛋白酶-EDTA消化液(0.25%)、结晶紫,索莱宝科技有限公司(北京);Matrigel胶,美国Corning公司;血管内皮生长因子(VEGF) ELISA试剂盒,上海碧云天生物技术有限公司;SDS,伯乐生命医学产品有限公司(上海);甲醛、磷酸二氢钾、氯化钾、盐酸、碳酸氢铵,国药集团化学试剂有限公司;BCA蛋白定量试剂盒,德国MERCK公司;HIF-1α抗体、GAPDH抗体,美国CST公司。
1.4含药血清制备方法 将20只大鼠随机分为4组:桃红四物汤低、中、高剂量组分别给予3 g/kg、6 g/kg、12 g/kg的桃红四物汤灌胃,空白组给予等量生理盐水灌胃,均1次/d,连续7 d。末次灌胃1 h后,水合氯醛腹腔注射麻醉大鼠,经腹主动脉穿刺法采集各组大鼠全血。室温静置1 h后,3 000 r/min离心10 min,分离上清液,将同组大鼠血清混合,56 ℃水浴中灭活20 min,0.22 μm孔径的微孔滤膜过滤除菌,分装至5 mL离心管中。最终得到空白血清和低、中、高剂量桃红四物汤含药血清,保存于-80 ℃冰箱中备用。
1.5细胞培养方法 采用含10%胎牛血清、1%双抗(青链霉素混合液)的DMEM培养液,置于37 ℃,5% CO2的培养箱中培养hRMECs,显微镜下观察细胞为贴壁细胞,台盼蓝染色活细胞率≥95%。取对数生长期的hRMECs,胰酶消化、重悬,计数后按照实验要求数量接种至培养板,继续培养用于后续实验。
1.6实验方法
1.6.1实验一 实验分为5组:将贴壁的细胞饥饿24 h后,空白对照组加入含5 mmol/L葡萄糖的低糖培养基培养,高糖模型组加入含30 mmol/L葡萄糖的高糖培养基培养,桃红四物汤低、中、高剂量组分别加入含30 mmol/L葡萄糖的高糖培养基和相应浓度桃红四物汤含药血清培养,培养24 h后,通过Transwell和划痕实验检测细胞的侵袭和迁移能力,血管生成实验检测细胞的成管能力,ELISA试剂盒检测细胞中VEGF水平,Western blot法检测细胞中HIF-1α蛋白表达情况。
1.6.1.1Transwell实验方法 选择生长状态良好的细胞,胰蛋白酶消化,用不含血清的培养基制成单细胞悬液,稀释细胞悬液到3×105个/mL,小室上层加入0.3 mL细胞悬液,小室下层加入0.7 mL含血清培养基。各组进行相应干预,侵袭实验干预48 h,迁移实验干预24 h。使用4%多聚甲醛固定10 min,0.5%结晶紫染色30 min。使用倒置显微镜(×100)随机选择3个独立视野进行拍照计数。
1.6.1.2划痕实验方法 选择生长状态良好的细胞,消化重悬并计数,以1×106个/孔均匀铺于6孔板中,待细胞铺满板底时,用无菌枪头在每个孔内划十字线。各组进行相应干预,分别在0 h、12 h、24 h使用倒置显微镜(×200)在同一位置进行拍照,测量划痕面积。
1.6.1.3血管生成实验方法 实验前将保存在-20 ℃的基质胶转移至4 ℃冰箱融化过夜,接种前在12孔板中铺120 μL matrigel胶,37 ℃培养箱中放置30 min使其凝固。选择生长状态良好的细胞,消化重悬并计数,以2×105个/孔均匀铺于12孔板中,各组进行相应干预,使用倒置显微镜(×100)随机选择3个独立视野进行拍照计数。
1.6.1.4ELISA检测方法 待不同处理方式的细胞干预结束后,取细胞培养上清液,在4 ℃下6 000 r/min离心10 min,吸取上清液,按照ELISA试剂盒说明书检测VEGF水平。
1.6.1.5Western blot检测方法 待不同处理方式的细胞干预结束后,向细胞中加入细胞裂解液(RI-PA,含1%蛋白酶抑制剂PMSF)进行裂解30min,4 ℃下12 000 r/min离心15 min,提取总蛋白,BCA法蛋白定量。各组上样40 μg蛋白进行SDS-PAGE凝胶电泳,湿转至PVDF膜,5%脱脂奶粉室温封闭1 h;一抗HIF-1α(稀释浓度1∶1 000)或GAPDH(稀释浓度1∶1 000)于4 ℃摇床孵育过夜,TBST洗膜3次;对应二抗(稀释浓度1∶2 000)于室温摇床孵育1 h,TBST洗膜3次;使用ProteinSimple凝胶成像系统扫描拍照,FluorChem FC3软件分析统计。
1.6.2实验二 为考察桃红四物汤是否通过HIF-1α对hRMECs起作用,首先构建HIF-1α过表达细胞模型,并对细胞中HIF-1α蛋白表达水平进行检测,验证HIF-1α过表达细胞模型是否构建成功,然后分组考察HIF-1α过表达对桃红四物汤的功能回复作用。①HIF-1α过表达建模方法:采用慢病毒系统,从含有HIF-1α基因的质粒中利用PCR方法获取目的基因,将目的基因载体进行酶切,酶切产物电泳回收后进行交换,再用其产物转化感受态细胞。将长出的克隆进行菌落PCR鉴定后,再对PCR鉴定阳性的克隆进行测序和对比分析,从而获得稳定表达HIF-1α的慢病毒载体。随后,将制备好的HIF-1α过表达慢病毒载体以及病毒包装辅助质粒共转染293T细胞,收集富含慢病毒颗粒的细胞上清液,对其浓缩后最终得到高滴度的慢病毒浓缩液。采用高滴度的慢病毒浓缩液,将外源性HIF-1α质粒转染至hRMECs,经过流式细胞分选,建立HIF-1α过表达模型。②实验分为4组:将贴壁的细胞饥饿24 h后,空白对照组加入含5 mmol/L葡萄糖的低糖培养基培养,高糖模型组加入含30 mmol/L葡萄糖的高糖培养基培养,桃红四物汤组加入含30 mmol/L葡萄糖的高糖培养基和高剂量桃红四物汤含药血清培养(根据前述实验结果,高剂量桃红四物汤含药血清对hRMECs的改善作用最佳,因此选择高剂量培养),桃红四物汤+HIF-1α过表达组采用HIF-1α过表达的hRMECs细胞加30 mmol/L葡萄糖和高剂量桃红四物汤含药血清培养,再次进行细胞的侵袭和迁移能力、成管能力及细胞中VEGF水平和HIF-1α蛋白表达检测。
1.7统计学方法 采用SPSS 21.0软件进行数据统计学分析,选用One-Way ANOVA进行多组间比较方差分析,Dunnett法进行多重比较,P<0.05为差异有统计学意义。
2 结 果
2.1不同剂量桃红四物汤含药血清对hRMECs的影响
2.1.1各组hRMECs侵袭、迁移能力 高糖模型组的侵袭细胞数量、迁移细胞数量均明显多于空白对照组(P均<0.05)。桃红四物汤各组的侵袭细胞数量、迁移细胞数量呈现剂量依赖性减少,但各组间比较差异均无统计学意义(P均>0.05),其中桃红四物汤中、高剂量组的侵袭细胞数量、迁移细胞数量均明显少于高糖模型组(P均<0.05)。见图1及图2。

图1 空白对照组和高糖诱导各组人视网膜微血管内皮细胞侵袭能力
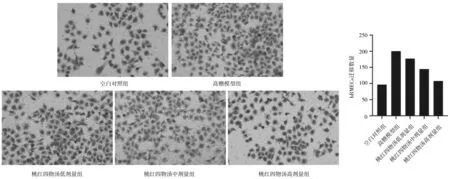
图2 空白对照组和高糖诱导各组人视网膜微血管内皮细胞迁移能力
2.1.2各组hRMECs迁移面积 干预12 h时,高糖模型组的细胞未迁移面积明显小于空白对照组(P<0.05);桃红四物汤各组的细胞未迁移面积与高糖模型组比较差异均无统计学意义(P均>0.05)。干预24 h时,高糖模型组的细胞未迁移面积显著小于空白对照组(P<0.05);桃红四物汤高剂量组的细胞未迁移面积明显大于高糖模型组(P<0.05),桃红四物汤低、中剂量组的细胞未迁移面积与高糖模型组比较差异均无统计学意义(P均>0.05)。见图3。
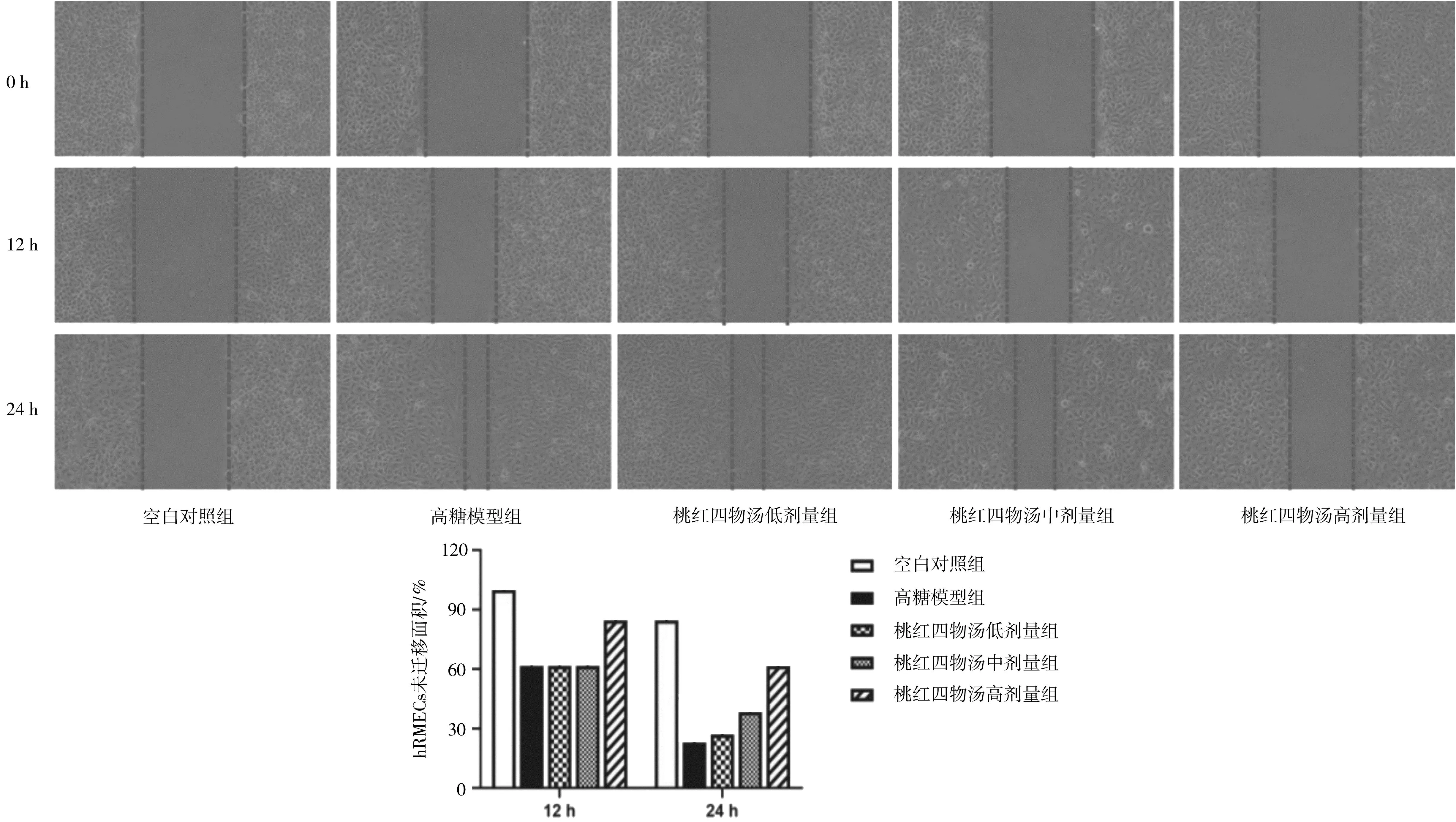
图3 空白对照组和高糖诱导各组人视网膜微血管内皮细胞迁移情况
2.1.3各组hRMECs血管生成情况 高糖模型组的成管数量明显多于空白对照组(P<0.05)。桃红四物汤各组的成管数量呈现剂量依赖性减少,但各组间比较差异均无统计学意义(P均>0.05),其中桃红四物汤高剂量组的成管数量明显少于高糖模型组(P<0.05),桃红四物汤低、中剂量组与高糖模型组比较差异均无统计学意义(P均>0.05)。见图4。

图4 空白对照组和高糖诱导各组人视网膜微血管内皮细胞血管生成情况
2.1.4各组hRMECs中VEGF水平 高糖模型组中VEGF水平明显高于空白对照组(P<0.05)。桃红四物汤各组中VEGF水平呈现剂量依赖性降低,但各组间比较差异均无统计学意义(P均>0.05),其中桃红四物汤中、高剂量组中VEGF水平均明显低于高糖模型组(P均<0.05)。见图5。

图5 空白对照组和高糖诱导各组人视网膜微血管内皮细胞中VEGF水平
2.1.5各组hRMECs中HIF-1α蛋白表达情况高糖模型组中HIF-1α蛋白相对表达量明显高于空白对照组(P<0.05)。桃红四物汤各组中HIF-1α蛋白相对表达量呈剂量依赖性降低,但各组间比较差异均无统计学意义(P均>0.05),其中桃红四物汤中、高剂量组均明显低于高糖模型组(P均<0.05)。见图6。
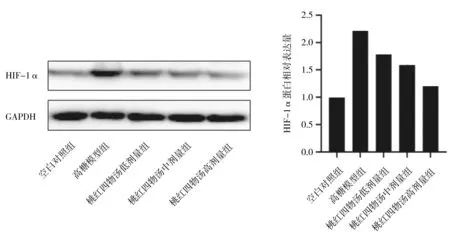
图6 空白对照组和高糖诱导各组人视网膜微血管内皮细胞中HIF-1α蛋白表达情况
2.2桃红四物汤通过HIF-1α对hRMECs的影响
2.2.1各组hRMECs侵袭、迁移能力 高糖模型组的侵袭细胞数量、迁移细胞数量均明显多于空白对照组(P均<0.05)。桃红四物汤组的侵袭细胞数量、迁移细胞数量均明显少于高糖模型组(P均<0.05),桃红四物汤+HIF-1α过表达组的侵袭细胞数量、迁移细胞数量均明显高于桃红四物汤组(P均<0.05)。见图7及图8。

图7 空白对照组和高糖诱导各组人视网膜微血管内皮细胞侵袭能力

图8 空白对照组和高糖诱导各组人视网膜微血管内皮细胞迁移能力
2.2.2各组hRMECs迁移面积 干预12 h和24 h时,高糖模型组的细胞未迁移面积均明显小于空白对照组(P均<0.05)。干预12 h时,桃红四物汤组、桃红四物汤+HIF-1α过表达组的细胞未迁移面积与高糖模型组比较差异均无统计学意义(P均>0.05);干预24 h时,桃红四物汤组的细胞未迁移面积明显大于高糖模型组(P<0.05),桃红四物汤+HIF-1α过表达组的细胞未迁移面积明显小于桃红四物汤组(P<0.05)。见图9。
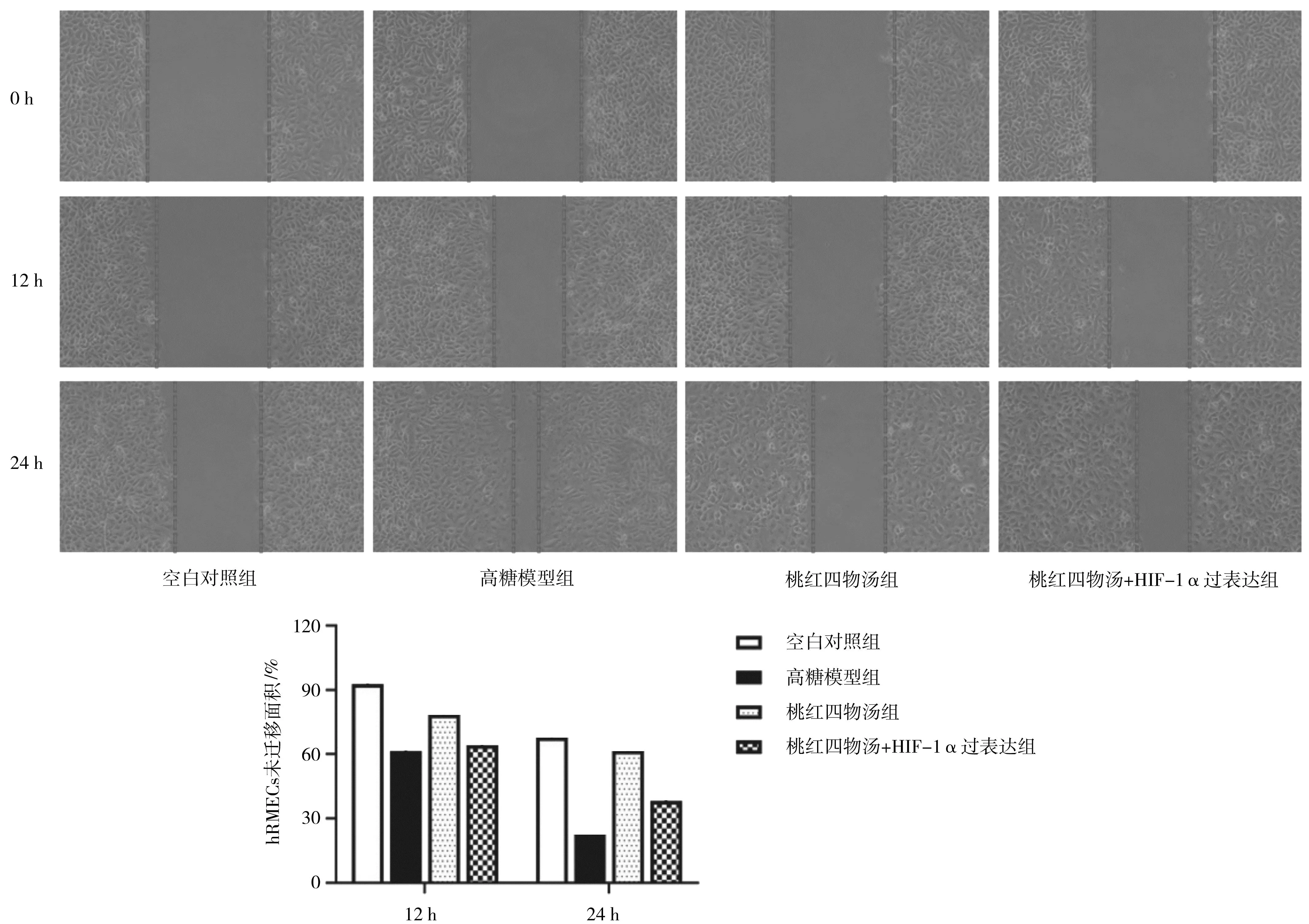
图9 空白对照组和高糖诱导各组人视网膜微血管内皮细胞迁移情况
2.2.3各组hRMECs血管生成情况 高糖模型组的成管数量明显多于空白对照组(P<0.05);桃红四物汤组的成管数量明显少于高糖模型组(P<0.05);桃红四物汤+HIF-1α过表达组的成管数量有高于桃红四物汤组的趋势,但差异无统计学意义(P>0.05)。见图10。

图10 空白对照组和高糖诱导各组人视网膜微血管内皮细胞血管生成情况
2.2.4各组hRMECs中VEGF水平 高糖模型组中VEGF水平明显高于空白对照组(P<0.05);桃红四物汤组中VEGF水平明显低于高糖模型组(P<0.05),桃红四物汤+HIF-1α过表达组中VEGF水平明显高于桃红四物汤组(P<0.05)。见图11。

图11 空白对照组和高糖诱导各组人视网膜微血管内皮细胞中VEGF水平
2.2.5各组hRMECs中HIF-1α蛋白表达情况高糖模型组中HIF-1α蛋白相对表达量明显高于空白对照组(P<0.05);桃红四物汤组中HIF-1α蛋白相对表达量明显低于高糖模型组(P<0.05),桃红四物汤+HIF-1α过表达组中HIF-1α蛋白相对表达量明显高于桃红四物汤组(P<0.05)。见图12。

图12 空白对照组和高糖诱导各组人视网膜微血管内皮细胞中HIF-1α表达情况
3 讨 论
视网膜微血管系统可维持正常视力所必需的血-视网膜屏障功能,hRMECs是参与DR等许多眼部疾病的主要细胞类型之一,hRMECs细胞损伤在DR病理进程中发挥关键作用[3]。有研究发现,高血糖是微血管损伤的重要原因,可通过不同机制导致hRMECs功能障碍,引起血管壁削弱且内皮细胞异常增殖,促进血管渗漏和功能不全,进而引起正常血管的失衡和异常新生血管的形成,最终导致出血、牵拉性视网膜脱离,甚至视力丧失[9]。因此,本研究通过高糖诱导hRMECs异常侵袭迁移、小管形成等,导致hRMECs细胞损伤,以此模拟DR在体外的病理状态。
中医根据不同临床症状将DR称之为“视瞻昏渺”“云雾移睛”“暴盲”[10],归属于络病范畴。糖尿病久病入络加之目络幽深纤细,导致络中瘀血形成,络虚血瘀是DR的基本病机,瘀血贯穿DR始终,是DR病情发展加重的重要影响因素[11-12]。桃红四
物汤全方养血而不滞血,活血而不破血,补中有行,破中有收,诸药合用,达到活血行气、扶正祛邪之功效[13]。本实验发现,桃红四物汤能够抑制高糖诱导的hRMECs异常侵袭、迁移和血管生成能力,减轻高糖引起的细胞损伤,从细胞水平上证实了桃红四物汤对DR的改善作用。
HIF-1α的表达水平是衡量DR疾病进程的重要指标[14]。研究表明,长期高血糖与缺氧是DR发生发展的重要因素[15]。高血糖加强了多元醇代谢,引起红细胞内糖化血红蛋白含量增加,氧亲和力提高,氧解离速率降低,导致红细胞聚集加速,视网膜血流速度下降,血栓形成,视网膜组织缺氧,从而诱导了HIF-1α的表达[16]。HIF-1α进而调控下游靶基因的表达,使视网膜毛细血管通透性增加,血-视网膜屏障被破坏,新生血管形成,视网膜发生病变[17]。本研究基于前期网络药理学分析中发现的HIF-1信号通路,进一步研究了桃红四物汤对HIF-1α的调控作用。结果发现,桃红四物汤能够下调HIF-1α的表达,并且HIF-1α过表达能够抵消桃红四物汤对hRMECs的侵袭、迁移和血管生成能力的抑制作用,一定程度上说明了桃红四物汤可能通过下调HIF-1α的表达,减轻DR引起的细胞损伤。
VEGF是内皮细胞的特异性丝裂原,也是目前已知最强的血管通透剂,不仅能够提高血管通透性,还能诱导血管内皮细胞的增殖迁移[18-19]。VEGF是HIF-1α的靶基因,HIF-1α表达上调会引起VEGF转录活性和表达增强,继而诱导内皮细胞支架蛋白和黏附蛋白磷酸化,刺激视网膜色素上皮细胞之间紧密连接蛋白、闭锁蛋白的磷酸化,改变细胞连接构象,从而改变视网膜毛细血管的通透性;同时,VEGF还能促进有丝分裂素与内皮细胞受体结合,引起内皮细胞增殖并形成新生血管,改变血管渗透性,从而加快血-视网膜屏障的破坏以及DR的疾病进程[14,20]。本研究发现,桃红四物汤能够降低高糖诱导的hRMECs中VEGF的表达,推测桃红四物汤对HIF-1α的下调作用也减少了靶基因VEGF的表达,进而减轻了VEGF引起的细胞损伤。
综上所述,桃红四物汤可通过下调HIF-1α及其靶基因VEGF的表达,减轻高糖诱导的hRMECs损伤,本研究为临床中桃红四物汤治疗DR提供了实验基础和科学依据。
利益冲突:所有作者均声明不存在利益冲突。

