尿蛋白酶抑制剂治疗耐多药肺结核效果及对患者免疫状态、氧化应激的影响
李俊东,杜 娜,边卫国,窦海荣,邱洪波,RASSUL(哈萨克斯坦)
(1.西安交通大学第一附属医院麻醉科,陕西 西安 710061;2.陕西省结核病防治院内四科,陕西 西安 710105;3.陕西中医药大学,陕西 咸阳 712046)
耐多药肺结核(Multidrug-resistant tuberculosis,MDR-TB)是指至少对利福平、异烟肼同时耐药的结核分枝杆菌感染所致的肺结核[1],我国是结核病高负担国家,也是全球范围内MDR-TB病例数最高的7个国家之一,而这7个国家耐药结核病患者数(包括MDR-TB)为世界各国患者总例数的2/3[2]。MDR-TB治疗周期长,药物种类多,治疗成本高,且完成率和治愈率较低,已成为持续危害群众健康的严重的公共卫生问题[3]。尽管近年来肺结核患者利福平耐药率和耐多药率显著降低,但由于我国人口基数大,结核病耐药仍然是我国一项沉重的负担[4]。探索合理的治疗方案提高MDR-TB治疗效果,改善患者预后具有重要意义。尿蛋白酶抑制剂是从健康人尿液中提取的酶抑制剂,具有清除氧自由基、减轻氧化应激、抑制炎症反应等作用[5-6]。MDR-TB患者免疫力低下,机体内存在着明显氧化应激后的炎症反应,且对MDR-TB病情程度产生明显影响[7],因此在MDR-TB治疗中除了应用抗结核药物外,联合其他药物改善机体免疫功能、减轻氧化应激具有重要意义。目前尿蛋白酶抑制剂主要应用于重症胰腺炎、脓毒症、重症颅脑损伤等重症疾病抗炎和器官功能保护[8-10],应用于MDR-TB的临床报道不多。本研究对47例MDR-TB患者在基础抗结核分枝杆菌药物的基础上应用尿蛋白酶抑制剂,并观察该药对机体免疫状态和氧化应激的影响,以期提高MDR-TB的疗效。
1 资料与方法
1.1 一般资料 入选研究对象为本院2019年1月至2022年6月期间收治的MDR-TB患者103例,随机分为观察组(52例)和对照组(51例),治疗期间观察组有5例、对照组有4例患者脱落,两组均47例纳入研究。观察组男26例,女21例,年龄21~68岁,平均(42.62±9.43)岁;体重指数(BMI)18.7~28.6 kg/m2,平均(23.26±2.40)kg/m2;病程11个月至9年,平均(5.25±1.93)年;病灶位置:单侧16例,双侧31例;空洞情况:单侧23例,双侧15例,无空洞9例;并发肺外结核8例。对照组男29例,女18例,年龄21~71岁,平均(43.80±9.476)岁;BMI 18.4~28.3 kg/m2,平均(23.11±2.26)kg/m2;病程10个月至11年,平均(5.34±1.82)年;病灶位置:单侧18例,双侧29例;空洞情况:单侧25例,双侧11例,无空洞11例;并发肺外结核9例。两组上述一般资料比较无统计学差异(均P>0.05),具有可比性。病例纳入标准:①符合《耐药结核病化学治疗指南(2019年简版)》[11]中相关诊断标准,并经药敏实验证实为MDR-TB;②年龄>18岁;③认知功能正常,能够配合用药和随访;④自愿参加本次临床试验,并签署协议书。排除标准:①合并其他脏器或组织感染性疾病;②合并自身免疫性疾病;③心肝肾功能异常;④过敏体质;⑤妊娠或哺乳期女性;⑥合并肿瘤、血液病、精神系统疾病、其他传染病等;⑦合并肺气肿、支气管扩张、肺发育不全等其他肺部疾病;⑧入组前12周内应用激素、免疫抑制剂等药物。本研究获得医院伦理批准。
1.2 治疗方法 两组患者均接受个体化背景治疗方案。该方案参照《耐药结核病化学治疗指南(2019年简版)》[11]、《耐药结核病治疗更新版指南》[12]相关选药原则,并结合患者最近的药敏实验结果和药物耐受情况,由3位结核科副主任医师共同商讨制定。观察组在背景治疗方案基础上予以乌司他丁(批号:20181224)静脉滴注,每次10万U,每日3次,连续用药7 d。
1.3 观察指标 ①临床疗效:治疗6个月后,参照《临床诊疗指南(结核病分册)》[13]相关内容评价疗效:a为痰菌转阴情况,连续2个月痰液中结合分枝杆菌培养阴性,且不再复阳表示痰菌转阴;b为病灶吸收情况,根据治疗前后胸部CT结果评价,如病灶较前吸收≥50%为显著吸收,<50%为吸收,无明显变化计为不变,如病灶较前扩大或出现播散则计为恶化;c为空洞变化情况,如空洞消失计为闭合,如空洞直径较前减小≥50%计为缩小,无明显变化计为不变,较前增大≥50%计为增大。②实验室检查:两组受试者治疗前后均采集上午空腹静脉血8 ml,分置于2个无菌试管,一个试管不抗凝,以1000 r/min转速离心10 min,收集血清低温保存(-70 ℃)待测,酶联免疫法测定血清白细胞介素-10(Interleukin-10,IL-10)、转化生长因子-β1(Transforming growth factor-β1,TGF-β1)、降钙素原(Procalcitonin,PCT)水平,试剂盒购自美国eBioscience公司,应用Beckman Coulter AU5800型全自动生化分析仪检测血清总氧化态(Total oxidation state,TOS)、总抗氧化态(Total antioxidant state,TAS)水平,计算氧化应激指数(Oxidative stress index,OSI),OSI=TOS/TAS。另一试管为肝素钠抗凝管,流式细胞术测定外周血CD3+、CD4+、CD8+含量,应用Mutiset软件获得T淋巴细胞亚群的所占百分比,仪器应用Epics XL 型流式细胞仪(美国Beckman Coulter公司生产)。治疗前及治疗6个月后各检测一次。③安全性指标:记录两组治疗期间不良反应发生情况,比较两组不良反应发生率。
1.4 统计学方法 应用SPSS 23.0统计学软件分析数据,计量资料以均数±标准差表示,IL-10、TGF-β1、PCT、TOS、TAS、OSI、CD3+、CD4+、CD4+/CD8+组间、组内比较应用t检验;计数资料以[例(%)]表示,痰菌转阴率组间比较应用χ2检验,组间病灶吸收情况、空洞变化情况比较应用秩和检验;P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床疗效比较 治疗6个月后,观察组痰菌转阴率高于对照组(P<0.05),病灶吸收情况和空洞变化情况均优于对照组(均P<0.05),见表1。

表1 两组患者临床疗效比较[例(%)]
2.2 两组患者治疗前后外周血CD3+、CD4+、CD4+/CD8+比较 两组治疗后外周血CD3+、CD4+、CD4+/CD8+显著增加(均P<0.01),且观察组增加更明显,上述各项指标均高于对照组,两组比较差异有统计学意义(均P<0.01),见表2。
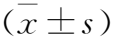
表2 两组患者治疗前后外周血CD3+、CD4+、CD4+/CD8+比较
2.3 两组患者治疗前后TOS、TAS、OSI比较 两组治疗后TAS与治疗前比较增加(P<0.01),TOS、OSI与治疗前比较降低(均P<0.01),观察组TAS高于对照组(P<0.01),TOS、OSI低于对照组(P<0.01),见表3。
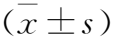
表3 两组患者治疗前后TOS、TAS、OSI比较
2.4 两组患者治疗前后血清IL-10、TGF-β1、PCT水平比较 两组治疗后血清IL-10、TGF-β1、PCT水平均显著降低(均P<0.01),观察组降低更明显,各项指标均低于对照组(均P<0.01),见表4。
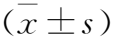
表4 两组患者治疗前后血清IL-10、TGF-β1、PCT水平比较
2.5 两组患者不良反应发生情况比较 观察组用药期间发生恶心2例,腹泻1例,肝功能异常2例,皮疹1例,不良反应发生率为12.77%(6/47),对照组用药期间出现头痛1例,肝功能异常1例,上腹部不适2例,不良反应发生率为8.51%(4/47),两组均对症处理后症状缓解,不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨 论
MDR-TB是由于结核分枝杆菌基因突变导致对抗结核药物敏感性降低,具体耐药机制复杂,耐药基因之间的相互关系也尚未阐明,因此临床尚缺乏治疗MDR-TB的特效药物[14]。目前对于MDR-TB的治疗主要应用不同的二线抗结核药物,存在着疗程长、价格昂贵、患者依从性差等不足,治疗成功率低,临床效果不理想[15]。探索更有效的药物以进一步提高MDR-TB的治疗效果是临床亟待解决的问题。
尿蛋白酶抑制剂又名乌司他丁,是由143个氨基酸残基(分子质量为67 kD)组成的一种广谱蛋白酶抑制剂,具有稳定溶酶体膜、清除氧自由基、抑制溶酶体酶和炎症介质释放等作用,并可改善组织、器官血液灌注,保护器官功能[16]。通过抑制炎症反应、抗氧化应激、调节酶的活性等多种机制治疗急性胰腺炎、器官衰竭等严重疾病[17]。本研究对47例MDR-TB患者(观察组)在个体化背景治疗方案基础上应用尿蛋白酶抑制剂7 d,经过6个月的治疗,发现痰菌转阴率、病灶吸收情况和空洞变化情况均优于对照组,且不良反应发生率与对照组比较差异无统计学意义,表明尿蛋白酶抑制剂联合其他抗结核药物,促进了耐药结核分枝杆菌的清除和结核病灶的吸收,且并未增加不良反应,是治疗方案中发挥强化作用的主要力量。研究表明,肺结核的发生除了结核分枝杆菌感染外,还与机体的免疫功能低下密切相关。而MDR-TB患者往往病程较长,患者年龄较大,机体内往往会存在着更为严重的免疫功能受损[14]。CD3+、CD4+是具有免疫保护作用的淋巴细胞亚群,而CD8+也参与CD4+细胞介导的免疫反应,溶解已吞噬的结核杆菌,并分泌γ干扰素等细胞因子拮抗结核菌感染,上述T淋巴细胞亚群是反应机体免疫功能变化有效指标。本研究发现治疗后观察组外周血CD3+、CD4+含量、CD4+/CD8+均高于对照组,与对照组比较,观察组免疫功能得到明显改善。由于两组患者均采取了多种药物联合应用,药物作用机制复杂,其改善机体免疫功能的具体机制尚需进一步探讨,分析原因可能是观察组尿蛋白酶抑制剂的应用加速了T淋巴细胞的生成和释放,免疫功能得到改善。同时,机体免疫功能增强促进肺泡细胞大量合成和分泌淋巴细胞,进而恢复免疫平衡,体内细胞免疫趋于稳定[18]。哈立新等[19]对87例呼吸机相关性肺炎患者的研究发现,尿蛋白酶抑制剂可调控T淋巴细胞亚群,改善机体免疫功能。
研究表明,MDR-TB患者体内存在着明显的炎症反应,巨噬细胞大量增殖,影响机体内抗氧化系统的生理功能,导致机体内产生严重的氧化应激损伤[20]。另外,结核分枝杆菌是一种专性需氧菌,MDR-TB患者肺泡内会释放活性氧物质,以利于结核分枝杆菌增殖,使肺组织内产生氧化应激损伤[21]。TOS、TAS分别为评估机体氧化状态和抗氧化状态的氧化应激参数,OSI综合了TOS、TAS两个指标的作用,可更精确评估机体的氧化应激状况[22]。研究表明尿蛋白酶抑制剂可激活重组与合成蛋白(Nrf2)/血红素加氧酶1的表达,调节丙二醛、髓过氧化物酶等物质的含量,发挥抗氧化应激作用[23]。ZHANG等[24]的研究发现尿蛋白酶抑制剂可阻断高迁移蛋白组B/toll样受体/核因子-κB 信号通路,降低内毒素所导致的氧化应激反应,减轻由此导致的脏器损伤。IL-10、TGF-β1是临床常见的具有免疫抑制效应的细胞因子,主要产生于单核细胞和淋巴细胞,可减轻单核细胞吞噬结核杆菌后产生的免疫反应[25]。PCT是降钙素的前体蛋白,生理状态下体内含量极低,但发生肺部感染性疾病后会迅速上升,是诊断包括肺结核在内肺部感染性疾病常用指标[26]。PCT参与肺结核的发病和进展,其血清水平变化可反应肺结核的病情变化[27]。本研究发现治疗后观察组血清IL-10、TGF-β1、PCT改善情况优于对照组,进一步表明尿蛋白酶抑制剂有利于减轻炎症反应,促进病灶的吸收。
综上所述,尿蛋白酶抑制剂可改善机体免疫功能,减轻氧化应激损伤,提高痰菌清除率,促进病灶吸收,治疗MDR-TB效果确切,安全性好。本研究不足之处在于纳入MDR-TB患者的样本量较小,且未进行远期疗效评价,尿蛋白酶抑制剂治疗MDR-TB的效果尚需扩大样本量进一步验证,其改善机体免疫功能,减轻氧化应激损伤的具体机制也需要深入探讨。

