细颗粒物致人肺泡上皮细胞炎性反应关键组分及机制探究
王 荣,张邱栋,张懿烨,贺红梅,王娜娜,秦 蓓
(1.西安医学院药学院,陕西 西安 710021;2.西安市多靶协同抗高血压创新药物研制重点实验室,陕西 西安 710021;3.西安医学院医学技术学院,陕西 西安 710021)
可吸入颗粒物(Particulate matter,PM)是城市首要空气污染物,是大气污染的关键成分,PM2.5表示空气动力学当量直径≤ 2.5 μm的悬浮颗粒物,又称细颗粒物(Particulate matter 2.5,PM2.5)[1]。PM2.5粒径小,可通过呼吸进入呼吸道深处和肺部,沉积于肺泡,引发一系列肺部病变,影响肺部功能,其与呼吸系统疾病的发病率和病死率密切相关[2-4]。已有研究表明,PM2.5诱发呼吸系统疾病与其致毒组分有关[5-6]。
A549是人肺腺癌上皮细胞,其在体外培养过程中呈现出Ⅱ型肺泡上皮细胞的特征[7],是目前评价PM2.5对呼吸系统危害的常用细胞模型[8]。丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路是胞内一组进化上高度保守的丝氨酸/苏氨酸蛋白激酶,能感受胞外刺激调节细胞多种生理过程[9]。已有文章报道了PM2.5全组分对A549细胞存活的影响[10-11],但未揭示PM2.5组分-效应间的关系。本研究将PM2.5样本的不同组分暴露于A549细胞,检测其对细胞存活和炎症指标的影响,研究MAPK信号通路及糖皮质激素对PM2.5不同组分导致的炎症是否具有干预作用,初步甄别PM2.5诱导呼吸系统炎症反应的可能毒性组分,为控制典型区域PM2.5污染和提高人群健康保障提供理论和技术支持。
1 材料与方法
1.1 细胞及主要试剂 人Ⅱ型肺泡上皮A549细胞(中国科学院典型培养物保藏委员会细胞库);PM2.5样品(西安交通大学能源与动力工程学院沈振兴教授馈赠,采集于2019年3月,采集地点位于西安交通大学能源与动力工程学院15 m高建筑物楼顶,PM2.5样品浓度192.97 μg/m3);无血清细胞冻存培养基(RPMI) 1640培养基(美国HyClone公司);青链霉素混合液、胰酶细胞消化液(Biosharp公司);胎牛血清(浙江天杭生物科技股份有限公司);四甲基偶氮唑蓝(MTT,Sigma公司);酶联免疫试剂盒(上海酶联生物科技有限公司);MAPK信号通路抑制剂(Med Chem Express USA)。
1.2 PM2.5不同组分工作液的制备 称取40 mg PM2.5粉末,分别加入二甲基亚砜(DMSO)和二氯甲烷 1 ml,超声震荡20 min,连续3次,0.22 μm 无菌滤膜在超净台滤过,挥干,分别再加入200 μl DMSO的浓度200 mg/ml的全颗粒物(Whole particles of PM2.5,WPPM2.5)和脂溶性组分(Liposoluble-soluble PM2.5,LSPM2.5)母液。另称取40 mg PM2.5粉末,加超纯水1 ml,超声震荡20 min,连续3次,过滤,干燥,称重,制备浓度200 mg/ml 的水溶性组分(Water-soluble PM2.5,WSPM2.5)母液。分别取上述母液0.5~5 μl,加培养基2 ml得到50、100、200、300、400、500 μg/ml的工作液。4 ℃ 保存,备用。
1.3 PM2.5对细胞形态的影响 采用RPMI 1640完全培养基(含10 %的胎牛血清,1 %的青链霉素)于37 ℃,5% CO2条件下培养A549细胞。不同浓度PM2.5工作液与A549细胞培养24 h,显微镜下观察细胞形态。
1.4 MTT法检测PM2.5对A549增殖的影响 对数生长期的A549细胞,以1.2×104/孔的密度接种于96孔板中培养24 h。弃上清,分别将上述组分不同浓度的工作液以100 μl /孔加入培养板,同时设空白对照组和溶剂对照组。培养12~48 h后弃去上清,每孔加入100 μl 0.5 mg/ml MTT溶液,继续培养4 h,弃去上清后每孔加入150 μl DMSO,震摇10 min,490 nm处酶标仪检测吸光度(OD值),计算细胞存活率。
1.5 MAPK信号通路抑制剂及地塞米松对PM2.5抑制A549增殖的影响 细胞接种同1.4。200 μg/ml的PM2.5不同组分工作液以100 μl/孔加入孔板。实验分为空白组、PM2.5组、PM2.5+抑制剂组(ERK通路抑制剂U0126、p38通路抑制剂SB203580、JNK通路抑制剂SP600125和地塞米松)。为了考察抑制剂的作用浓度和时间,U0126、SB203580和SP600125的作用浓度设置为10-4或2×10-4mol/L,地塞米松作用浓度设置为10-5或2×10-5mol/L,培养时间为24~48 h。按1.3操作MTT法检测细胞存活率。
1.6 细胞上清液中炎性因子的检测 细胞接种同1.4。200 μg/ml的PM2.5不同组分暴露基础上加入U0126、SB203580、SP600125(2×10-4mol/L)和地塞米松(2×10-5mol/L)处理细胞48 h,收集细胞上清,ELISA检测白细胞介素-6(IL-6),IL-8,肿瘤坏死因子-α(TNF-α)水平。
1.7 细胞信号通路磷酸化水平的检测 细胞接种同1.4,设置对照组和PM2.5不同分组,分别培养30 min、1、24 h后收集细胞上清液。ELISA检测细胞信号通路磷酸化水平。

2 结 果
2.1 PM2.5不同组分对A549细胞形态的影响 结果见图1。A549细胞呈长梭形或圆形,贴壁良好。WSPM2.5组细胞形态、密度与对照组相似;LSPM2.5及WPPM2.5组细胞与对照组相比明显皱缩,多呈圆形,且随着浓度的增加,活细胞数目逐渐减少。
2.2 PM2.5不同组分对A549 细胞增殖的影响 如图2所示,WPPM2.5及LSPM2.5可显著降低A549细胞活性,随工作浓度的增加,WPPM2.5及LSPM2.5对A549细胞的抑制作用呈浓度和时间依赖性。WSPM2.5不管是时间变化还是浓度变化均对A549增殖没有明显的抑制作用。IC50值如表1所示,培养24 h后完全组分IC50为199.9 μg/ml、脂溶性组分IC50为142.1 μg/ml。

表1 PM2.5不同组分抑制A549细胞增殖的IC50(μg/ml)
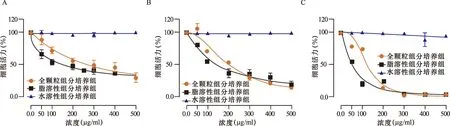
图2 PM2.5不同组分培养12~48 h对A549细胞存活率的影响
2.3 MAPK信号通路抑制剂及地塞米松对PM2.5抑制A549增殖的影响 通过将MAPK信号通路抑制剂及地塞米松与200 μg/ml PM2.5不同组分共同培养筛选抑制剂及地塞米松的最佳作用浓度和时间。结果显示,2×10-4mol/L抑制剂和2×10-5mol/L地塞米松作用24 h,与PM2.5组相比,MAPK信号通路抑制剂(U0126、SB203580、SP600125)和地塞米松均可显著降低A549细胞存活率,增强WPPM2.5和LSPM2.5对A549细胞的抑制作用(P<0.05或P<0.01);WSPM2.5对A549细胞增殖无显著影响,但MAPK信号通路抑制剂和地塞米松亦可降低A549细胞的存活率(均P<0.05)。见图3。

注:A为抑制剂(10-4mol/L)和地塞米松(10-5mol/L)作用24 h;B为抑制剂(10-4mol/L)和地塞米松(10-5mol/L)作用48 h;C为抑制剂(2×10-4mol/L)和地塞米松(2×10-5mol/L)作用24 h。与对照组比较,*P<0.05,**P<0.01;与PM2.5组比较,#P<0.05,##P<0.01
2.4 PM2.5致A549细胞炎症反应的检测 我们进一步评价了WPPM2.5和LSPM2.5对炎症因子释放的影响及机制。图4A为细胞上清液中IL-6因子水平,LSPM2.5可显著提高IL-6水平,U0126、SB203580、SP600125和地塞米松均可显著降低LSPM2.5染毒细胞上清液中IL-6水平(均P<0.01)。图4B为IL-8因子水平,WPPM2.5和LSPM2.5可显著增加IL-8表达,U0126、SB203580、SP600125和地塞米松均可显著抑制WPPM2.5和LSPM2.5致IL-8表达的增加(均P<0.01)。图4C为TNF-α因子水平,MAPK通路抑制剂及地塞米松对TNF-α水平无显著影响。

注:与对照组比较,*P<0.05,**P<0.01;与PM2.5组比较,#P<0.05,##P<0.01
2.5 PM2.5不同成分对A549细胞MAPK信号通路表达的影响 200 μg/ml WPPM2.5和LSPM2.5与A549细胞共同培养,ELISA法检测MAPK信号通路的活化水平。与对照组相比,作用30 min和1 h,WPPM2.5和LSPM2.5组p-ERK1/2与ERK1/2比值均显著增加(P<0.05或P<0.01)。作用24 h,WPPM2.5和LSPM2.5可显著增加p-JNK/JNK表达(均P<0.05),WPPM2.5和LSPM2.5对P38信号通路无显著影响。见图5。

注:与对照组比较,*P<0.05,**P<0.01
3 讨 论
PM2.5因其污染源多样而呈现出组分复杂的特点。研究显示,PM2.5暴露对人体的损害与PM2.5浓度、粒径和化学组分有关,不同组分对机体健康的不良效应及机制存在差异[12-13]。炎症是机体对吸入PM2.5的早期反应,PM2.5暴露可导致以炎性因子释放和炎症细胞浸润为特征的炎症反应[14-18]。然而,PM2.5诱导炎症的关键组分仍不清晰。因此,本研究采用西安冬季大气PM2.5。西安属于颗粒物污染严重的汾渭平原区域,其PM2.5主要来自于汽车尾气和燃煤燃烧,PM2.5样本具有一定代表性。
PM2.5主要由水溶性无机离子、金属元素、碳组分、多环芳烃等成分组成,水溶性无机离子与金属元素是水溶性组分的主要构成,碳组分与多环芳烃是脂溶性组分的主要构成。本研究采用超纯水和二氯甲烷分别提取PM2.5水溶性和脂溶性组分,另采用DMSO制备PM2.5全颗粒样品,对比三类组分对A549细胞存活及对炎症因子表达的影响。对细胞存活能力的影响是评价颗粒物对细胞毒性效应的重要指标。结果显示,PM2.5全颗粒和脂溶性组分可明显抑制A549细胞的增殖,并呈现浓度和时间依赖性,且二者暴露均可显著增加炎症因子的表达。对比二者的IC50值,全颗粒组分的IC50值(199.9 μg/ml)大于脂溶性组分的IC50值(142.1 μg/ml),表明脂溶性组分对A549细胞的毒性较大,而水溶性组分对细胞存活无显著影响。
MAPK信号通路参与调控细胞内信号传导,包括细胞增殖、分化、死亡过程及炎症因子分泌等[19-22]。研究发现,PM2.5可激活MAPK信号通路引发气道炎症[23]。糖皮质激素是目前广泛使用的抗炎药物,因此,我们选择MAPK信号通路特异性抑制剂及地塞米松探讨了PM2.5不同组分影响A549细胞活性和炎症的影响。MAPK信号通路抑制剂和地塞米松可显著增强PM2.5全颗粒和脂溶性组分对A549细胞的抑制作用,抑制炎性因子的表达。PM2.5全颗粒和脂溶性组分促进了JNK和ERK1/2的磷酸化。提示PM2.5全颗粒和脂溶性组分可明显抑制A549细胞的增殖,诱导炎症,其机制可能与激活ERK1/2和JNK MAPK信号通路有关。

