对苯二甲酸酯化合成对苯二甲酸二甲酯的反应热力学计算及分析
孙玉洁,景 旋,胡利如,唐建兴,王余伟
(中国石化仪征化纤有限责任公司研究院,江苏仪征 211900)
对苯二甲酸二甲酯(DMT),在1980年之前用于与乙二醇酯交换合成PET,但随着精对苯二甲酸合成技术的逐渐成熟,DMT路线逐渐被对苯二甲酸(PTA)直接酯化法取代,因此国内Witten法DMT装置陆续均已拆除[1]。近年来随着聚酯材料单体1,4-环己烷二甲醇(CHDM)消费量的逐渐增大,作为合成原料的对苯二甲酸二甲酯需求量也在增加[2],DMT制备方法包括以对二甲苯为原料的Witten法、以废聚酯为原料合成DMT的回收技术和PTA甲酯化法[3]。Witten法[4]工艺路线长,反应时间长,效率低下;废聚酯醇解[5]原料成分复杂,合成的DMT纯度低。PTA甲酯化法[6]是以对苯二甲酸和甲醇为原料反应合成对苯二甲酸二甲酯的方法,该法工艺路线短,合成工艺温和,十分具有工业化应用前景。
目前,我国尚无PTA甲酯化合成DMT的工业化装置,合成工艺也在研究探索阶段,PTA合成DMT的热力学数据及平衡常数等也无文献报道。对反应过程进行热力学分析,是判断反应发生的可能性及反应程度的重要依据,且能为反应工艺条件的设置、反应设备的选择等提供理论支撑及指导。浙江大学李希课题组[7]以碱减量废水中的对苯二甲酸(TA)为原料制备DMT,对反应过程的动力学模型进行了研究,发现在无催化的条件下,温度低于180 ℃,TA与甲醇的反应速率几乎可以忽略不计。该课题组也进行了酯化过程的热力学研究[8],但只给出了体系各物质的相平衡数据。
本文利用Aspen Plus对PTA合成DMT反应进行了详实的热力学计算和分析,对不同温度下体系内各物质的摩尔生成焓、摩尔生成熵及吉布斯自由能和反应过程的反应焓变、反应熵变、吉布斯自由能变及平衡常数进行模拟及计算,为PTA甲酯化合成DMT工艺条件的设定提供理论依据。
1 对苯二甲酸合成对苯二甲酸二甲酯反应
1.1 合成反应历程
PTA合成DMT是一个典型的连串反应,PTA一侧的羧基先进行酯化生成对苯二甲酸单甲酯(MMT),之后另一侧的羧基酯化生成DMT[8]。PTA甲酯化合成DMT的反应如图1所示。
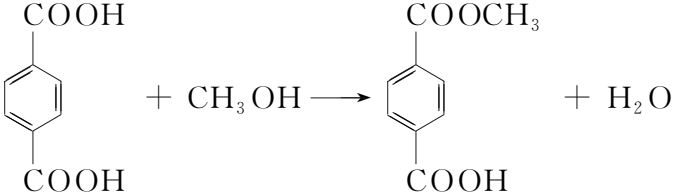
图1 PTA甲酯化合成DMT的反应方程
1.2 不同温度体系下物质的相态
由于体系中各物质的熔点不同,不同反应温度下,物质的相态不同,其热力学数据不同。除此之外,体系中各物质的相态还与其在甲醇中的溶解度有关。通过调研文献[9]及数据拟合,体系中PTA及DMT在甲醇中的溶解度如表1所示。天津大学Zhang等[10]采用Aspen计算与试验数据相结合的方法,发现DMT和MMT在甲醇中的溶解度都随着温度升高而增大,且MMT的溶解度大于DMT。

表1 PTA和DMT在甲醇中的溶解度 单位:g
化学反应的热力学分析应基于反应过程各组分实际状态,来确定反应进行的历程。由于酯化反应生成水,为使反应尽可能向右进行,工业装置通常采用反应精馏等非封闭体系将生成的水排出[11],因此,本研究基于非封闭体系来进行。当反应温度T<65 ℃时,体系中各物质PTA、MMT、DMT均为固相,甲醇、水为液相;当65
2 不同温度下反应热力学计算
2.1 计算方法
利用Aspen Plus软件中纯组分的物性分析模块对PTA甲酯化合成DMT反应体系中各物质的热力学数据进行估算,得到各物质摩尔生成焓、摩尔生成熵及吉布斯自由能[12]。由以上数据进行反应焓变、反应熵变、吉布斯自由能变计算。计算公式为式(1)~(3)。
ΔrHΘ=∑AμAHΘ
(1)
ΔrSΘ=∑AμASΘ
(2)
ΔrGΘ=∑AμAGΘ
(3)
式中μA为物质组分A对应的化学计量数,生成物为正数,反应物为负数。
2.2 标准状态下反应热力学计算
利用软件计算得到的反应体系中各物质标准状态下的热力学性质如表2所示。

表2 各物质标准状态下的热力学性质
根据表2数据及标准状态下体系中物质的状态,计算可得到数据如表3所示。

表3 25 ℃下的反应热力学性质
由以上计算可知,标准状态下,生成MMT及DMT反应均为放热反应,并且过程为熵减反应,反应吉布斯自由能大于0,在该温度下反应无法自发进行。
2.3 不同温度下反应热力学计算
由于随着温度变化,反应过程各组分实际状态不同,其反应历程不同。本文对不同温度下体系的反应热力学进行计算和分析。
当温度65 ℃ 表4 各物质80 ℃下的热力学性质 根据表4数据及标准状态下体系中物质的状态,计算可得到数据,如表5所示。 表5 80 ℃下的反应热力学性质 由以上计算可知,当反应温度为80 ℃时,生成MMT及DMT反应均为放热反应,熵减反应。生成MMT反应吉布斯自由能ΔGΘ≈0,在该温度下反应几乎没有可能自发进行。生成DMT过程反应吉布斯自由能大于0,在该温度下反应无法自发进行。 当反应温度T>100 ℃时,体系中各物质状态为:PTA为固相,MMT、DMT为液相,甲醇、水为气相,利用Aspen软件进行热力学性质的计算和分析如表6~8所示。 表6 各物质100~300 ℃下的摩尔生成焓ΔHΘ 单位:kJ/moL 表7 各物质100~300 ℃下的摩尔生成熵ΔSΘ 单位:J/(moL·K) 表8 各物质100~300 ℃下的生成吉布斯自由能ΔGΘ 单位:kJ/moL 根据表6~8数据,计算生成MMT及DMT反应在不同温度下的反应热力学数据,计算结果如表9、表10所示。 表9 生成MMT的反应热力学数据 表10 生成DMT的反应热力学数据 从表9可知,PTA单甲酯化生成MMT为吸热反应,反应焓变随温度升高而增大,且为熵增反应,反应熵变随温度变化不大,吉布斯自由能变在100 ℃以上均小于0,反应可自发进行。 从表10可知,反应焓变随温度升高而减小,当温度小于300 ℃,MMT甲酯化生成DMT为吸热反应,当反应温度达到300 ℃,反应开始放热。过程为熵减反应,吉布斯自由能变大于0,反应不可自发进行。 许新望[7]在180~270 ℃条件下,进行PTA制备DMT的甲酯化反应,也证明了该反应为典型连串反应,第一步为吸热反应生成MMT,反应速率较快,第二步为吸热反应生成DMT,与本文研究结果一致。吴春园[7]研究了240~270 ℃高温区间条件下,生成DMT的宏观反应速率较快,DMT得率随温度的提高而提高。由于文献中醇酸比为3,且当温度超过240 ℃时,甲醇处于超临界状态,反应可以自发进行。 在标准状态下,吉布斯自由能ΔGΘ与平衡常数Kp之间的关系有: ΔGΘ=-RTlnKp[14]。计算不同温度下反应的平衡常数如表11所示。 表11 不同温度下反应的平衡常数Kp 当反应平衡常数Kp<105时,反应进行得不完全,为可逆反应;当Kp>105时,为不可逆反应,反应进行得很完全[13]。因此,从表11中可知,温度对生成MMT的反应平衡常数影响很大,当反应温度小于100 ℃时,MMT在体系内溶解度较小,在体系中主要以固相存在,且反应为熵减过程,反应很难发生;当反应温度大于100 ℃时,MMT在体系内溶解度逐渐增大,在体系中主要以液相存在,生成过程为熵增,反应容易发生,且进行的很彻底。关于生成DMT反应,提高温度对平衡常数的影响不大,生成DMT反应为可逆反应。 文献报道[8],在180~270 ℃条件下,第一步为不可逆反应生成MMT,反应速率较快,第二步为可逆反应生成DMT,反应速率较慢,且受热力学平衡限制,与本文研究结果相对应。 PTA合成DMT反应为PTA酯化生成MMT、MMT酯化生成DMT的连串反应。由于体系中物质熔点和溶解度的影响,在不同温度下,体系内物质的相态不同,反应热力学性质复杂。 a) 本文利用Aspen Plus对反应进行了不同温度下热力学计算和分析,计算得到标准状态及非标准状态不同温度下体系内各物质的摩尔生成焓、摩尔生成熵及吉布斯自由能。 b) 对两步反应过程的焓变、熵变及吉布斯自由能变进行模拟及计算。当温度低于100 ℃时,合成MMT和DMT的反应均不可自发进行;当温度大于100 ℃时,合成MMT的反应可自发进行,且反应为吸热反应,合成DMT不能自发进行,反应为微吸热反应;当反应温度达到300 ℃,合成DMT反应开始放热。因此,PTA合成DMT反应需至少在100 ℃条件进行,且整体反应过程需要加热,以维持反应的进行,并且可能需要采用提高醇酸比等措施来促进合成DMT反应自发进行。






3 PTA甲酯化平衡常数

4 结 论

