锌诱导对香菇菌丝生长速度及金属硫蛋白含量的影响
姜海云 孙振英 刘贵巧*
(1.邯郸市食品药品检验中心,河北 邯郸 056002;2.河北工程大学 生命科学与食品工程学院,河北 邯郸 056038)
香菇在民间一直都有“山珍之王”的美誉,作为一种深受大家喜爱营养保健食品[1],为了为香菇菌丝创造一个更加有利的发育环境,通常选用人工栽培中的代料栽培[2],通过培养基培养的方式在恒温条件下进行菌丝的培养生长[3]。
1957年,美国科学家MARGOSHOES等[4]在研究过程中从动物的器官之中分离出镉的金属硫蛋白被称为金属硫蛋白(简称MT)。MT含有较多的半胱氨酸,具有良好的重金属解毒功能[5],MT可根据微量元素的状况对锌等金属进行吸收[6],可以此来探讨不同品种的香菇中金属硫蛋白含量对香菇重金属吸附能力影响。重金属污染指的是通过重金属或者其化合物造成环境污染。据徐丽红等[7]调研,浙江省食用菌重金属超标是主要安全隐患。
香菇是世界上栽培量最大的食用菌之一,含有多种有效的药用成分[8]。目前各国科学家所研究的降解食用菌中重金属含量的方法主要有化学法降解、生物分子分解等[9],锌会与食用菌中的氨基酸结合成有机锌,安全稳定[10],但是当重金属富集达到一定浓度后对食用菌的生长还是会产生不利影响。
徐尔尼等[11]发现香菇比茶树菇、金针菇对锌富集作用更强,但该富集作用一旦超过500 mg/kg,将会随锌浓度增加而逐渐减弱。且香菇营养特性和保健功能较于其他真菌类品种较好[12]本实验将选取食用菌中的香菇作为研究对象,模拟重金属对香菇的污染,测定所收获的不同香菇中元素锌及其金属硫蛋白的含量和影响作用并分析原因,金属硫蛋白具有较高吸附率和可回收金属离子的功能[13],也可为金属硫蛋白的应用前景进行展望。
1 实验部分
1.1 原料与培养基
土豆购于邯郸市水院北路农贸市场;4-12、74、808三个香菇品种,均由河北工程大学食品微生物实验室提供;PDA培养基(固/液两种)。
1.2 实验试剂及主要仪器
硫酸镁、磷酸二氢钾、硝酸、硫酸锌、葡萄糖均为分析纯(>99.7%),Tris-盐酸溶液、氯仿-乙醇溶液、金属硫蛋白(MT)酶联免疫分析试剂盒均购于上海莼试生物技术有限公司。
BPXUN立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂),DNP-9162BS-Ⅲ电热恒温培养箱,SW-CJ系列净化工作台(上海新苗医疗器械制造有限公司),PL-103S电热鼓风干燥箱(天津市通达实验电炉厂),KDN-12C消化炉(浙江托普仪器有限公司),TCL-16B高速台式离心机(上海安亭科学仪器厂),THZ-C恒温振荡器(北京瑞邦兴业科技有限公司),TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司),电子天平(上海精密科学仪器有限公司天平仪器厂制造),Utrao-SM800酶标仪(上海永创医疗器械有限公司),AA800型原子吸收分光光度仪(美国PE公司)。
1.3 实验方法
1.3.1 香菇菌种的活化及长速测定
按土豆200 g/L、琼脂20 g/L、葡萄糖20 g/L、磷酸二氢钾2 g/L、硫酸镁1 g/L、自来水1 L的比例配PDA固体培养基。将煮沸的培养基以每瓶100 mL的量分装于锥形瓶中,各个锥形瓶中按每100 mL培养基加入1、3、5、7 mmol/L的浓度梯度加入ZnSO4·7H2O并配空白浓度后高压灭菌取出以备使用。将灭好菌的培养基以每个菌种每个浓度倒入三个平板为宜,待液体凝固后将保藏好的三个不同品种的香菇菌种进行接种,此环节要在无菌环境下进行,接种后将培养皿封口放到25 ℃电热恒温培养箱中进行培养保存,并观察各菌块每天的生长情况,并测量出每个菌落的三个不同方向的生长直径,取平均值。
按上述步骤再次配制液体PDA培养基,设置0.5 g/L和1 g/L的金属硫蛋白诱导剂ZnSO4浓度,以每瓶200 mL分装于500 mL的锥形瓶内,高压灭菌后在无菌操作台上用打孔器进行接种,每瓶接0.5 cm3的菌种6块,之后放到25 ℃,150 r/min的摇床中进行培养,由于香菇菌丝在高浓度金属盐溶液培养下细胞内平衡遭到破坏,因此不同浓度下的菌丝生长可能会有不同[14],因此要每天观察菌种的生长情况。
1.3.2 香菇中金属硫蛋白粗提取
取6.055 g Tris试剂加入到800 mL无菌去离子水后加1% HCl溶液调至pH值为8.2,定容至1 L,高温高压灭菌后室温保存以备使用。
将培养好的菌丝用漏斗过滤掉液体培养基,之后用无菌去离子水冲洗菌丝体3~4次,将洗好的纯净菌丝展开铺到滤纸上,放到45 ℃的烘干箱内大约25~30 min,烘干菌丝体外部水分,得到湿样,收集菌丝湿样在天平上称其重量,并取相同质量的三种不同品种的香菇菌丝进行下列实验操作。按2 mL/g加入0.05 mol/L、pH=8.2的Tris-HCl缓冲溶液,将菌丝和溶液混合物放到研钵中进行研磨,直至成匀浆状态后进行超声波破碎细胞。将破碎好的浆状物取出后加入与菌丝/Tris-HCl缓冲溶液混合物等体积的氯仿-乙醇混合溶液(0.08∶1),搅拌约3 min变性除离心去杂蛋白质。9 000 r/min离心机离心25 min,将液体混合好离心后提取上清液部分。将上清液放置于80 ℃的恒温水浴锅中热变性15 min除去杂蛋白,用烧杯盛取适量自来水将上清液放置其中迅速冷却,静置约30 min后再次用离心机以10 000 r/min的转速离心25 min,取上清液部分即得到金属硫蛋白的粗提取液。
1.3.3 香菇中金属硫蛋白的吸光度
将上面实验得到的金属硫蛋白的粗提取液在紫外分光光度计中进行检测。首先进行光谱测量,对粗提取液进行210~320 nm紫外区域的连续扫描,光度方式为Abs,速度中等,距离间隔为0.5 nm,校正零基准线后开始测量得到金属硫蛋白紫外吸收光谱图,记清波峰位置及与之相对应的波长长度。第二步进行光度测量,将上一步处于波峰位置的波长在此次实验中设定为测量波长,先用参比液进行调零,再用同一浓度的三种菌丝金属硫蛋白粗体液依次进行测定。
1.3.4 金属锌含量的测定
取三个不同品种且含不同锌浓度的菌丝体湿样各0.1 g加入5 mL浓硝酸在消化炉上进行消化,另取标品作为对照样同样加浓硝酸进行消解,直至液体加热至澄清,在消解管中剩余少量液体为宜,充分将酸挥发,避免影响实验结果。将消解完全的液体取出,用无菌去离子水定容到25 mL,然后根据国家标准GB/T 5009.14—2003《食品中锌的测定》进行实验与计算。
1.3.5 香菇中金属硫蛋白含量的测定
此过程依据MT酶联免疫分析法测定原理,根据所购试剂盒说明书严格进行各步骤实验,并根据最后结果进行计算分析。
以标准物的浓度为横坐标,OD值为纵坐标,利用Excel 2007绘图软件绘出标准曲线,用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度;再乘以稀释倍数5,这样便可以得到样品的实际浓度。
2 结果与分析
2.1 锌浓度对固体培养基中香菇菌种生长速度的影响
模拟重金属对香菇的污染,在栽培基质料中添加不同浓度的重金属盐溶液,研究不同浓度的重金属锌对香菇长速的影响,模拟重金属对香菇的污染,在栽培基质料中添加不同浓度的重金属盐溶液,研究不同浓度的元素锌对香菇长速的影响。
2.1.1 不同浓度锌诱导下香菇4-12菌种的生长情况
研究不同浓度的元素锌对香菇4-12菌种长速的影响(图1)。通过10 d的长速观察发现,培养的第4 d前菌丝处于前期吸收营养物质状态,并未生长,从第4 d开始菌丝出现明显的生长状态,第4 d 1 mmo/L锌浓度下菌落直径为1.93 cm,3 和5 mmol/L分别为1.26、1.22 cm,7 mmol/L下菌落尚未生长,1~5 mmol/L菌落虽然均较空白组有促进作用,但是效果还不明显;从第5 d开始,1 mmol/L菌落直径为2.97 cm,3和5 mmol/L菌块直径分别为1.57和1.46 cm,7 mmol/L菌块依然未生长,从第4 d到第10 d整体来看,1~7 mmol/L菌落直径一直呈现依次递减状态,从数据上看出随着锌浓度的增大,促进作用逐渐减弱,抑制作用逐渐明显。
1 mmol/L的锌浓度对4-12的生长起到比较明显的促进作用,促进生长率可达到60.47%,从3 mmol/L开始,虽然菌丝还在生长,但已经相较于空白已开始有抑制作用,当锌浓度达到7 mmol/L时菌丝已经完全停止生长。5 mmol/L锌浓度作用下的其中一组数据可能由于摇晃不均匀,导致在制作固体培养基时浓度偏低,在第7 d时菌落直径已达到2.2 cm,以此单独在此提出。
因此可分析得知,当锌浓度在1 mmol/L时,菌丝生长最快;到5 mmol/L时锌对4-12菌丝产生明显的抑制作用,但达到7 mmol/L时对菌块的生长造成严重的影响。
2.1.2 不同浓度锌诱导下香菇74菌种的生长情况
研究不同浓度的元素锌对香菇74菌种长速的影响,通过图2可看到第4 d前并没有长出菌落,培养到第4、5、6 d时空白与5 、7 mmol/L锌浓度培养条件下的菌落生长直径相差不大,5 mmol/L菌落直径变化从1.33到1.87 cm,7 mmol/L菌落直径从1.34到1.76 cm,较空白组菌落直径从1.24到1.89 cm的变化没有明显的影响;而1和3 mmol/L直径的变化分别为从1.67到2.30 cm和从1.69到2.29 cm,较空白组有较为明显的促进作用。
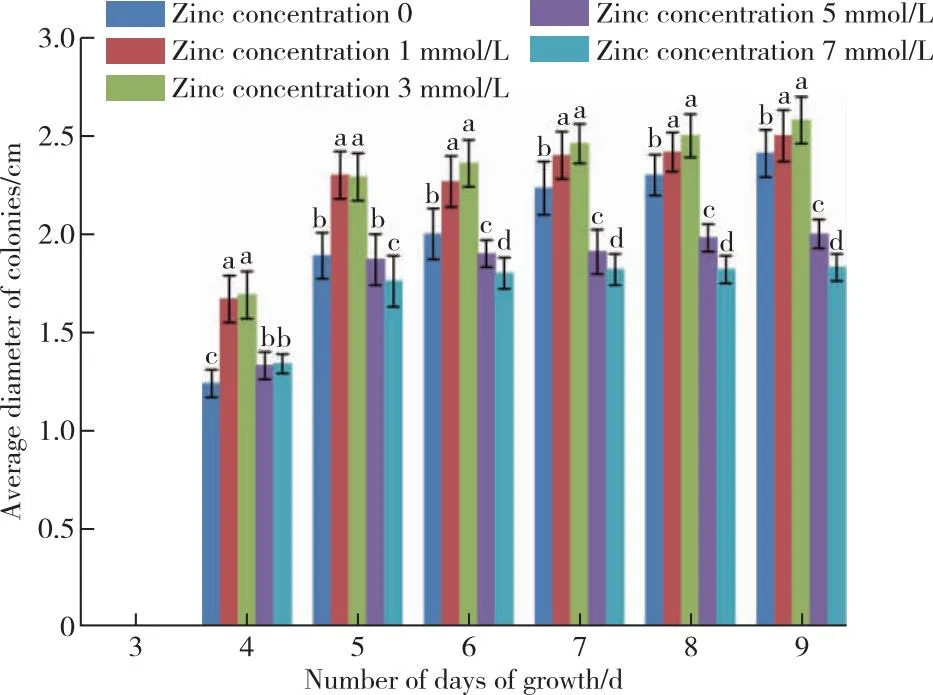
图2 不同锌浓度下74品种菌落生长情况Figure 2 Colony growth of 74 species under different zinc concentrations.
但是,从第7 d开始,5和7 mmol/L的锌浓度对菌落的生长的抑制作用开始变得明显,抑制率可以达到54.8%以上;而1和3 mmol/L锌浓度条件下培养的菌落从一开始到第10 d一直有生长上的优势,虽然两个浓度的菌落只有0.1 cm以内的差距,但是相比而言,3 mmol/L的锌浓度促进作用更大一些。
因此可以分析得到,当锌浓度在3 mmol/L时,菌丝生长最快,前期促进效率高达90%以上,但从5 mmol/L的锌浓度开始对74菌丝的抑制作用开始显现。
2.1.3 不同浓度锌诱导下香菇808菌种的生长情况
研究不同浓度的元素锌对香菇808菌种长速的影响,由图3可知菌丝培养第4 d到第5 d直径的变化分别是:空白组1.07到1.72 cm;1 mmol/L锌浓度下1.87到2.44 cm;3 mmol/L锌浓度下1.88到2.58 cm;5 mmol/L锌浓度下1.43到1.80 cm;7 mmol/L锌浓度下1.44到1.76 cm。通过分析可知3 mmol/L的增速最快,这两天在锌作用下的菌块均比空白组菌落生长快,有明显的促进作用。但是从第6 d开始到第10 d观察结束,1和3 mmol/L锌浓度均有较为明显的促进作用,而5和7 mmol/L的抑制作用则凸显出来。
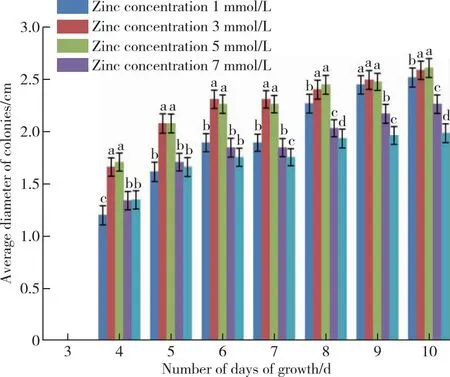
图3 不同锌浓度下808品种菌落的生长情况Figure 3 Colony growth of 808 varieties under different zinc concentrations.
通过图3可看到1和3 mmol/L锌浓度对808菌块生长的影响相接近,5和7 mmol/L的锌浓度对菌块的影响相差不明显。第4、5 d时5和7 mmol/L的锌浓度条件下的菌块比空白菌块长速相对较快,但是由于金属浓度较高,到后期培养之时,长速下降并呈现抑制作用。相比较之下,前两个锌浓度较小,因此对菌块的长势起到促进的作用。
因此,当锌浓度在3 mmol/L时,菌丝生长最快,当锌浓度达到5 mmol/L时对808菌丝出现生长抑制作用。
2.2 不同浓度锌作用下香菇菌丝中金属硫蛋白含量及锌含量对比
探究不同浓度锌作用下香菇菌丝中金属硫蛋白含量及锌含量对比,通过进行香菇对金属硫蛋白含量相关性研究,从而为香菇及其他食用菌富集重金属的原因及其富集机理的研究提供参考(图4)。
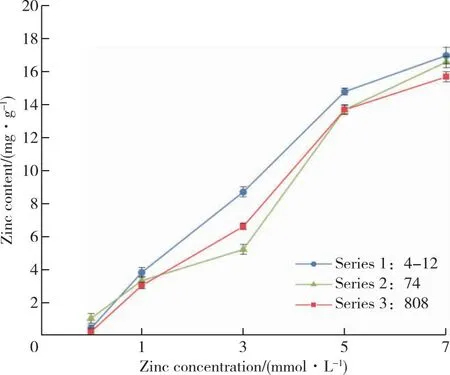
图4 不同浓度下三种菌丝吸附重金属锌含量对比Figure 4 Comparison of heavy metal zinc content adsorbed by three kinds of mycelia at different concentrations.
根据国家标准GB/T 5009.14—2003《食品中锌的测定》,对试样中锌含量进行计算:
(1)
X——试样中锌的含量,mg/kg或mg/L;
A1——测定试样消化液中锌含量,μg/mL;
A2——试剂空白液中锌含量,μg/mL;
V——试样消化液总体积,mL;
M——试样质量或体积,g或mL。
根据资料显示不同的吸附时间对铅的吸收效果也会不同[15]。因此推断出时间可能对锌吸附效果也有一定影响[16],但在此实验中只以最后一天长成时间作为截止时间,以此不做分析。
在0、1、3、5、7 mmol/L锌诱导浓度下,4-12品种富锌量从0.33 mg/g开始依次增长,最终在7 mmol/L浓度下达到最大吸附量17.12 mg/g;74品种空白组富锌量很低只要0.16 mg/g,之后随着锌浓度的增加,菌体内的富锌量也在增加;808的品种每个浓度下与74的含量相差不大,虽然中间吸附量有低于74品种,但最后的含量比74要高。
在3 mmol/L浓度下,4-12、74、808的吸附量分别为8.79、6.62、5.46 mg/g,5 mmol/L锌浓度下4-12、74、808的吸附量分别为14.97、13.97、13.81 mg/g,对比之前的吸附量,在3和5 mmol/L之间锌吸附量增长率很高。
通过图4显示来看,同一菌种在不同浓度梯度下菌丝的锌含量随着培养液锌浓度的增加而增加;同一锌浓度作用条件下,4-12富锌量较其他两个品种较高,74与808富锌量相差不大,整体上808稍微高出一点。
2.3 香菇菌丝中金属硫蛋白的含量
图5显示,通过标品吸光度值得到回归线性方程为:
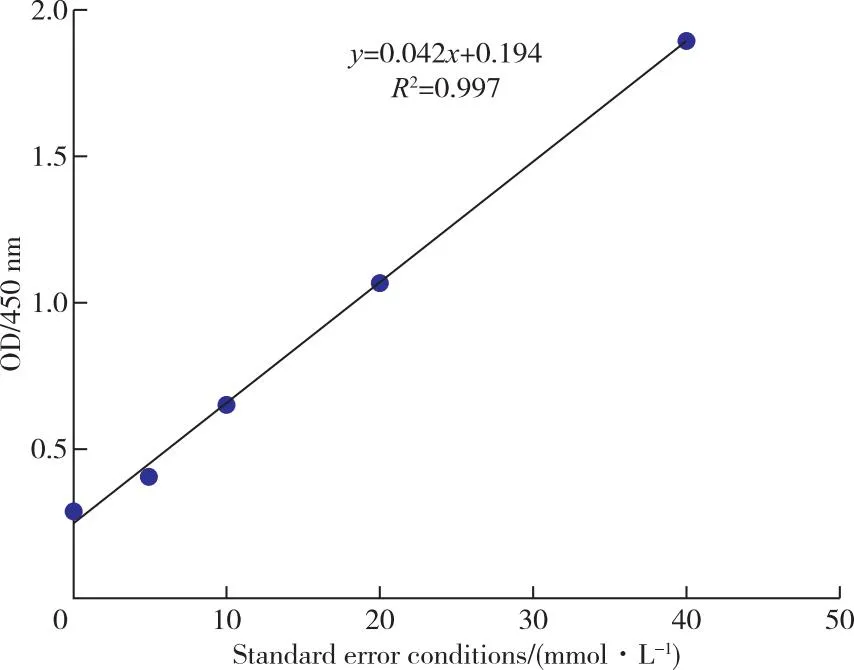
图5 金属硫蛋白标品标准曲线图及回归方程式Table 5 Standard chart and regression formula of metallothionein labeling.
y=0.0429x+0.1943
(2)
将各个待测样品的吸光度值代入方程式中得到粗提液中金属硫蛋白浓度。
菌丝中金属硫蛋白浓度含量=OD值×稀释倍数×粗提液体积×初始菌丝湿重质量÷制取粗提掖菌丝湿重质量
(3)
即可得到三种品种菌丝体不同元素浓度下吸附的金属硫蛋白含量。
空白组4-12、74、808三个品种内金属硫蛋白含量分别为0.53、0.47、0.49 mg/g,随着菌丝体吸附锌含量的增加,菌体内金属硫蛋白含量相对应也在增加;在最高锌诱导浓度条件下,4-12、74、808三个品种内金属硫蛋白含量可以达到9.33、5.61、7.99 mg/g。结果如图6所示,同一菌丝吸附锌含量越多,其菌丝体内金属硫蛋白含量越高。整体来看,同一浓度下4-12所含金属硫蛋白含量最高。
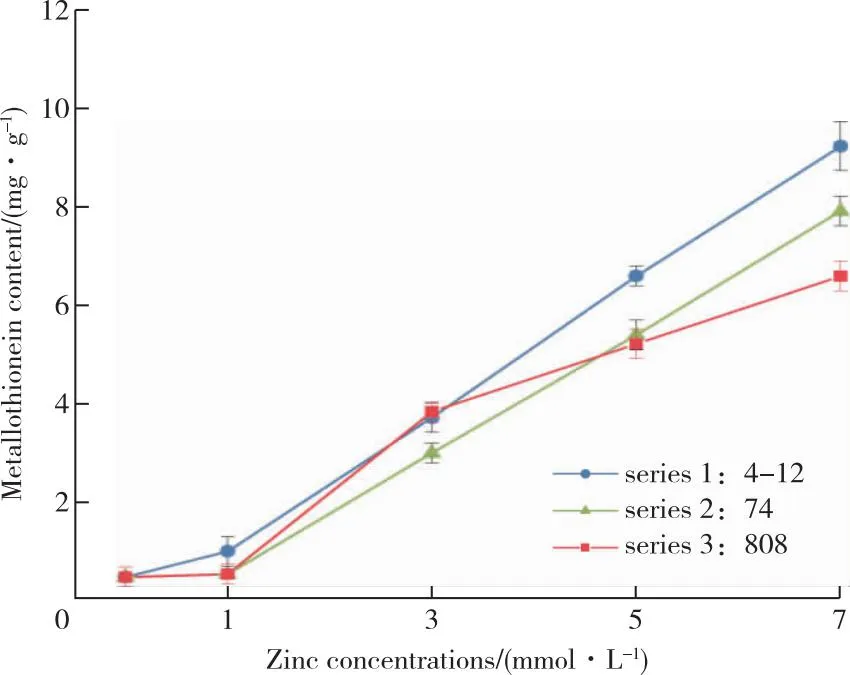
图6 不同浓度下三种香菇菌种原菌丝中的金属硫蛋白含量Figure 6 Metallothionein content in the mycelium of three lentinus species at different concentrations.
2.4 香菇菌丝富锌含量与金属硫蛋白的含量相关性分析
采用 SPSS 数据分析软件 Pearson检验法和Excel 2007办公软件进行菌丝体富锌含量与金属硫蛋白含量的相关性分析。R2为P值,P>0.6说明具有显著性意义[17]。
通过对图4中不同浓度下三种菌丝吸附锌含量对比和图6中不同浓度下三种香菇菌种原菌丝中的金属硫蛋白含量(mg/g)的对比可以看到:香菇菌丝富锌含量与金属硫蛋白的含量相关性关系为正相关。香菇菌丝内富锌含量越多,菌丝体中所含金属硫蛋白含量越高[19]。
通过SPSS 数据分析 Pearson检验法和Excel 工作表绘图可以精确得到图7~9三个不同香菇品种各自菌体内富锌量和金属硫蛋白含量的相关联性[20]。
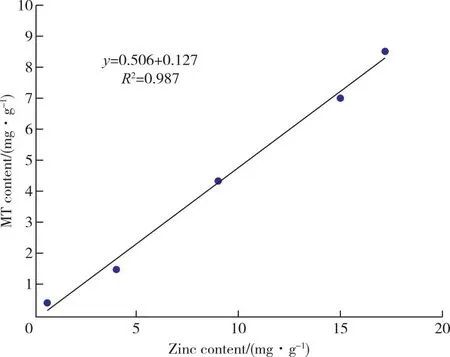
图7 4-12菌种菌丝体富锌含量与菌体内MT含量相关性回归曲线[18]Figure 7 Regression curve of correlation between zinc-rich content in mycelium of 4-12 strains and MT content in mycelium [18]
以菌丝体内金属硫蛋白含量为横坐标,菌丝富锌含量为纵坐标,绘制4-12菌种MT含量与富锌量的相关性回归曲线,如图7所示,4-12菌种MT含量与富锌量有极显著正相关(R2=0.967,P>0.6),表明4-12菌种富锌含量的多少明显影响MT含量的大小,且富锌量越大越大,MT的含量越大。图8、9中74和808菌种MT含量与富锌量相关性系数分别为R2=0.922>0.6和R2=0.962>0.6,因此,三个菌种MT含量与富锌量均是极显著正相关。
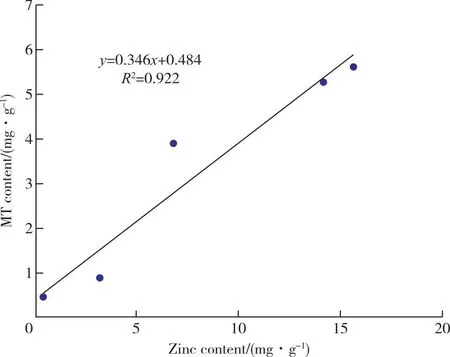
图8 74菌种菌丝体富锌含量与菌体内MT含量相关性回归曲线Figure 8 Regression curve of correlation between zinc-rich content in mycelium and MT content in mycelium of 74 strains.
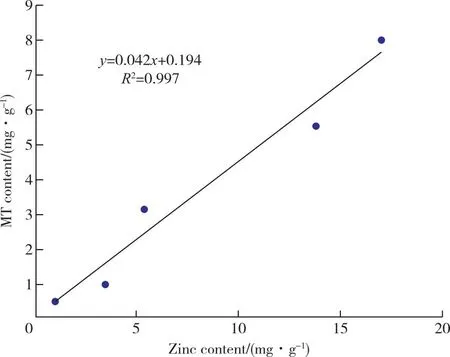
图9 808菌种菌丝体富锌含量与菌体内MT含量相关性回归曲线Figure 9 808 Regression curve of correlation between zinc rich content in mycelium and MT content in mycelium of 808 strain.
3 结论
本实验主要以香菇和金属锌为研究的主要内容,从整体来看,香菇菌丝的三个品种中4-12生长的最快。4-12品种的菌丝收获量最大,比另两种菌丝生长更加旺盛,同一香菇品种富锌含量随着锌浓度作用梯度的增加而增加。吸收锌含量越多,菌丝体内金属硫蛋白含量越多。
在今后的研究中可以扩大真菌和重金属关联的研究范围,以便更好地进行真菌中金属硫蛋白与重金属之间关系的研究。