金属组学在急性心肌梗死早期诊断中的应用
盛大平 汪雅婷 乐建军 张艳丽 江鑫垚 李玉锋 王 欣 李 超*
(1.安徽医科大学 第一附属医院 检验科,合肥 230032;2.安徽医科大学 第二附属医院 检验科,合肥 230601;3.六安市人民医院 全科医学科,安徽 六安 237008;4.安徽医科大学 第二附属医院 肿瘤科,合肥 230601;5.安徽医科大学 第一临床学院,合肥 230032;6.中国科学院高能物理研究所,北京 100049;7.安徽医科大学 基础医学院 化学教研室,合肥 230032)
近年来心血管疾病的发病率与死亡率逐年增加[1-2]。心肌梗死(MI)又称为心肌梗塞[3],是心血管病最主要的死亡原因之一。根据《中国心血管健康与疾病报告 2022》报告2020年我国冠心病死亡率延续2012年以来的上升趋势,城市与农村居民冠心病的死亡率分别为1.27/‰与1.36/‰。AMI的死亡率在2002-2020年间总体呈上升态势,严重威胁人民的生命健康[4]。
目前对AMI的诊断主要有心肌标志物与心电图两种主要的方式,而心肌标志物的临床应用始于20世纪中期,谷草转氨酶(AST)作为诊断MI第一个标志物应用于临床。随后乳酸脱氢酶(LDH)、肌酸激酶同工酶(CKMB)与肌红蛋白(Mb)广泛应用于AMI的诊断。敏感性高的方法检测心肌肌钙蛋白(cTn)在临床检验中逐渐普及,有助于早期发现微小损伤的心肌细胞并且被临床普遍接受[5]。目前,cTn为多部指南推荐的首选心肌损伤检测标志物。然而上述标志物具有一定的局限,不能满足临床早期诊断与治疗AMI的需求。
金属组学是继基因组学、蛋白质组学和代谢组学之后的一种新的组学。金属组学研究生物体系中金属组,包括研究金属离子或其他金属种态与基因、蛋白质、代谢物质及其他生物分子的相互作用和功能关系,它在研究生物体的金属与蛋白质结合的化学组成问题的同时探讨金属蛋白等生命物质担负生命活动的机理。金属组学可以用于疾病的诊断及治疗[6-7]。目前已有应用金属组学研究癌症、慢性肾脏疾病、甲状腺疾病等报道[8-10],例如碘和硒对人类健康至关重要,在新陈代谢中发挥着重要作用,它们对甲状腺代谢和功能也很重要,并与甲状腺自身免疫和肿瘤相关。
本研究拟在临床检测电解质(K+、Na+、Ca2+、Fe2+与Mg2+)的基础上进行回顾性分析,探讨金属组学对AMI的应用价值。
1 实验部分
1.1 临床资料
选取2022年5月至2023年2月收治的AMI患者37例,其中男性25例,女性12例,年龄41~78岁,中位年龄为64岁;选取同时期健康体检者35例为对照,其中男性20例,女性15例,年龄42~79岁,中位年龄为62岁。
1.2 纳入标准
符合《2019 Ⅱ型心肌梗死与急性非缺血性心肌损伤患者的评估和治疗白皮书》,经确诊为AMI患者。
1.3 排除标准
排除:慢性肺部疾病患者,恶性肿瘤患者,肝肾功能异常患者,心脏瓣膜疾病、心肌病等心脏疾病患者,病毒、细菌感染患者。
1.4 主要仪器与试剂
采用贝克曼全自动生化分析仪 AU-5800,所有试剂均为原装配套试剂。
1.5 方法
AMI组和健康对照组于清晨空腹状态下抽取静脉血3 mL,室温放置30 min后以3 500 r/min 转速离心10 min后分离血清。采用AU-5800贝克曼全自动生化分析仪检测血清中电解质(K+、Na+、Ca2+、Fe2+、Mg2+)、血糖(BS)、甘油三酯(TG)、总胆固醇(CHOL)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)的水平。
1.6 统计学分析
应用SPSS 19.0和Origin 6.0对相关数据进行统计学分析。计数资料比较采用卡方检验;计量资料以均数±标准差表示,两组间比较采用t检验,多组间比较采用One-Way ANOVA分析,P<0.05时差异具有统计学意义。
2 结果与讨论
2.1 两组患者基础临床资料比较
AMI组与健康对照组在性别、年龄及BS、TG、TC、LDL-C、HDL-C比较均无统计学差异(表1)。
2.2 两组患者血清K+、Na+、Ca2+、Fe2+、Mg2+水平比较
与健康组相比,AMI组的Ca2+与Fe2+水平低于健康对照组且两组差异具有统计学意义(表2)。

表2 AMI组与健康对照组血清电解质水平比较
2.3 判别方程
判别分析方法是一种多变量统计学分析方法,在分类确定的前提下,依据一定的判别原则建立一个或多个判别类型函数,用研究对象的大量资料确定判别函数中的待定系数值并计算判别指标,在此基础上可确定样本分类[11-12]。基于血钙和铁水平两组具有显著性差异,以它们为基础进行判别分析,获得判别函数式如下:
AMI组:Y1=154.704X1-0.684X2-163.718
健康者组:Y2=170.649X1-0.697X2-199.852
其中X1为血钙浓度,mmol/L;X2为血铁浓度,μmol/L。分别将各记录相应的变量值X1、X2代入上述判别式,求得该记录各类的评分即Y值,若Y1>Y2则为AMI组,反之则为健康者组。判别分析的准确率达到了86.1%。
2.4 主成分分析法(PCA)
PCA采用降维的算法从原始变量中推导出少数几个主成分,使它们尽可能保持原始变量的信息且彼此之间互不相关。因此PCA将原来众多具有一定相关性指标重新组合成一组新的互相无关的综合指标来代替,观察多个变量间相关性[13]。
将血清中K+、Na+、Ca2+、Fe2+、Mg2+的数据代入进行PCA。发现以第一主成分(PC1)为横坐标,以第四主成分(PC4)为纵坐标绘制PCA散点图能很好地区分AMI患者与健康者。绘制并分析载荷因子(图 1),位置距离原点的距离越远,其对于诊断AMI的价值越大[14]。由图1可以判断发现Fe2+对于AMI诊断的价值最大。
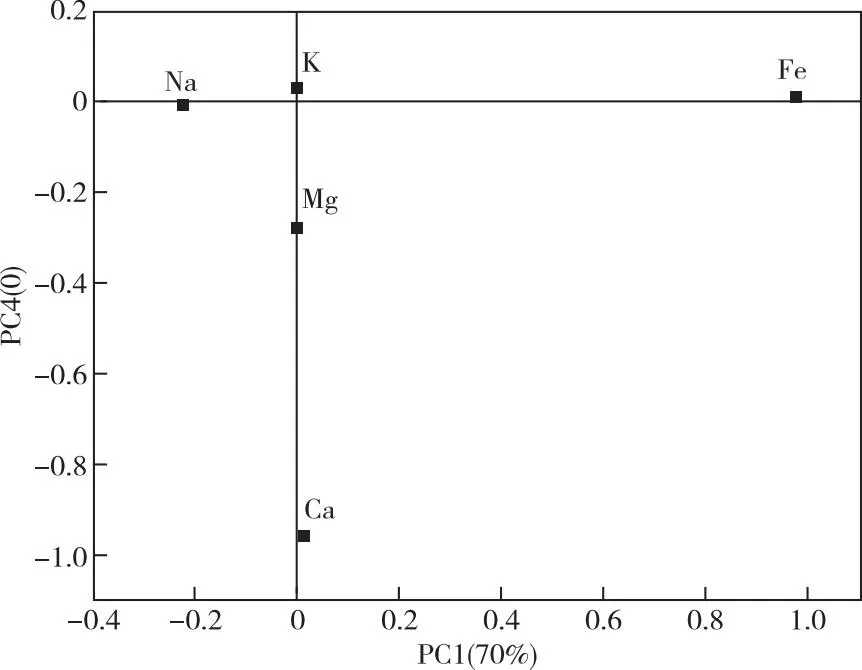
图1 PCA载荷因子图Figure 1 Loading factor diagram of PCA.
3 讨论
心脏的电活动取决于细胞跨膜离子梯度时间与电压依赖的电导变化。正常心肌组织中,电解质异常会导致心脏电活动,从而促进心律失常出现。异常心肌组织细胞中,电解质紊乱是导致心律失常的常见原因。电解质变化进而影响金属离子在特定离子通道的传导,产生抗心律失常或者导致心律失常的发生[15]。
AMI是由于心脏的冠状动脉循环阻塞而引起心肌细胞缺血、缺氧引起心肌宏观、环形区的坏死。有研究指出,心肌梗死患者体内电解质紊乱可对心肌细胞的兴奋性、自律性及传导性产生改变,从而引起不同程度的心律失常,临床实践中较常见的患者电解质异常见于K+、Na+、Ca2+、Fe2+、Mg2+异常等[16]。
血清中的Ca离子一般情况下合并血清中其他电解质出现异常,例如Ca2+含量减少可导致QT间期与ST段水平的延长、T波的低平或倒置,当严重减少时更会导致期前收缩及心动过速等症状[15]。此外,血Ca2+能够保护血管平滑肌及减轻炎症性损伤血管内皮细胞,相对于高血Ca2+含量,低血Ca2+含量可以引起更多的心血管危险因素,例如低血Ca2+含量与AMI死亡率具有较高的相关系数。血清Fe2+与心脏急性功能衰竭密切相关。研究发现缺铁可导致大鼠心肌能量代谢异常和心室重构[17]。此外,Fe代谢异常是引起铁死亡的重要机制之一。心肌细胞的Fe代谢平衡遭到破坏,细胞内的Fe聚集会导致芬顿反应发生,引起细胞内的脂质过氧化,诱导铁死亡[18-19]。有学者研究发现加入铁死亡的抑制剂会抑制心肌细胞铁死亡的发生[20]。由上可以发现Fe代谢水平可作为AMI诊断的重要辅助工具。
4 结论
AMI患者组血清中的Ca2+与Fe2+含量较健康对照组偏低。通过判别方程和PCA发现血清中的Ca2+与Fe2+含量对于诊断AMI有一定的价值。本研究也存在不足,为单中心的回顾性研究且样本量少,后续会加大样本量,进行多中心合作,以探索金属组学在AMI中的应用价值。
——以安徽医科大学为例