基于Rac1 信号通路研究淫羊藿苷对慢性阻塞性肺疾病模型小鼠肺泡巨噬细胞胞葬及吞噬功能的影响
周哲旭,王 省,唐 洲,陈 星,吴耀松,刘 洋,菅佳宁,胡啸博,刘娅茹,陈玉龙
河南中医药大学,河南省中医方证信号传导重点实验室,河南省中医方证信号传导国际联合实验室,河南 郑州 450046
慢性呼吸系统疾病包括慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、哮喘、肺纤维化等,截至2017 年,全球慢性呼吸系统疾病发病率较1990 年增加39.8%,是仅次于心血管疾病和肿瘤的第3 大死亡原因,其主要危险因素包括香烟烟雾、粉尘、生物燃料及空气污染[1]等。其中吸烟是唯一最可预防的死亡和疾病原因,香烟烟雾除了与COPD 密切相关,还与肺癌、间质性肺病的发展,以及肺部感染和急性肺损伤易感性的增加有关[2]。香烟烟雾包含4 500 多种物质(尼古丁、焦油、一氧化碳等)[3-4],具有致毒、致突变以及致癌作用。香烟烟雾会引起氧化应激,导致低级别慢性炎症反应,并通过激活上皮细胞、肺泡巨噬细胞、中性粒细胞和T 淋巴细胞将炎症细胞募集到气道[5]。肺泡巨噬细胞发挥吞噬和胞葬功能,清除肺内凋亡细胞、有害颗粒,从而维持内环境稳态,与COPD 等慢性肺部疾病的发生发展密切相关。
目前,很少有治疗方法可以影响COPD 的整体病程,现有的治疗方法大多以缓解症状为主以降低恶化率,如西医临床治疗慢性呼吸系统疾病以使用支气管扩张剂、吸入糖皮质激素以及服用抗生素和祛痰药物为主,这些药物可以在短期内有效改善肺通气从而缓解不适,但长期使用也会增加患者微生物感染的风险和频率[6]。中医认为,COPD 属于中医“肺胀”“肺痿”等范畴,该病首先伤肺,久病肺虚累及脾肾,久虚又导致痰浊、气滞、血瘀,出现正虚与邪瘀的相互影响。COPD 稳定期以补肺、健脾、益肾为主,而淫羊藿“禀天冬令之水气,入足少阴肾经,得地润泽之金味,入手太阴肺经”(《叶天士·本草经解》),入肺、肾、肝经,具有补肝肾、祛风湿、清肺润肺等功效。淫羊藿苷是淫羊藿的有效成分之一,属黄酮类物质[7]。淫羊藿苷具有抗氧化作用,能抑制一氧化氮和一氧化氮合酶(nitric oxide synthase,iNOS)释放[8-9],具有抑制炎症的作用[10],减少香烟烟雾诱导COPD 小鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎性细胞数量,改善香烟烟雾提取物引起的炎症反应、氧化应激和细胞损伤等[11-12]。说明淫羊藿苷在一定程度上能够抑制COPD 慢性持续性炎症反应的发展,为淫羊藿的补肺益肾功能提供实验依据。课题组前期研究发现,香烟烟雾提取物作用下大鼠肺泡巨噬细胞Rac1 表达降低,淫羊藿苷能够上调Rac1 表达。现有研究表明,在脂多糖/香烟烟雾诱导的COPD 模型刺激下,Rac1 持续活化并释放炎症因子[13-16],Rac1受抑制会下调巨噬细胞吞噬颗粒物的活性[17]。因此,本研究通过香烟烟雾熏吸法制备COPD 小鼠模型,基于Rac1 信号通路探讨淫羊藿苷介导细胞骨架重排改善COPD 稳定期肺泡巨噬细胞胞葬及吞噬功能障碍的分子机制。
1 材料
1.1 动物
SPF 级C57BL/6 小鼠40 只,6~8 周龄,雌雄各半,体质量18~20 g,由北京斯贝福生物技术有限公司提供,动物质量合格证号113242200080854,许可证号SCXK(京)2019-0010。动物适应性饲养1 周后开始造模。实验动物伦理审查批号DWLL202209008。
1.2 细胞
小鼠肺癌LLC 细胞购自中国科学院昆明细胞库(编号KCB20781YJ),由本实验室传代培养。
1.3 药品与试剂
淫羊藿苷(质量分数≥98.0%,批号MUST-22012418)购自成都曼思特生物科技有限公司;Rac1 抑制剂(批号S8031-03)购自美国Selleck 公司;无水乙醇(药用级,批号C13975831)购自上海麦克林生化科技有限公司;PKH26 细胞链接试剂盒(批号6008X220861)购自懋康生物公司;TRIZOL( 批号 284911 )、pHrodo™Deep RedE.coliBioParticles(批号2510628)购自美国Invitrogen 公司;FITC 鬼笔环肽(批号CA1620)、红细胞裂解液(批号20210915)购自北京索莱宝科技有限公司;ReverTra Ace qPCR RT 试剂盒(批号117000)购自日本TOYOBO 公司;SYBR Green 荧光染料(批号RK21203)购自武汉ABclonal 公司;兔单克隆抗体Rac1(批号2465S-4)购自美国CST 公司;P21 蛋白激活激酶(P21 activated kinase,PAK)兔多克隆抗体(批号0069245)购自武汉三鹰生物技术有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)鼠单克隆抗体(批号41323)购自美国Genetex 公司;白细胞介素-6(interleukin-6,IL-6)ELISA 试剂盒(批号A206H20233 )、IL-4 ELISA 试剂盒( 批号A204H20757)购自杭州联科生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(批号AK064V062759)购自武汉Elabscience 公司;乳脂球表皮生长因子8(milk fat globule EGF factor 8,MFG-E8)ELISA 试剂盒(批号L220921733)购自武汉云克隆公司;生长停滞特异性蛋白6(growth arrest specific protein 6,GAS6)ELISA 试剂盒(批号7421898927)购自武汉博士德生物公司;FITC 抗小鼠F4/80 抗体(批号B361742)、APC 抗小鼠CD68 抗体(批号B355351)购自Biolegend 公司;PE-CD206 抗体(批号D0721)购自 Santa Cruz 公司;“红旗渠”香烟(批号1062453192944302)购自河南中烟工业公司。
1.4 仪器
YP10001 型电子天平(上海衡际科学仪器有限公司);Fine Pointe WBP 型非束缚小动物肺功能测量系统(美国BUXCO 公司);FACSCalibur 型流式细胞仪(美国BD 公司);Epoch 酶标仪(美国Bio-Tek公司);CL-1000 型紫外交联仪(美国UVP 公司);Scientz-48L 型高通量组织研磨器(宁波新芝生物科技股份有限公司);Universal Hood II 型凝胶成像扫描仪(美国Bio-Rad 公司);QuantStudio 6 型实时荧光定量PCR 仪、ProFlex 型PCR 热循环仪、NanoDrop One/One C 型超微量分光光度计(美国Thermo 公司)。
2 方法
2.1 动物模型制备
雌、雄小鼠分笼饲养,每笼4 只,适应性喂养1 周后,随机数字法选出雌雄共8 只作为空白组,其余32 只小鼠采用香烟烟雾熏吸法制备COPD 模型[18-19]:造模工具为熏烟架,过滤嘴香烟,PE 塑料膜。造模时长为8 周,造模期间,每周熏烟6 d,每日熏烟2 次,每次间隔3 h 以上。每次熏烟时,将鼠笼置于熏烟架上,外用PE 塑料膜密封,共点燃25 支香烟,熏吸40 min,熏烟架上放置温度计,实时监测熏烟时的温度,温度控制于26 ℃,熏烟结束后,打开塑料膜,稳定30 min 后将小鼠运回动物房,同时期空白组小鼠自由呼吸新鲜空气。熏烟结束后常规饲养,8 周后判断是否造模成功[20]。
2.2 动物分组及给药
将造模成功的32 只小鼠运用随机数字法分为模型组、Rac1 抑制剂(2.5 mg/kg)组和淫羊藿苷低、高剂量(40、80 mg/kg)组,每组8 只。空白组和模型组ig 生理盐水(雄鼠0.25 mL/次,雌鼠0.20 mL/次)和ip 生理盐水(雄鼠0.20 mL/次,雌鼠0.15 mL/次);Rac1 抑制剂组ig 生理盐水(雄鼠0.25 mL/次,雌鼠0.20 mL/次)并ip Rac1 抑制剂(雄鼠0.20 mL/次,雌鼠0.15 mL/次);淫羊藿苷ig 不同浓度的药物(雄鼠0.25 mL/次,雌鼠0.20 mL/次)并ip 生理盐水(雄鼠0.20 mL/次,雌鼠0.15 mL/次)。1 次/d,每周给药6 次,干预4 周。
2.3 一般情况观察
每日观察小鼠精神、运动、呼吸状态、皮肤毛色、饮水饮食等,每周日称定小鼠体质量,比较各组小鼠第0、4、8、12 周的体质量。
2.4 肺功能检测
第0、4、8、12 周采用无束缚小动物全身体积描记仪测定无创肺功能。通过软件记录分析得出最终潮气量(TV)、每分钟呼气量(MV)、呼气峰流速(PEF)和50%潮气量呼气流量(EF50)。
2.5 小鼠肺组织病理分析
给药结束后,使用4%多聚甲醛灌注小鼠左肺,固定72 h,将固定好的肺组织乙醇梯度浸泡、石蜡包埋制作蜡块,用切片机切成4 μm 切片。捞片后,将切片置于烤片机内烤片,按照脱腊、水化、染色、中性树胶封片流程进行常规苏木素-伊红(HE)染色。置于光学显微镜下观察各组气道、支气管及肺泡的病理变化。
各组均取6 张病理切片,采用K-viewer 数字病理分析软件随机选取6 个视野,在200 倍视野下,避开大、中支气管与大、中血管,截取图片,测得视野总面积(S),“十”字线总长度(L),计算视野中肺泡总数(Na)和穿过“十”字线的肺泡间隔数(Ns),计算肺泡平均截距(mean linear intercept,MLI)和单位面积平均肺泡数(mean alveolar numbers,MAN)。
MLI=L/Ns
MAN=Na/S
2.6 小鼠BALF 提取肺泡巨噬细胞
末次给药3 h 后取材,取材前12 h 禁食不禁水。取材时小鼠称定质量,颈椎脱臼处死,全身喷洒乙醇,迅速转移至超净台内,固定好四肢,手术剪分离小鼠气管,横剪“一”字小口后,用5 mL 注射器将4 ℃预冷的PBS 缓慢注入肺内进行肺泡灌洗,收集BALF 至15 mL 尖底离心管内,1 500 r/min 离心10 min,用1 mL 完全培养基重悬,转移至6 孔板内,收集贴壁细胞即为小鼠肺泡巨噬细胞。
2.7 巨噬细胞胞葬功能测定
将各组小鼠肺泡巨噬细胞种于35 mm 的培养皿中,调整细胞数量为5×105个,每皿2 mL 完全培养基,等待贴壁。同时诱导LLC 细胞凋亡,以每皿20 mL 培养基开盖置于紫外交联仪中,以30 000 μj/cm2的紫外强度照射15 min 后,置于CO2培养箱中平衡10 min。平衡结束后使用PKH26 膜标记探针进行染色,使LLC 细胞携带红色荧光。待巨噬细胞贴壁后,按照小鼠肺泡巨噬细胞-LLC 细胞(1∶5)的比例,加入染色后的LLC 凋亡细胞,置于培养箱中孵育1 h,使用4%多聚甲醛避光固定15 min,0.04%台盼蓝淬灭细胞外荧光,1 500 r/min 离心5 min,PBS 重悬后,流式细胞术检测巨噬细胞荧光强度,肺泡巨噬细胞所携带的平均荧光强度代表其吞噬凋亡细胞的能力。
2.8 巨噬细胞吞噬功能检测
将各组小鼠肺泡巨噬细胞以5×105接种于35 mm 的培养皿中,每皿2 mL 完全培养基,配制荧光标记大肠杆菌溶液(1 mg/mL),将大肠杆菌加入对应各组,终质量浓度为0.1 mg/mL,在CO2培养箱中避光吞噬3 h 后,流式细胞仪检测巨噬细胞吞噬大肠杆菌的平均荧光强度。
2.9 全血巨噬细胞M1/M2 分型检测
抽取100 μL 全血,加入F4/80、CD68、CD206抗体避光孵育30 min,加入5 倍体积的红细胞裂解液,冰上裂解,每5 分钟避光涡旋1 次,裂解15 min后,4 ℃、450×g离心10 min,重复裂解2 次,配制含5%胎牛血清的PBS 重悬细胞,转移至含2 mL PBS 流式管中,离心后加入500 μL PBS 重悬细胞,上机检测。
2.10 ELISA 法检测肺组织匀浆中TNF-α、IL-4、IL-6 及胞葬辅助因子MFG-E8、GAS6 含量
取小鼠肺组织30 mg,置于1.5 mL EP 管内,用眼科剪将组织剪碎,加入4~5 个小钢珠和270 μL预冷的PBS,用组织破碎机破碎10 min,离心取上清用于检测,按照ELISA 试剂盒说明书检测细胞上清中TNF-α、IL-4、IL-6、MFG-E8、GAS6 的含量。
2.11 qRT-PCR 检测肺组织Rac1 和PAK mRNA 表达
称取小鼠肺组织,TRIZOL 法提取RNA,ReverTra Ace qPCR RT 试剂盒合成cDNA,使用SYBR Green Fast qPCR Mix 进行实时荧光PCR 检测,以GAPDH 为参考基因,用2−∆∆Ct法进行定量,对照组的基因表达被标准化为 1。引物序列由GENEWIZ 公司设计与合成,见表1。

表1 引物序列Table 1 Primer sequences
2.12 Western blotting 检测肺组织Rac1 和PAK 蛋白表达
称取肺组织,加入适量裂解液,组织破碎机低温破碎10 min 后,4 ℃、12 000 r/min 离心10 min,采用BCA 法检测各组蛋白浓度后变性蛋白,统一蛋白上样量,蛋白条带以凝胶成像分析系统进行检测,使用Image Lab 软件分析条带灰度值。以目的蛋白条带灰度值/内参蛋白条带灰度值分析各实验组蛋白表达情况,进行统计分析。
2.13 巨噬细胞吞噬及骨架结构变化观察
各组小鼠肺泡巨噬细胞种板同“2.8”项,贴壁后吸掉培养液,加入大肠杆菌混悬液,使其终质量浓度为0.1 mg/mL,吞噬3 h 后处理细胞:37 ℃预热的PBS 清洗细胞2 次;4%多聚甲醛固定10 min;室温下PBS 清洗细胞2 次,每次10 min;加入2 mL 0.5% Triton X-100 溶液透化处理5 min;PBS 清洗2次,每次10 min;每皿加入1 mL 配制好的FITC 鬼笔环肽工作液(100 nmol/L),室温避光孵育30 min后,PBS 清洗3 次,每次5 min;使用500 µL DAPI溶液(100 nmol/L)对细胞核进行复染30 s;在皿底中央滴入抗荧光衰减封片剂,盖上盖玻片后放入暗盒内,在激光共聚焦下观察。
2.14 统计学分析
数据采用SPSS 25.0 软件进行分析,数据符合正态分布,结果以±s进行统计描述。两组间对比选用独立样本t检验;多组间对比选用单因素方差分析,方差齐以LSD 为统计依据,若方差不齐则采用DunnettT3检验。
3 结果
3.1 小鼠一般情况观察
实验期间,空白组小鼠毛色鲜亮,摄食活动正常,二便正常,精神状态良好,体质量正常增长;模型组小鼠出现烦躁不安,毛色晦暗等现象,撕咬打架较为频繁,摄食进水减少,垫料较为潮湿,造模第4 周时空白组小鼠体质量增长较快,造模组雌、雄小鼠体质量均增长缓慢,第8 周造模结束时,与空白组比较,其余熏烟雌雄小鼠体质量均有显著降低(P<0.05、0.01,表2、3),给药4 周后,模型组雌雄小鼠体质量虽有较前有所增长,但仍较空白组偏低(P<0.05、0.01);与模型组比较,Rac1 抑制剂组及淫羊藿苷高、低剂量组雄鼠体质量有一定升高但无统计学差异,Rac1 抑制剂组及淫羊藿苷高剂量组雌鼠体质量有显著升高(P<0.05、0.01)。
表2 各组雄鼠体质量变化 (±s, n = 4)Table 2 Changes of body weight of male mice in each group (±s, n = 4)
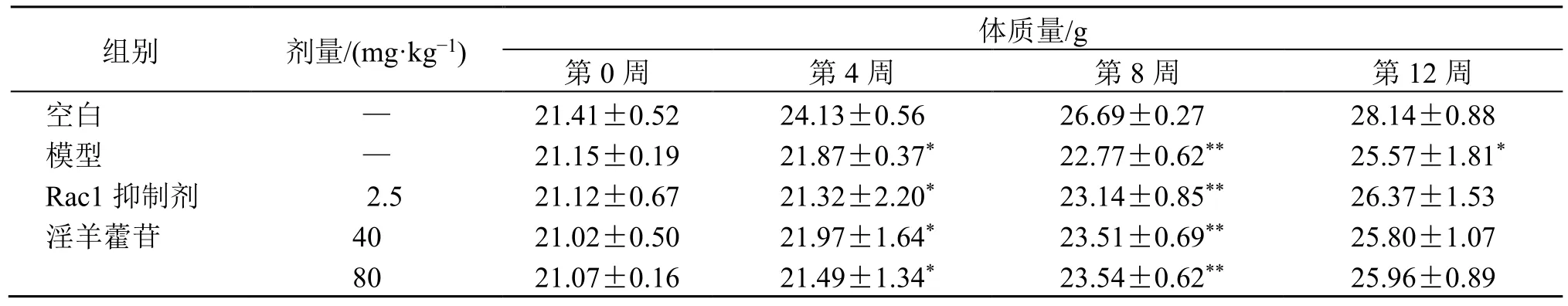
表2 各组雄鼠体质量变化 (±s, n = 4)Table 2 Changes of body weight of male mice in each group (±s, n = 4)
与空白组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01,下表同。*P < 0.05 **P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group, same as below tables.
组别 剂量/(mg·kg−1) 体质量/g第0 周 第4 周 第8 周 第12 周空白 — 21.41±0.52 24.13±0.56 26.69±0.27 28.14±0.88模型 — 21.15±0.19 21.87±0.37* 22.77±0.62** 25.57±1.81*Rac1 抑制剂 2.5 21.12±0.67 21.32±2.20* 23.14±0.85** 26.37±1.53淫羊藿苷 40 21.02±0.50 21.97±1.64* 23.51±0.69** 25.80±1.07 80 21.07±0.16 21.49±1.34* 23.54±0.62** 25.96±0.89
表3 各组雌鼠体质量变化 (±s, n = 4)Table 3 Changes of body weight of female mice in each group (±s, n = 4)
组别 剂量/(mg·kg−1) 体质量/g第0 周 第4 周 第8 周 第12 周空白 — 17.46±0.22 19.88±0.36 21.02±0.09 21.74±0.47模型 — 17.35±0.58 18.08±0.65** 18.54±0.99** 19.93±0.94**Rac1 抑制剂 2.5 17.43±0.53 18.50±0.32* 18.81±0.71** 21.33±0.40##淫羊藿苷 40 17.09±0.47 18.13±0.87** 19.16±0.45* 20.48±0.43 80 17.37±0.51 18.31±0.98** 18.54±1.77** 20.88±0.50#
3.2 小鼠肺功能指标比较
如表4~7 所示,造模4 周时,与空白组比较,熏烟小鼠TV、MV、EF50、PEF 有降低趋势(P<0.05、0.01);第8 周造模结束后,模型组小鼠肺功能指标TV、MV、EF50、PEF 显著降低(P<0.05、0.01);第12 周给药结束后,与空白组比较,模型组TV、MV、PEF 水平仍受损(P<0.05、0.01);与模型组比较,淫羊藿苷低、高剂量组小鼠肺功能TV、MV、PEF 水平有明显改善(P<0.05、0.01)。
表4 各组小鼠TV 变化 (±s, n = 6)Table 4 Changes of TV in each group of mice (±s , n = 6)

表4 各组小鼠TV 变化 (±s, n = 6)Table 4 Changes of TV in each group of mice (±s , n = 6)
组别 剂量/(mg·kg−1) TV/mL第0 周 第4 周 第8 周 第12 周空白 — 0.25±0.03 0.32±0.03 0.41±0.11 0.39±0.05模型 — 0.23±0.02 0.27±0.03* 0.24±0.08** 0.23±0.07**Rac1 抑制剂 2.5 0.24±0.02 0.27±0.02* 0.31±0.07* 0.27±0.08淫羊藿苷 40 0.24±0.03 0.27±0.06* 0.23±0.06** 0.33±0.07#80 0.24±0.02 0.30±0.04 0.31±0.08* 0.35±0.07##
表5 各组小鼠MV 变化 (±s, n = 6)Table 5 Changes of MV in each group of mice (±s, n = 6)

表5 各组小鼠MV 变化 (±s, n = 6)Table 5 Changes of MV in each group of mice (±s, n = 6)
组别 剂量/(mg·kg−1) MV/mL第0 周 第4 周 第8 周 第12 周空白 — 103.57±15.99 118.16±13.51 182.58±52.40 169.84±13.58模型 — 110.61±4.75 72.96±20.92** 108.07±41.35** 97.92±26.80**Rac1 抑制剂 2.5 121.24±11.02 84.44±20.22** 131.52±29.82* 113.32±32.29淫羊藿苷 40 110.25±7.02 88.90±15.15* 99.87±24.01** 140.79±28.34#80 116.82±10.43 80.90±23.74** 100.68±39.51** 149.58±33.13##
表6 各组小鼠EF50 变化 (±s, n = 6)Table 6 Changes of EP50 in each group of mice (±s , n = 6)

表6 各组小鼠EF50 变化 (±s, n = 6)Table 6 Changes of EP50 in each group of mice (±s , n = 6)
组别 剂量/(mg·kg−1) EF50/mL第0 周 第4 周 第8 周 第12 周空白 — 0.27±0.05 0.45±0.06 0.46±0.13 0.39±0.09模型 — 0.28±0.03 0.35±0.13* 0.29±0.08** 0.28±0.11 Rac1 抑制剂 2.5 0.32±0.07 0.27±0.05** 0.30±0.09** 0.27±0.08淫羊藿苷 40 0.27±0.05 0.28±0.06** 0.25±0.08** 0.30±0.11 80 0.30±0.04 0.35±0.09* 0.29±0.07** 0.35±0.11
表7 各组小鼠PEF 变化 (±s, n = 6)Table 7 Changes of PEF in each group of mice (±s, n = 6)
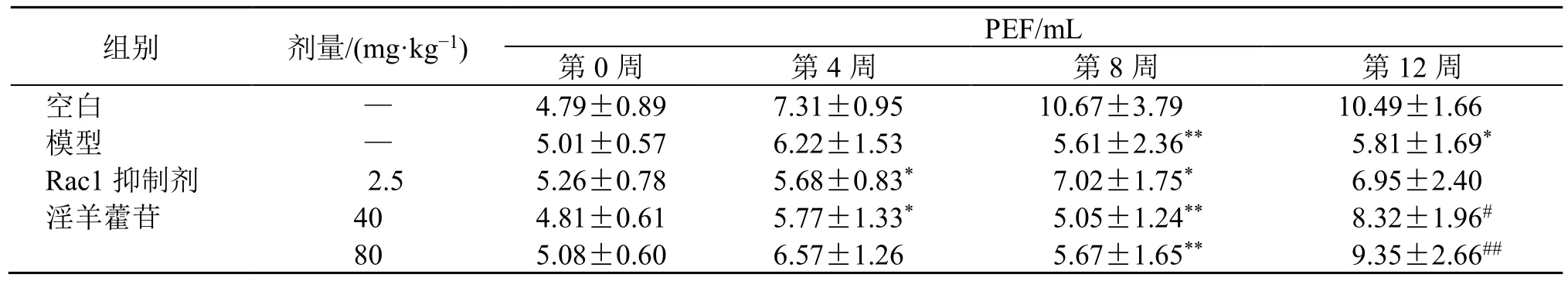
表7 各组小鼠PEF 变化 (±s, n = 6)Table 7 Changes of PEF in each group of mice (±s, n = 6)
组别 剂量/(mg·kg−1) PEF/mL第0 周 第4 周 第8 周 第12 周空白 — 4.79±0.89 7.31±0.95 10.67±3.79 10.49±1.66模型 — 5.01±0.57 6.22±1.53 5.61±2.36** 5.81±1.69*Rac1 抑制剂 2.5 5.26±0.78 5.68±0.83* 7.02±1.75* 6.95±2.40淫羊藿苷 40 4.81±0.61 5.77±1.33* 5.05±1.24** 8.32±1.96#80 5.08±0.60 6.57±1.26 5.67±1.65** 9.35±2.66##
3.3 小鼠肺组织病理观察
如图1 所示,空白组小鼠肺泡大小基本均匀,肺泡壁结构比较完整,肺泡无明显塌陷,偶见肺泡壁断裂融合,肺泡腔和肺泡壁炎症细胞浸润较少,支气管管壁未见明显增厚。模型组小鼠肺泡大小不一,大量肺泡壁断裂融合,可见明显肺泡塌陷,肺泡腔扩大,炎性细胞浸润明显,支气管壁可见明显增厚,管腔狭窄,杯状细胞与黏液细胞肥大增生,支气管周围纤维组织增生。Rac1 抑制剂组和淫羊藿苷低、高剂量组小鼠上述情况明显改善。

图1 各组小鼠肺组织病理变化 (HE, ×100)Fig.1 Histopathologic changes in lung of mice in each group (HE, × 100)
3.4 肺组织病理定量分析
如图2 和表8 所示,200 倍镜下测得视野总面积0.225 7 mm2,“十”字线总长度为955.41 μm,计算视野中肺泡总数和穿过“十”字线的肺泡间隔数,结果显示,与空白组比较,模型组MAN 显著降低(P<0.01),MLI 显著升高(P<0.01);与模型组比较,Rac1 抑制剂组和淫羊藿苷低、高剂量组MAN显著升高(P<0.01),MLI 显著降低(P<0.01)。
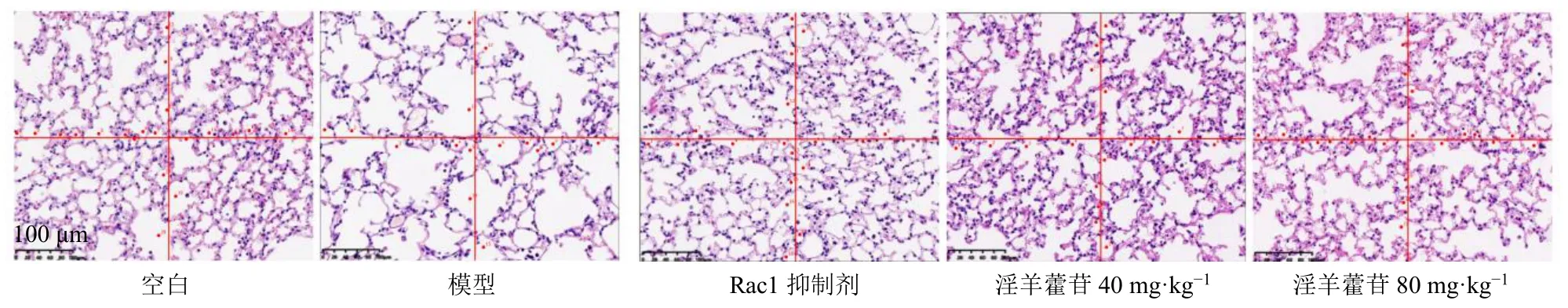
图2 各组小鼠穿过“十”字线肺泡间隔数 (HE, ×200)Fig.2 Number of alveolar intervals across cross line in each group of mice (HE, × 200)
表8 各组小鼠MAN、MLI 定量分析 (±s , n = 6)Table 8 Analysis of MAN and MLI in each group of mice(±s , n = 6)

表8 各组小鼠MAN、MLI 定量分析 (±s , n = 6)Table 8 Analysis of MAN and MLI in each group of mice(±s , n = 6)
组别 剂量/(mg·kg−1) MAN/mm2 MLI/μm空白 — 453.48±35.98 43.15±1.54模型 — 298.13±52.94** 70.17±6.10**Rac1 抑制剂 2.5 427.87±85.96## 45.17±4.91##淫羊藿苷 40 400.67±49.60## 45.20±5.00##80 442.65±43.09## 47.84±5.34##
3.5 小鼠肺泡巨噬细胞胞葬、吞噬功能及M1/M2分型检测
如表9 和图3 所示,与空白组比较,模型组小鼠肺泡巨噬细胞胞葬及吞噬功能显著降低(P<0.05、0.01),促炎M1 型巨噬细胞表达增加(P<0.05),抑炎M2 型巨噬细胞表达降低(P<0.01);与模型组比较,给予Rac1 抑制剂后M2 型巨噬细胞比例增加(P<0.01),低、高剂量淫羊藿苷干预后胞葬功能增加(P<0.05、0.01),吞噬功能改善,M1型巨噬细胞比例降低(P<0.05、0.01),M2 型巨噬细胞显著增加(P<0.05、0.01)。
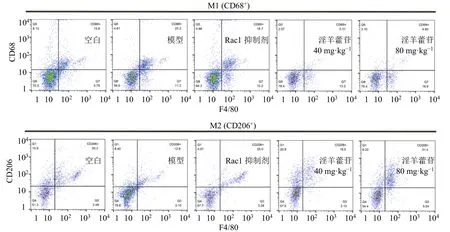
图3 小鼠肺泡巨噬细胞M1/M2 分型Fig.3 Mouse alveolar macrophage M1/M2 phenotyping
表9 各组肺泡巨噬细胞胞葬、吞噬功能及M1/M2 分型变化 (±s, n = 3)Table 9 Efferocytosis, phagocytosis and M1/M2 phenotype of alveolar macrophage in each group (±s, n = 3)
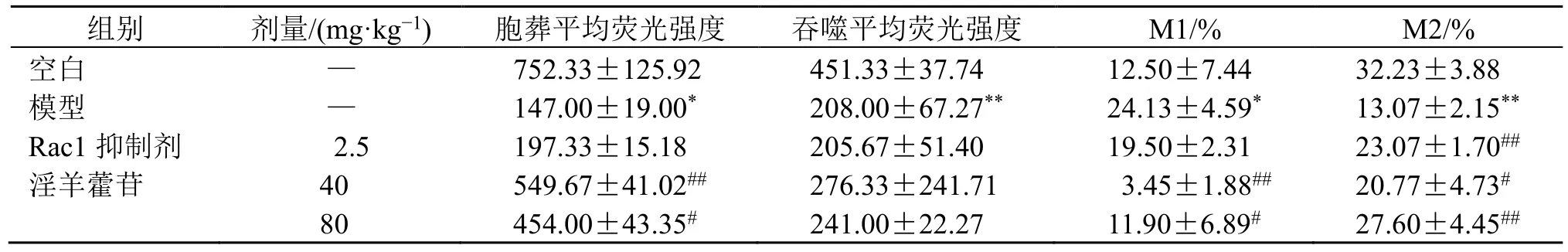
表9 各组肺泡巨噬细胞胞葬、吞噬功能及M1/M2 分型变化 (±s, n = 3)Table 9 Efferocytosis, phagocytosis and M1/M2 phenotype of alveolar macrophage in each group (±s, n = 3)
组别 剂量/(mg·kg−1) 胞葬平均荧光强度 吞噬平均荧光强度 M1/% M2/%空白 — 752.33±125.92 451.33±37.74 12.50±7.44 32.23±3.88模型 — 147.00±19.00* 208.00±67.27** 24.13±4.59* 13.07±2.15**Rac1 抑制剂 2.5 197.33±15.18 205.67±51.40 19.50±2.31 23.07±1.70##淫羊藿苷 40 549.67±41.02## 276.33±241.71 3.45±1.88## 20.77±4.73#80 454.00±43.35# 241.00±22.27 11.90±6.89# 27.60±4.45##
3.6 小鼠肺组织炎症因子及胞葬辅助因子含量比较
如表10 所示,与空白组比较,模型组小鼠肺组织匀浆中炎症因子IL-4、IL-6、TNF-α 水平显著增加(P<0.05、0.01),胞葬辅助因子MFG-E8、GAS6水平显著降低(P<0.05);与模型组比较,Rac1 抑制剂组炎症因子IL-4、TNF-α 水平显著降低(P<0.05、0.01),淫羊藿苷低、高剂量组均能显著降低相关炎症因子水平,促进胞葬相关辅助因子的分泌(P<0.05、0.01)。
表10 各组小鼠肺组织炎症因子及胞葬辅助因子表达 (±s, n = 6)Table 10 Expressions of inflammatory factors and efferocytosis cofactors in lung tissue of mice in each group (±s , n = 6)
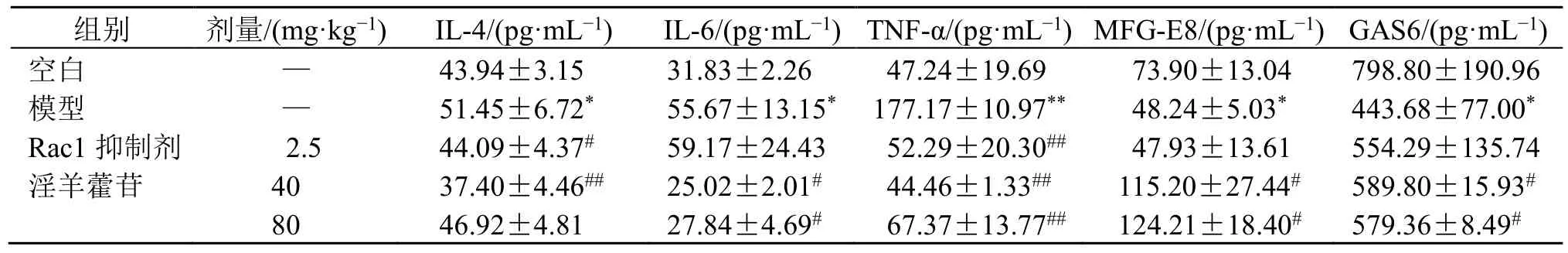
表10 各组小鼠肺组织炎症因子及胞葬辅助因子表达 (±s, n = 6)Table 10 Expressions of inflammatory factors and efferocytosis cofactors in lung tissue of mice in each group (±s , n = 6)
组别 剂量/(mg·kg−1) IL-4/(pg·mL−1) IL-6/(pg·mL−1) TNF-α/(pg·mL−1) MFG-E8/(pg·mL−1) GAS6/(pg·mL−1)空白 — 43.94±3.15 31.83±2.26 47.24±19.69 73.90±13.04 798.80±190.96模型 — 51.45±6.72* 55.67±13.15* 177.17±10.97** 48.24±5.03* 443.68±77.00*Rac1 抑制剂 2.5 44.09±4.37# 59.17±24.43 52.29±20.30## 47.93±13.61 554.29±135.74淫羊藿苷 40 37.40±4.46## 25.02±2.01# 44.46±1.33## 115.20±27.44# 589.80±15.93#80 46.92±4.81 27.84±4.69# 67.37±13.77## 124.21±18.40# 579.36±8.49#
3.7 小鼠肺组织Rac1、PAK mRNA 表达变化
如表11 所示,与空白组比较,模型组小鼠肺组织Rac1、PAKmRNA 表达水平显著升高(P<0.05、0.01);与模型组比较,各给药组Rac1、PAKmRNA表达水平显著降低(P<0.01)。
表11 各组小鼠肺组织Rac1、PAK mRNA 表达 (±s, n = 3)Table 11 Rac1 and PAK mRNA expressions in lung tissue of mice in each group (±s, n = 3)

表11 各组小鼠肺组织Rac1、PAK mRNA 表达 (±s, n = 3)Table 11 Rac1 and PAK mRNA expressions in lung tissue of mice in each group (±s, n = 3)
组别 剂量/(mg·kg−1) mRNA 相对表达量Rac1 PAK空白 — 1.00±0.00 1.00±0.00模型 — 1.25±0.13* 1.69±0.08**Rac1 抑制剂 2.5 0.91±0.10## 0.57±0.03##淫羊藿苷 40 0.83±0.12## 0.84±0.10##80 0.66±0.20## 0.74±0.07##
3.8 小鼠肺组织Rac1、PAK 蛋白表达
如图4 和表12 所示,与空白组比较,模型组小鼠肺组织Rac1、PAK 蛋白表达水平显著升高(P<0.05、0.01);与模型组比较,各给药组Rac1、PAK蛋白表达水平显著降低(P<0.05、0.01)。
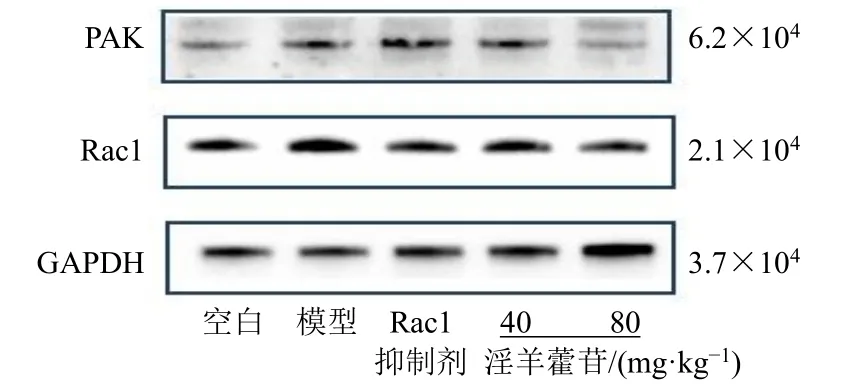
图4 各组小鼠肺组织PAK、Rac1 蛋白表达Fig.4 PAK and Rac1 protein expressions in lung tissue of mice in each group
表12 各组小鼠肺组织PAK、Rac1 蛋白表达 (±s, n = 3)Table 12 PAK and Rac1 protein expressions in lung tissue of mice in each group (±s, n = 3)

表12 各组小鼠肺组织PAK、Rac1 蛋白表达 (±s, n = 3)Table 12 PAK and Rac1 protein expressions in lung tissue of mice in each group (±s, n = 3)
组别 剂量/(mg·kg−1) 蛋白相对表达量Rac1 PAK空白 — 1.38±0.13 0.57±0.18模型 — 2.40±0.54** 1.03±0.26*Rac1 抑制剂 2.5 1.33±0.08## 1.20±0.29淫羊藿苷 40 1.09±0.37## 0.53±0.08#80 0.98±0.31## 0.61±0.06#
3.9 小鼠肺泡巨噬细胞细胞骨架变化
如图5 所示,与空白组比较,模型组小鼠肺泡巨噬细胞形态僵硬,肌动蛋白丝排列紊乱,吞噬E.coli较少,伪足伸出数量较少;与模型组比较,Rac1抑制剂组和淫羊藿苷低、高剂量组小鼠肺泡巨噬细胞形态明显改善,吞噬E.coli变多,丝状伪足伸出。
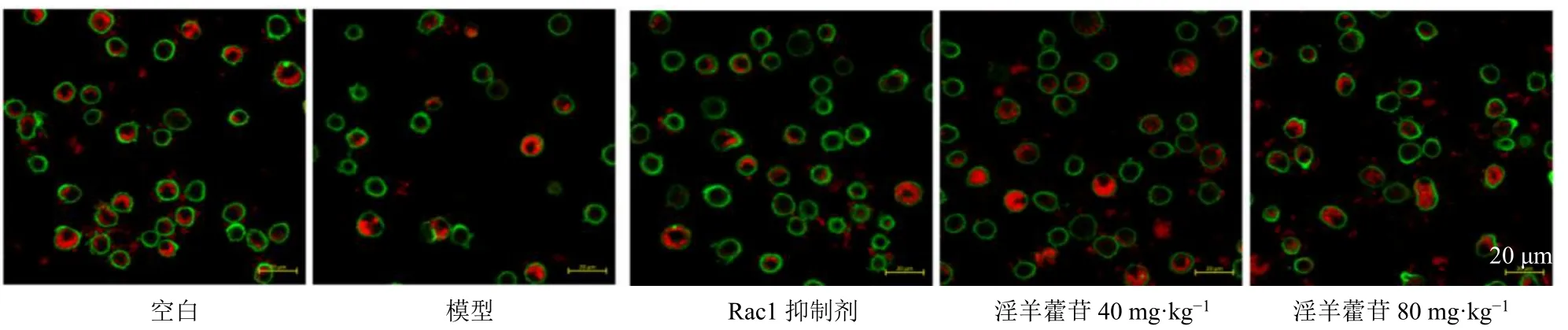
图5 小鼠肺泡巨噬细胞骨架形态变化 (×400)Fig.5 Morphologic changes in cytoskeleton of mouse alveolar macrophages (× 400)
4 讨论
COPD 在中医学属“肺胀”“喘证”范畴,病位主要在肺、脾、肾三脏,以肺虚为始而肾虚为基,且随着患者病情发展,肺、脾、肾功能受损而导致水谷精微等营养物质化生不足,病人营养不良的风险随之增加。本研究造模期间发现,在香烟烟雾熏吸下,小鼠的精神状态及毛发色泽变差,体质量增长缓慢。药物干预后体质量及一般情况有所改善。肺功能是检测及评估COPD 的金标准,通过无束缚小动物全身体积描记仪测定无创肺功能,检测TV、MV、EF50、PEF 评估小鼠肺功能,发现模型组小鼠TV、MV、EF50、PEF 均有一定程度受损,通过肺组织病理切片也可以看出,模型组小鼠肺泡大小不一,断裂融合较多,有明显的萎缩塌陷情况,肺泡腔可见大量炎症细胞浸润,支气管壁明显增厚,纤毛排列不整齐,管腔内外大量炎症细胞浸润,MAN显著降低,MLI 显著上升;而与模型组比较,Rac1抑制剂组与淫羊藿苷低、高剂量组小鼠肺功能指标有一定程度升高,肺组织损伤减轻,表明淫羊藿苷可以改善COPD 小鼠一般状态及肺功能损伤。
COPD 的特征性表现——慢性气道炎症、持续性的呼吸道症状以及进行性的气流阻塞等,与肺泡巨噬细胞吞噬及胞葬功能受损有关。巨噬细胞在肺内分布广泛,占肺内免疫细胞的90%以上[2],巨噬细胞作为前哨细胞,在抗原呈递、释放炎性介质的、募集炎性细胞中起重要作用,在清除死亡或凋亡细胞及组织碎片、结束炎症反应和组织修复中也起重要作用[21-23]。凋亡细胞能够快速被吞噬细胞吞噬,这一过程可以预防死亡细胞释放胞内抗原引起的炎症反应和自身免疫应答是维持内环境稳态的重要基础[24-27]。本研究结果显示,烟雾刺激下小鼠肺泡巨噬细胞吞噬及胞葬功能降低,巨噬细胞以促炎M1型为主,使用Rac1 抑制剂及低、高剂量淫羊藿苷干预后,巨噬细胞吞噬及胞葬功能有所恢复,巨噬细胞由促炎M1 型向抑炎M2 型转化。COPD 患者的肺泡巨噬细胞不仅对流感嗜血杆菌和肺炎链球菌的吞噬能力较差,导致细菌定植及感染的反复发生,而且巨噬细胞对细胞碎片、死亡或凋亡细胞清除的胞葬功能也受到抑制,使坏死物质在肺中积累,从而导致炎症持续存在,加重患者病情[28]。此外,在香烟烟雾刺激下,慢性持续性炎症反应导致TNF-α、IL-6、IL-8 等炎症介质的释放,高表达的TNF-α 负向调节胞葬相关受体分子的表达,使凋亡细胞不能有效清除从而加重炎症反应,而正常的巨噬细胞胞葬亦可以有效减少TNF-α 等炎症因子的分泌,且TNF-α、IL-6 等炎性标志物与COPD 严重程度密切相关,在COPD 稳定期患者血清和痰液中较正常人升高,并在急性加重期进一步升高[29-30]。巨噬细胞对凋亡细胞的清除是结束炎症反应的关键,MFG-E8、GAS6 作为吞噬细胞表面胞葬辅助因子,是吞噬细胞与凋亡细胞之间的纽带[31-33]。研究表明,香烟烟雾暴露下的小鼠肺组织凋亡细胞增加,MFG-E8 水平降低,从而引起巨噬细胞胞葬功能的障碍[34],炎症刺激下GAS6 被抑制导致巨噬细胞胞葬功能降低[35]。本研究通过检测肺组织匀浆中炎症因子与胞葬辅助因子含量,发现模型组小鼠炎症因子IL-4、IL-6、TNF-α 水平增加,胞葬辅助因子MFGE8、GAS6 水平受到抑制,而给予Rac1 抑制剂及淫羊藿苷干预后,炎症有所缓解,胞葬辅助因子水平增加,巨噬细胞吞噬及胞葬功能障碍均得到一定程度的改善。说明淫羊藿苷可以改善香烟烟雾引起的小鼠肺泡巨噬细胞胞葬与吞噬功能障碍,该机制可能与Rac1 通路相关。
现有研究表明,活化的Rac1 介导炎症反应及氧化应激,Rac1 还通过还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶介导活性氧(reactive oxygen species,ROS)的产生[36]。香烟烟雾刺激下会引起肺部炎症反应并导致ROS 大量堆积,进而产生氧化应激导致肺组织损伤[37]。体内外研究发现,暴露在香烟烟雾下的小鼠肺组织Rac1 表达升高并介导肺泡-上皮间充质转化[38]。此外,Rac1 在调控细胞骨架重排中发挥重要作用,巨噬细胞发挥吞噬作用需要细胞骨架形态的变化,通过细胞膜结构的改变形成吞噬杯进而包裹被吞噬物[39-40],其主要过程包括①初始吞噬杯形成:巨噬细胞通过膜表面受体识别病原微生物后,细胞膜内侧产生大量肌动蛋白,聚合的肌动蛋白形成初始吞噬杯;②延展:吞噬杯包绕颗粒物使肌动蛋白大量聚集,根据颗粒物形态动态调整其形态和延展方向;③吞噬杯延伸至最大:随着细胞机械张力的增加,吞噬杯延伸至最大程度,细胞前缘肌动蛋白不断聚合并伴随着后方解聚,保持细胞极性及动态平衡[41-43];④吞噬杯关闭:吞噬杯内包裹颗粒物并完全封闭[39]。肌动蛋白的聚合与解聚、丝的断裂、末端加帽、丝的集束等动态变化被称为“肌动蛋白细胞骨架重构”[44]。Rac1 作为Rho家族的小三磷酸鸟苷酶主要研究对象之一,活跃在细胞前沿,形成膜褶皱及板状伪足,膜褶皱与胞吞作用相关,板状伪足的形成在细胞迁移中发挥重要作用。本研究收集了小鼠肺泡巨噬细胞,使其吞噬灭活的荧光标记大肠杆菌,共聚焦显微镜下观察发现,模型组小鼠巨噬细胞吞噬大肠杆菌较少,形态变圆且僵硬,大量肌动蛋白丝聚合,排列紊乱,而给予Rac1 抑制剂或淫羊藿苷干预后,巨噬细胞吞噬大肠杆菌变多,细胞形态有所改善。Rac1 与下游效应分子结合,协同完成肌动蛋白聚合与解聚,从而使巨噬细胞发挥正常的吞噬和胞葬功能,Rac1 通过胰岛素受体酪氨酸激酶底物p53 蛋白(insulin receptor substrate p53,IRSp53)与WASP 家族蛋白WAVE 结合,刺激Arp2/3 成核肌动蛋白聚合;或通过磷酸化其下游效应器PAK 激活LIM 激酶(LIM kinase,LIMK),活化的LIMK 使得肌动蛋白解聚蛋白cofilin 失活,从而稳定肌动蛋白,此时cofilin可以与突起前缘的Arp2/3 复合物协同作用来促进肌动蛋白聚合,且进一步稳定所形成的板状伪足或膜褶皱[45]。从mRNA 及蛋白表达结果来看,香烟烟雾制备COPD 模型小鼠肺组织中Rac1、PAK 蛋白及mRNA 的表达上调,使用Rac1 抑制剂及低、高剂量淫羊藿苷干预后可下调其相关表达。说明在香烟烟雾刺激下,Rac1 等相关促进肌动蛋白聚合的分子表达均上调,Rac1 作为细胞前缘膜突起形成的关键因子,通过与WAVE 蛋白结合激活Arp2/3 复合物使肌动蛋白聚合排列,使肌动蛋白在细胞前缘不断堆积,作用于巨噬细胞吞噬杯的早期形成,吞噬杯的形成与包裹闭合是1 个动态过程,香烟烟雾导致Rac1 的持续活化使吞噬杯不能完全闭合,细胞骨架重排障碍进而导致吞噬功能障碍。淫羊藿苷可以通过调节Rac1 及其下游分子的表达,介导巨噬细胞骨架结构重排改善其吞噬及胞葬功能障碍。
此外,Rac1 在吞噬过程中被上调,然后在吞噬体成熟之前被下调[46],Rac1 在不断的激活和失活中调控细胞骨架重排,使巨噬细胞发挥吞噬功能,Rac1 活化可以激活巨噬细胞的吞噬功能,但Rac1持续活化则会导致炎症反应加剧,吞噬杯延伸停滞而无法关闭,导致巨噬细胞吞噬功能障碍,同样,Rac1 低表达会下调巨噬细胞摄取颗粒物的活性,抑制吞噬体的闭合。通过体内外实验发现,淫羊藿苷可以调控Rac1 及其下游效应分子的表达,使其恢复正常的激活-失活状态,从而介导巨噬细胞骨架重排,改善COPD 所致肺功能、肺组织损伤,抑制炎症反应。
利益冲突所有作者均声明不存在利益冲突

