1-苯基2-硫脲通过p53调控自噬活性来保护斑马鱼神经丘毛细胞❋
秦彦筠, 范纯新❋❋, 王 建
(1. 上海海洋大学 国家海洋生物科学国际联合研究中心, 上海201306;2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海201306)
毛细胞是一类感受机械刺激的感觉细胞,存在于所有脊椎动物的内耳中,以及鱼类和两栖类的侧线感受器中。内耳毛细胞可以探测环境中的声音信息,毛细胞的异常会导致人类的感音性耳聋[1]。侧线毛细胞用于探测水流运动,在鱼类捕食、避敌、群游和趋流等行为中发挥重要作用[2]。毛细胞的结构精细,对抗生素、重金属离子和噪音等刺激因素异常敏感[3]。因此,毛细胞的再生和存活研究对于人类健康和生物资源保护具有重要意义。
自噬是真核细胞消化溶酶体中大分子和受损细胞器的一个基本分解代谢过程。在正常条件下,细胞自噬通过蛋白质降解和细胞器周转来平衡细胞的蛋白质合成和细胞器的生物活性,为正常细胞提供生长途径[4]。而在应激条件下,如饥饿、缺氧或细胞损伤等,自噬也可以作为一种促生存的途径来响应这些刺激[5]。已有研究表明,在各种类型的听力损失中,自噬对毛细胞存活具有保护作用[6-7]。Pang等[8]在顺铂的耳毒性实验中发现,自噬可抑制斑马鱼侧线和小鼠耳蜗免受顺铂诱导的毛细胞丢失。细胞自噬与肿瘤抑制蛋白p53基因(Tumor protein p53 gene,tp53)间存在重要的互作,tp53可以通过激活自噬基因,促进细胞自噬的发生[9]。但细胞自噬是否通过p53保护毛细胞尚不清楚。
苯基硫脲(PTU)是酪氨酸酶的抑制剂,常被用于阻断斑马鱼胚胎的色素形成。近期的研究表明:PTU可以激活斑马鱼胚胎细胞中的细胞自噬,PTU处理导致自噬体和自噬溶酶体形成,溶酶体富集[10]。侧线神经丘中的毛细胞与内耳毛细胞同源,且位于体表,易于观察,已成为感音性耳聋理想的研究模型[11]。本研究中,将利用斑马鱼仔鱼分析PTU是否通过促进细胞自噬来保护侧线神经丘毛细胞,这个过程是否通过p53发挥作用,从而为进一步理解毛细胞的存活和保护奠定基础。
1 材料与方法
1.1 材料
本课题所用的野生型AB品系购自国家斑马鱼研究中心,标记毛细胞的Tg(Brn3c:GFP)系为中国海洋大学赵呈天教授课题组惠赠。成体斑马鱼养殖在斑马鱼养殖单元中(海圣),每天早晚喂食新鲜孵化的丰年虫。室温控制在26~28 ℃,循环水体PH为7.0~8.0,固定光周期为14 h光照、10 h黑暗。斑马鱼胚胎饲养在蓝水(0.3 g/L红海盐以及0.4 mg/L亚甲基蓝)中,置于28.5 ℃恒温培养箱中培养。受精后5 d,仔鱼出壳后转移至光照培养箱喂养开口饵料草履虫,受精后10 d混喂草履虫和新鲜孵化的卤虫,受精后15 d可转移至水系统饲养,用于后续实验。有关斑马鱼的所有实验操作均符合上海海洋大学动物伦理委员会相关规定。
1.2 PTU处理和溶酶体染色
将苯基硫脲(PTU,购买自sigma)用二甲基亚砜(DMSO)溶解后,用新鲜配制的1× Holt’s Buffer (1.75 g/L NaCl、0.05 g/L CaCl2、0.025 g/L KCl和0.5% HEPES) 配制成不同浓度的溶液。将受精后24 h的斑马鱼胚胎浸泡在装有PTU溶液的12孔板中,每个孔盛放15条斑马鱼,对照组用等量的DMSO溶液处理。将其放置在28.5 ℃恒温培养箱培养,每天更换新鲜的药物。
将Lyso Tracker Red DND-99 (Yeasen) 按1∶1 000稀释,从而得到终浓度为10 μmol/L的工作液,然后将斑马鱼仔鱼浸泡在该工作液中于28.5 ℃避光染色1 h。染色完成后,用1× Holt’s Buffer清洗仔鱼3次,用麻醉剂MS-222 (0.1 mg/mL) 处理后,将其包埋在1.5%低熔点琼脂糖中,保持侧面贴在薄底小皿底部,并用荧光倒置显微镜成像观察。
1.3 斑马鱼后侧线毛细胞标记
用新鲜配制的1× Holt’s Buffer将YO-PRO-1 (Thermo Fisher) 配制成2 μmol/L的染色工作液,然后将受精后3和5 d的斑马鱼仔鱼均用该工作液浸泡染色(28.5 ℃避光),1 h后用1× Holt’s Buffer清洗鱼体3次,每次5 min。用MS-222麻醉斑马鱼仔鱼5 min后,在荧光倒置显微镜488 nm通道下对活体斑马鱼侧线神经丘毛细胞进行观察计数。每个实验的实验组和对照组样本量都大于12。
1.4 荧光定量PCR
荧光定量PCR采用诺唯赞公司的ChamQ Universal SYBR qPCR Master Mix试剂盒。以斑马鱼cDNA为模板,以真核翻译延伸因子1α1基因 (eef1α1|1) 为内参基因(见表1),每个样品检测设置3个平行,利用Applied Biosystem ABI 7500定量PCR仪(ABI 7500)进行荧光定量PCR,根据2-ΔΔCt计算目标基因在不同样品中的相对表达量,并用t-检验对相对表达量进行差异显著性分析。

表1 引物信息Table 1 Information of primers
1.5 整胚原位杂交
收集受精后5 d的斑马鱼胚胎,用4%多聚甲醛(4% PFA)固定后,放置于4 ℃过夜。固定后的样品用甲醇室温脱水5 min,再换取新鲜的甲醇放置-20 ℃保存。全程都需要尽量保持RNase-Free的环境。完全脱水后的样品经PBST (2.5 mL 20×PBS+0.1% Tween-20) 梯度复水后,用10%过氧化氢溶液使胚胎脱色成米黄色,然后用10 μg/mL的蛋白酶K在37 ℃消化通透5 min,换上4% PFA重新室温固定30 min。加入含反义探针的杂交液,于70 ℃孵育过夜。孵育之后依次经过漂洗、封闭、抗体孵育和漂洗,然后在室温下用碱性磷酸酶溶液(NBT/BCIP stock solution)避光显色。显色完成后,用4% PFA终止显色反应,经过PBST溶液漂洗后加入100%甘油长期保存,用体式镜进行观察并拍照。
1.6 sgRNA的设计和合成
利用CRISPRscan设计靶向于tp53第五外显子的 sgRNA。合成含有sgRNA靶序列的特异性Oligo:5’端包含T7启动子序列,3’端包含下游通用引物的互补序列(见表1)。将该特异性Oligo与下游通用Oligo共同进行PCR,然后把所得PCR产物通过利用T7 High Yield RNA Synthesis Kit (Vazyme) 进行体外转录合成sgRNA。经过 DNaseⅠ消化后,产物用RNA Clean &Concentrator Kit纯化,纯化后的产物放置于-80 ℃保存。
1.7 Cas9 mRNA合成
用XbaⅠ限制性核酸内切酶(Thermo Fisher)将质粒pT3TS-nlsCas9nls线性化处理,所得线性化产物用普通DNA产物纯化试剂盒(Vazyme)进行纯化。用mMessage mMachine T3 Transcription Kit试剂盒体外转录获得Cas9 mRNA,最后用RNA Clean &Concentrator Kit纯化终产物,并保存于-80 ℃。
1.8 显微注射和基因分型
收集1~2细胞期的斑马鱼胚胎,利用显微注射仪将混合液通过显微注射针注射到细胞质中。每颗卵注射约300 pg Cas9 mRNA和50 pg sgRNA。注射后的胚胎转移到蓝水中28.5 ℃恒温培养。将受精后培养约24 h的胚胎用碱裂解法提取DNA。PCR扩增后(见表1)将所得产物送生工生物工程公司进行毛细管电泳检测,判断是否敲除成功。将成功注射后的胚胎继续培养至性成熟,与野生型AB交配获得子代F1,将F1饲养至一个月以上,剪取它们的尾部组织,然后由碱裂解法进行基因分型,挑选出杂合突变F1并将它们内交,对获得的子二代F2继续用碱裂解法进行基因分型以获得纯合突变体。
另外,本研究中还根据野生型基因座和突变型基因座设计基因座特异性的基因分型引物(见表1),对模板DNA进行PCR,确定其DNA的基因型。
2 结果
2.1 PTU促进神经丘毛细胞自噬
本研究中,利用能标记溶酶体的Lyso Tracker探针去观察细胞内溶酶体和自噬溶酶体的含量情况,以此来反映细胞内的自噬情况。结果显示:DMSO处理组神经丘在15 min后仍有较清晰的信号轮廓;PTU处理组神经丘中的Lyso Tracker信号虽然早期更强,但信号弥散得更快,15 min后就变得弥散(见图1A)。为了确定神经丘内发生自噬的细胞类型,对受精后3 d斑马鱼同时进行YO-PRO-1和Lyso Tracker染色,发现溶酶体染色阳性的细胞和YO-PRO-1阳性的毛细胞共定位(见图1B),这表明:PTU在神经丘中诱导的自噬主要发生在毛细胞中。
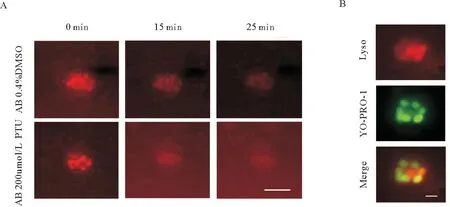
(A: 经200 μmol/L PTU处理受精后3 d野生型斑马鱼的溶酶体染色情况。标尺:50 μm。B: 受精后3 d斑马鱼毛细胞和溶酶体染色阳性细胞的共定位。标尺:10 μm。A: Lysosome staining in 3 days post fertilization wildtype zebrafish treated with 200 μmol/L PTU. Scale bar: 50 μm. B: Co-localization of 3 days post fertilization zebrafish hair cells and lysosome-positive cells. Scale bar: 10 μm.)图1 PTU促进神经丘毛细胞自噬Fig.1 PTU induces neuromast hair cell autophagy
2.2 PTU处理保护神经丘毛细胞
本研究中,利用荧光成像技术,在Tg(Brn3c:GFP)背景下观察PTU对毛细胞数量的影响。发现在200 μmol/L PTU处理下,实验组毛细胞数量多于对照组(见图2A—C)。本文作者还用YO-PRO-1对毛细胞进行活体染色,检测不同浓度的PTU对斑马鱼神经丘毛细胞的影响。染色结果表明无论是受精后3 d(见图2B)还是受精后5 d(见图2C),在200 μmol/L的PTU处理下,毛细胞数量都显著多于对照组,而当PTU浓度再升高时,毛细胞则没有显著增多,甚至在800 μmol/L的时候显著减少。因此,2种毛细胞标记方法都显示200 μmol/L的PTU促进毛细胞的存活。
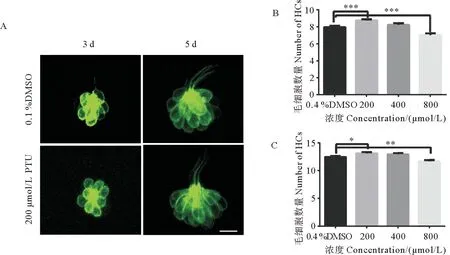
(A: 200 μmol/L PTU处理后,Tp(Brn3c:GFP)转基因斑马鱼毛细胞成像图。标尺:25 μm。B: 不同浓度PTU处理受精后3 d野生型斑马鱼的毛细胞定量分析,纵坐标为毛细胞数量。:p<0.001。C: 不同浓度PTU处理受精后5 d野生型斑马鱼的毛细胞定量分析,纵坐标为毛细胞数量。:p<0.05,:p<0.01。A: Imaging of Tg(Brn3.1:GFP) transgenic zebrafish hair cells after 200 μmol/L PTU treatment. Scale bar: 25 μm. B: Quantitative analysis of hair cells in 3 days post fertilization wildtype zebrafish treated with different concentrations of PTU. The Y-axis is the number of hair cells. : p<0.001. C: Quantitative analysis of hair cells in 5 days post fertilization wildtype zebrafish treated with different concentrations of PTU. The ordinate is the number of hair cells. : p<0.05, : p<0.01.)图2 PTU处理保护神经丘毛细胞Fig.2 PTU treatment protects neuromast hair cells
2.3 敲除斑马鱼tp53基因
据报道,p53在细胞自噬过程中发挥重要作用[12]。为了确定tp53基因是否参与PTU诱导的神经丘毛细胞自噬,本文作者对PTU浸泡过的斑马鱼仔鱼用qPCR检测其tp53表达情况。结果显示:PTU处理组tp53表达量显著高于对照组(见图3A),这表明PTU处理可诱导tp53表达。另外,整胚原位杂交结果表明,tp53基因在斑马鱼侧线神经丘发育过程中呈现动态表达。在受精后3 d时表达量较高,而在受精后5 d时表达量显著降低(见图 3B)。接下来,利用 CRISPR/Cas9 技术敲除斑马鱼tp53基因。突变的tp53基因座gRNA靶点位置缺少了8个核苷酸CCCTCCAC,推测突变的tp53基因序列提前终止表达,因此其表达产物仅保留了N端的反转录激活域和一段残缺的DNA结合域(见图3C)。同时,qPCR结果显示:在受精后5 d斑马鱼中,tp53纯合突变体内该基因的表达量显著低于野生型。这表明:tp53敲除导致无义介导的mRNA降解(见图3D)。由此可见,在本研究中,本文作者成功地建立了tp53功能缺失的突变体斑马鱼。
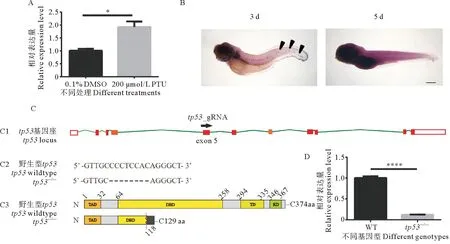
(A: 经200 μmol/L PTU处理受精后3 d野生型斑马鱼tp53的表达情况。纵坐标为相对表达水平。:p<0.05。B: tp53基因在斑马鱼后侧线神经丘中表达情况,通过整胚原位杂交检测受精后3 d和5 d时期的野生型斑马鱼中tp53基因的表达情况。标尺:200 μm。C: sgRNA在tp53基因上的靶点(见图C1),缺失的碱基对(见图C2)以及预测的突变体p53蛋白结构(见图C3)示意图。D: qPCR结果显示tp53基因在野生型个体和tp53-/-突变体中的相对表达量。纵坐标为相对表达水平。WT:野生型;:p<0.000 1。A: Relative expression of tp53 in 3 days post fertilization wildtype zebrafish treated with 200 μmol/L PTU. The Ordinate is the relative expression level. : p<0.05. B: The expression of tp53 gene in the zebrafish posterior lateral line neuromast. The expression of tp53 gene in wildtype zebrafish at 3 and 5 days post fertilization stages was detected by whole embryo in situ hybridization. Scale bar: 200 μm. C: The schematic diagram of the sgRNA target on the tp53 gene (see figure C1), the missing base pairs (middle see figure C2), and the predicted mutant p53 protein structure (see figure C3). D: qPCR result shows the relative expression of tp53 gene in wildtype and tp53-/- mutant zebrafish. The ordinate is the relative expression level.WT:Wildtype; : p<0.000 1.)图3 敲除斑马鱼tp53基因Fig.3 Knocking out tp53 in zebrafish
2.4 tp53突变不影响神经丘毛细胞的数量
研究表明:p53参与细胞凋亡调控,p53可以促进细胞凋亡[13]。为了分析tp53突变是否直接影响神经丘毛细胞的数量,本文作者用YO-PRO-1对tp53突变体斑马鱼的神经丘毛细胞进行活体染色,检测tp53突变是否影响神经丘毛细胞的数量。统计结果显示,无论是受精后3 d还是受精后5 d,tp53纯合突变体的毛细胞数量相较于野生型和tp53杂合突变体都没有显著性差异(见图4)。这说明tp53的突变可能不直接影响神经丘毛细胞的存活。
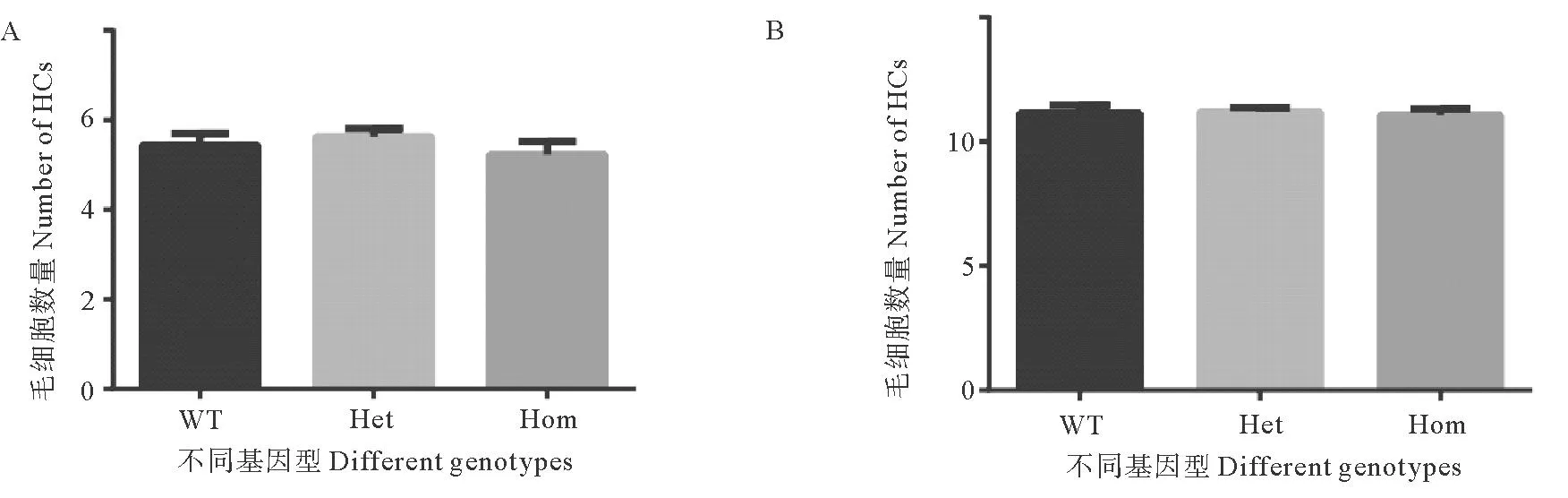
(A: 受精后3 d tp53杂合子内交子代毛细胞的定量分析。纵坐标为神经丘毛细胞数量。B: 受精后5 d tp53杂合子内交子代毛细胞的定量分析。纵坐标为神经丘毛细胞数量,横轴中WT、Het和Hom分别代表野生型,杂合型和纯合型。A: Quantitative analysis of tp53 heterozygous inbred progeny hair cells at 3 days post fertilization. The ordinate is the number of hair cells in neuromast. B: Quantitative analysis of tp53 heterozygous inbred progeny hair cells at 5 days post fertilization. The ordinate is the number of hair cells in neuromast. WT, Het and Hom in abscissa represents wildtype, heterozygous and homozygous, respectively.)图4 tp53突变不影响神经丘毛细胞的数量Fig.4 tp53 mutation does not affect the number of neuromast hair cells
2.5 tp53突变减弱PTU对神经丘毛细胞的保护
为了确定tp53突变是否影响斑马鱼神经丘的细胞自噬,本文作者用200 μmol/L PTU处理野生型AB系斑马鱼个体和tp53-/-突变体后观察其神经丘的Lyso Tracker信号,通过荧光显微镜实时成像发现,PTU处理的tp53-/-突变体毛细胞Lyso Tracker信号和野生型染色标记消退的速度接近,在15 min左右依旧能看清细胞的轮廓(见图5A)。表明tp53缺失后,PTU诱导的毛细胞自噬活性减弱。
为了阐明PTU诱导的神经丘毛细胞增多是否通过tp53发挥作用,本文作者在tp53-/-突变体中检测PTU处理对神经丘毛细胞数量的影响。经过毛细胞计数后发现,在受精后3和5 d,不同浓度的PTU处理下,除了在高浓度下毛细胞数量略微下调外,其他组毛细胞数量与对照组并没有显著差异(见图5B、C)。这表明PTU诱导毛细胞的增多可能是通过p53来实现的。
3 讨论
本研究中,发现PTU处理导致斑马鱼毛细胞溶酶体染色消退的速度较对照组明显加快,同时毛细胞数量较对照组多。而tp53突变抑制了PTU对溶酶体的活化和毛细胞的保护。溶酶体是自噬泡的降解部位,溶酶体的降解速度反映了自噬的活性[14]。另外,p53可通过转录激活促进自噬发生[9]。文献[8]的研究表明:细胞自噬可以保护毛细胞的存活。因此,本研究结果暗示PTU很可能通过p53诱导毛细胞内自噬溶酶体降解速度加快,从而促进毛细胞的存活。
毛细胞的保护对于人类健康和动物适应环境具有重要意义。凋亡抑制因子、抗氧化小分子和热激蛋白等在毛细胞保护中都起到重要作用[15-16]。细胞自噬是通过降解异常蛋白和衰老细胞器进而维持细胞存活的重要途径。He等[6]研究发现:新霉素或庆大霉素处理导致小鼠耳蜗毛细胞的自噬活性增加,若用自噬激活剂增加其自噬活性,则细胞的活性氧水平,凋亡和细胞死亡水平显著降低,揭示自噬通过抑制氧化应激来保护新霉素诱导的氧化损伤。Pang等[7]研究发现:在老化的耳蜗中miR-34a表达量明显升高,伴随吞噬体积累,自噬溶酶体融合受损,从而抑制细胞自噬,进而导致细胞死亡。与上述发现一致,本研究的侧线神经丘毛细胞中有明显的溶酶体信号,在用PTU加速了溶酶体信号的消退情况下,存活的毛细胞增多,这表明细胞自噬对毛细胞的保护在神经丘和内耳毛细胞中是保守的,未来可通过激活细胞自噬以开发保护毛细胞的药物或方法。另外,本文作者发现的保护神经丘毛细胞的PTU这类小分子化合物可以作为保护内耳毛细胞的候选,进一步在小鼠内耳等模型中确定其功能。
PTU是实验室用于抑制斑马鱼胚胎色素形成的常用手段。但是,本文作者和以往研究者的工作都显示出PTU可促进斑马鱼胚胎脑、上皮细胞和毛细胞等多种组织的自噬[10]。细胞自噬与多种生理和病理过程有关,如癌症、神经退行性疾病和细胞分化等。本文作者发现,PTU对神经丘毛细胞的存活有促进作用,这提示在利用斑马鱼侧线神经丘作为模式以研究毛细胞损伤、保护和再生时,需要尽可能避免使用PTU抑制胚胎色素形成,因为PTU的处理可能会对结果造成干扰。

