人工智能辅助诊断系统预测肺腺癌PD-L1表达水平的应用研究
佘李岚 黄妹兰 薛蕴菁
目前在全球范围内,肺癌仍是发病率和死亡最高的恶性肿瘤。近些年来,肿瘤免疫治疗方法的快速发展为晚期肿瘤患者的治疗带来了福音。免疫治疗种类繁多,包括免疫检查点阻断剂、免疫调节剂、抗体治疗、细胞因子等方法,而免疫检查点阻断剂(immune checkpoint inhibitors,ICIs)通过调节T 细胞活性的形式,提高机体抗肿瘤免疫反应,受到临床医生和患者的青睐[1]。其中以细胞程序性死亡受体1(programmed death receptor-1,PD-1)或程序性死亡配体1(programmed death-ligand 1,PD-L1)抑制剂为代表的免疫治疗方法在肺癌的诊治中取得了较大的发展[2]。目前对肺癌PD-L1 表达水平的检测主要依靠免疫组织化学技术;但免疫组化需通过局部手术或穿刺来获取肿瘤组织标本,并且检查费用相对昂贵,这种有创的操作方式加重了晚期肿瘤患者的生理负担和经济压力。因此,探索一种无创的医学影像生物标记物以反映癌组织的PD-L1 表达水平,成为亟须解决的难题。人工智能(artificial intelligence,AI)在医学影像领域具有广阔的应用前景,特别是在肺癌的诊断方面,已成为最热门的研究焦点之一[3]。但关于人工智能技术用于预测肺腺癌PD-L1 表达水平的研究鲜有报道。因此,本研究主要探讨肺结节人工智能辅助诊断系统提取的肺癌肿块的形状纹理信息能否预测肺癌PD-L1 表达,并明确其临床应用价值。
1 资料与方法
1.1 一般资料
回顾性收集2022 年1 月—2022 年4 月于福建医科大学附属协和医院胸外科行手术切除或穿刺活检的肺腺癌患者139 例。所有患者均接受肺部CT 检查,并通过医院信息系统(hospital information system,HIS)系统收集患者的临床信息,包括性别、年龄、细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)表达水平、吸烟史(烟龄≥5 年)、表皮生长因子受体(epidermal growth factor receptor,EGFR)状态。纳入标准:(1)经病理证实为浸润性肺腺癌。(2)在术前或穿刺前2 周内行肺部CT 检查。(3)肺部CT 图像质量符合诊断标准。排除标准:(1)CT 检查前已接受穿刺活检、放化疗等临床干预手段,破坏肿瘤原生形态。(2)CT 图像质量差而影响诊断。本研究已获得医院伦理委员会批准(伦理号:2022WSJK024),并豁免患者知情同意。
1.2 方法
1.2.1 扫描协议
本研究使用的设备为256 排GE Revolution CT(通用电器,美国)。患者取仰卧位,双手上举抱头,扫描范围从肺尖到肾上腺。管电压为120 kVP,管电流设为自动毫安(smart mA),扫描层厚5 mm,图像矩阵512×512,旋转时间为0.50 s,探测器宽度为80 mm,螺旋模式螺距为0.992 ∶1,转速158.75 mm/s,重建层厚1.25 mm。嘱患者吸气后屏住呼吸扫描。
1.2.2 图像处理
将层厚1.25 mm 的CT 肺窗图像(窗宽:1 500,窗位:-600)导入推想肺结节智能分析系统,自动生成相应的结节AI 参数,纳入结节最长径、结节体积、实性成分占比、CT 最大值、CT 最小值、平均CT 值、中位CT 值、CT 标准差、紧凑度、球形度、CT 值的峰度和偏度、熵。
1.2.3 PD-L1 表达水平测定
将穿刺活检或手术取得的肺癌组织样本,以10%甲醛进行固定、石蜡包埋和切片,通过标准规范的免疫组织化学法检测PD-L1 蛋白的表达。采用肿瘤细胞阳性比例分数(tumor proportion score,TPS)评分测量PD-L1 的表达水平,TPS <1%判定为阴性,TPS ≥1%判定为阳性[4]。
1.3 统计学方法
运用SPSS 23.0 统计学软件进行数据分析。采用Shapiro-Wilk 检验对年龄、AI 参数等连续性计量资料进行正态性分析,服从正态分布则采用独立样本t检验分析,以(±s)表示,不服从正态分布则采用Mann-WhitneyU检验,以中位数和四分位数间距描述数据基本分布特征。性别、吸烟史、EGFR 状态等计数资料用n(%)表示,采用Pearsonχ2检验。检验水准设为α=0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 PD-L1 阳性组与PD-L1 阴性组临床指标比较
两组年龄、性别、吸烟史、EGFR 状态比较,差异有统计学意义(P<0.001),见表1。相较于PD-L1 阴性组,PD-L1 阳性组多为年龄较大且有吸烟史的男性患者,具有更高的EGFR 突变率。
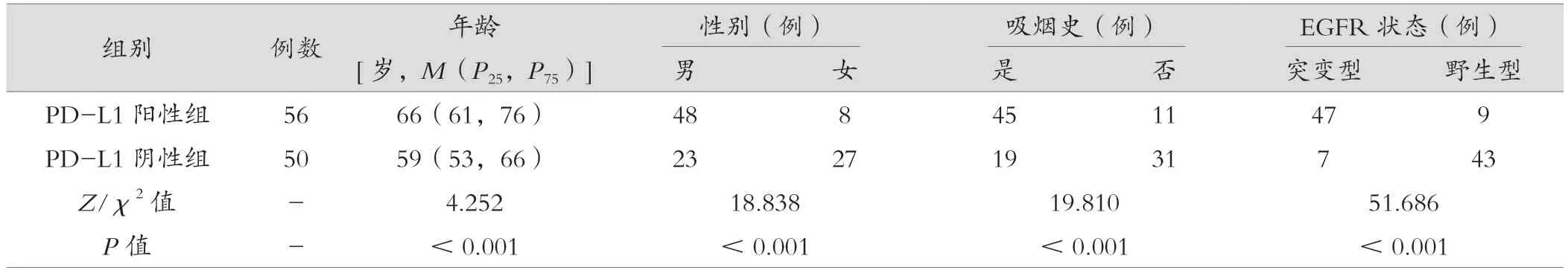
表1 PD-L1 阳性组与PD-L1 阴性组临床指标比较
2.2 PD-L1 阳性组与PD-L1 阴性组肺部CT 的AI 参数比较
两组肿块的最大径、体积、CT 最小值、CT 平均值、CT 中位数、实性成分占比、紧凑度、CT 值的峰度和偏度比较,差异有统计学意义(P<0.001);相较于PD-L1 阴性组,PD-L1 阳性组肿块尺寸更大,密度更高,含有更多的实性成分,且形态较不规则,见表2。

表2 PD-L1 阳性组与PD-L1 阴性组肺部CT 的AI 参数比较[M(P25,P75)]
3 讨论
NSCLC 是当今世界范围内癌症相关死亡的主要原因[5]。针对PD-1 或PD-L1 的免疫检查点抑制剂已成为无靶向治疗选择患者的主要治疗方法。然而,只有20%~30%的患者对免疫检查点阻滞剂能保持持久的反应。强大的预测性生物标志物可能有助于确定哪些患者可能受益于基于免疫检查点抑制剂的治疗,哪些患者可能受益于其他治疗策略。尽管目前医学上已经提出了许多关于免疫检查点抑制反应的分子预测指标,而且美国食品和药物管理局已经批准将PD-L1 和肿瘤突变负荷作为生物标志物,用于指导NSCLC患者的治疗选择[6];但这些特征都不能完全反映结果的变化,这表明免疫检查点抑制的获益是由肿瘤、微环境和宿主的相互作用协调而成的[7]。而免疫组化的结果受肿瘤活检标本组织的取样量大小、肿瘤内异质性的影响,并且费用相对昂贵,因此有一定的应用限制[8-9]。相比之下,医学影像已经被常规用于肿瘤的诊断分期和预后评估,并且可以无创地捕获整个肿瘤及其背景实质。此外,肿瘤的生物学特性及其与肿瘤免疫微环境的相互作用产生了不同的成像表型,通过机器学习和深度学习算法,可以挖掘以预测临床结果和基因组特征。因此,本研究通过CT 影像与深度学习相结合,提供了一种非侵入性的方法来识别与免疫检查点抑制反应相关的生物学功能,有利于后续开发预测性的生物标志物,为免疫检查点抑制剂的治疗选择提供信息。通过无创的CT 检查方式结合人工智能辅助诊断系统,客观量化肿瘤内部异质性信息,得出了肺肿块的形态、纹理信息的量值,并证实了肺部CT 的AI 参数对预测PD-L1 表达水平有一定的价值。
免疫检查点阻断是一种调节T 细胞活性以改善抗肿瘤免疫反应的方法。PD-1/PD-L1 通路在免疫应答中起着重要作用。通过肿瘤细胞表达的PD-L1 和T 淋巴细胞上表达的PD-1 的直接结合,促使肿瘤免疫逃逸[10]。因此,PD-L1在肿瘤细胞表面的表达可能是抗Pd -1/PD-L1 免疫治疗的重要预测生物标志物。免疫检查点阻断剂的问世改善了肺癌患者的预后水平,延长患者的总生存期。已有较多的研究证实PD-L1 的表达水平与免疫治疗效果及患者的生存结局存在相关性[11-12];而较高的PD-L1 表达水平往往预示着良好的免疫治疗效果。如果能够建立PD-L1 表达与放射学表型之间的关联,则可以用来反映对免疫检查点抑制剂的反应。但目前关于PD-L1 表达与放射学特征之间的相关性还没有得到很好的研究。
本研究中,PD-L1 的阳性表达在有吸烟史的男性中更为常见,进一步证实了PD-L1 表达的发生率与烟草暴露相关[13];但这一发现的生物学解释尚不清楚,值得进一步研究。笔者认为暴露于烟草致癌物可能导致更多的高度突变的肿瘤,吸烟者比从不吸烟者的肿瘤暴露更多的新抗原,导致更高的PD-L1 表达。此外,吸烟诱导的炎症反应涉及T 细胞促炎细胞因子,包括干扰素-γ(interferon-γ,IFN-γ),而干扰素是目前已知可诱导PD-L1 表达的细胞因子[14]。
同时,本研究发现PD-L1 阳性表达的肿瘤尺寸相对较大,EGFR 突变更常见,肿瘤的大小能一定程度上反映肿瘤负荷,这也提示高PD-L1 表达水平与较高的病理分级和较差的病理亚型密切相关[15]。同时,PD-L1 阳性组相较于PD-L1 阴性组,前者具有更高的肿块密度值和实性成分占比。有学者发现微乳头状腺癌和实性腺癌的生存率较低,这也表明PD-L1 表达的患者可能预后较差[16]。实变区(密度高)主要代表纤维化灶或实性生长模式的肿瘤,而磨玻璃病变区(ground glass opacity,GGO)反映肿瘤细胞取代肺泡内壁细胞的生长模式区域。在肿瘤发生过程中,腺癌取代肺泡壁的鳞状生长模式在CT 上表现为GGO。相比之下,CT 上的实性成分表明肺泡壁塌陷、纤维化或侵袭性肿瘤细胞增殖[17]。肿瘤实性成分的百分比与病理侵袭程度存在相关性,从组织形态学的角度来看,实体和微乳头状优势肿瘤比基于GGO 的肿瘤具有更大的恶性潜能,由此可以推断,PD-L1 的表达与更具侵袭性的腺癌病理类型显著相关。另外,本研究还证实肿块的紧凑度和球形度与PD-L1 表达有关,紧凑度、球形度与肿块的形态密切相关,数值越接近1,代表肿块越接近类球形、形态越规则。而肿块的形态特征被认为是区分良性和恶性肺肿瘤的重要影像学特征。既往有部分学者通过分析肺癌患者的肺部CT 影像,发现PD-L1 的表达水平与肿块的影像特征具有相关性,病灶周围缺乏GGO,周围血管集束征,邻近胸膜凹陷,特别是形态不规则,呈现分叶、毛刺、空洞、密度值高、实性成分比例大的肿块,多为PD-L1 表达阳性[18-19],这与本研究的观点一致。
综上所述,通过比较肺部CT 的AI 量化参数与PD-L1表达的相关性,显示肿瘤最大径、体积、CT 最小值、平均CT 值、中位CT 值、实性成分占比、紧凑度、CT 值的峰度和偏度对于预测PD-L1 表达水平有一定的价值。推荐AI和临床指标相结合,可作为PD-L1 表达的无创预测方式。
本研究的局限性:(1)本研究为回顾性研究,未能全面纳入更多有用信息。(2)本研究排除了已接受临床干预的患者,这可能与真实世界的患者构成研究存在出入。(3)仅在单中心展开研究,结果可能存在一定的选择偏移。

