调强放疗联合免疫治疗对食管鳞状细胞癌患者的效果
杨延灵,张宛莉,陈亚楠,申静
[安阳市肿瘤医院(河南科技大学第四附属医院) 放疗五科,河南 安阳 455000]
食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)发病率占所有恶性肿瘤的2%,大部分患者确诊时已处于中晚期,已失去最佳手术时机[1]。针对中晚期恶性肿瘤患者治疗方案主要为综合治疗,大部分患者可从中获益。树突状细胞-细胞因子诱导的杀伤细胞(dendritic cells-cytokine-induced killercells,DC-CIK)可杀灭肿瘤细胞[2]。调强放疗是一种影像引导调强适形放疗,可促使靶区照射充分,控制病灶转移,还可避免病灶周围正常组织受损[3-4]。目前调强放疗、免疫治疗在中晚期ESCC患者中的应用价值尚未明确。本研究主要分析调强放疗联合DC-CIK在ESCC中的应用效果,并分析其对肿瘤标志物、免疫功能、生活质量的影响。
1 对象与方法
1.1 研究对象
选取2019年4月至2022年6月安阳市肿瘤医院收治的205例ESCC患者为研究对象,依据其治疗意愿分为单一组(98例)和联合组(107例)。单一组:男62例、女36例,年龄56~73(64.25±2.63)岁,体重指数18~26(21.85±1.28)kg·m-2,卡氏功能状态评分[5]63~82(72.32±2.93)分,病灶部位上段18例、中段49例、下段31例,临床分期Ⅲ期47例、Ⅳ期51例。联合组:男68例、女39例,年龄54~74(63.85±3.02)岁,体重指数15~29(22.03±2.04)kg·m-2,KPS评分62~81(71.63±3.02)分,病灶部位上段20例、中段53例、下段34例,临床分期Ⅲ期52例、Ⅳ期55例。两组一般资料比较差异无统计学意义(P>0.05)。本研究已获得医院医学伦理委员会审核批准,患者对本研究内容知情,自愿签署知情同意书。
1.2 纳入与排除标准
纳入标准:符合ESCC诊断标准[6];食管无穿孔现象;近期未接受化疗;原发性食管癌;预计生存期>6个月;不符合手术指征;认知、沟通、精神正常;依从性良好。排除标准:造血功能障碍;全身急慢性感染;存在活动性出血征象;合并远处转移;对本研究治疗方案存在禁忌证;合并免疫系统疾病;合并多系统纤维化病变。
1.3 治疗方法
(1)两组均接受常规化疗治疗。采用紫杉醇(辰欣药业股份有限公司,国药准字H20057404)联合顺铂(山东凤凰制药股份有限公司,国药准字H20056422)方案。第1天静脉滴注紫杉醇135 mg·m-2;第1~3天静脉滴注顺铂30 mg·m-2,以21 d为1个治疗周期,连续治疗2个周期。(2)单一组接受调强放疗,操作方法:取仰卧位行颈胸腹部增强CT扫描(层厚3 mm),选取食管病变及纵隔淋巴结(病灶长度>10 mm且直径>10 mm)作为大体肿瘤靶区;计划靶区范围食管病变上下外放2~3 cm,纵膈淋巴结上下外放10 cm、左右外放5~8 cm及相应纵膈淋巴结引流区,95%肿瘤计划靶区肿瘤吸收剂量设置为56~66 Gy,95% PTV肿瘤吸收剂量设置为50~54 Gy,照射线为6 MVX,每日1次,连续治疗5 d后休息2 d。(3)联合组接受调强放疗联合DC-CIK治疗[7],采集外周血单核细胞进行DC-CIK培养,培养14 d后分2次回输给患者,每2周1次,单次回输DC-CIK数>1×109个。两组以21 d为1个治疗周期,连续治疗2个治疗周期。
1.4 观察指标
(1)临床疗效[8]:依据实体肿瘤疗效评价标准,完全缓释为肿瘤病灶消失且持续时间>4周;部分缓释为所有可测量肿瘤病灶长径总和缩小≥30%且持续时间>4周;疾病进展为所有可测量肿瘤病灶长径总和增加≥20%或出现新病灶;疾病稳定为不符合上述标准。客观缓释率为完全缓解率和部分缓解率的和。(2)肿瘤标志物水平:分别于治疗前后采集患者晨起空腹肘静脉血12 mL,血液样本分为4份(每份3 mL),离心后取血清置于-20 ℃保存待测。采用化学发光法检测癌胚抗原(carcinoembryonic antigen,CEA)、细胞角质蛋白19片段抗原21-1(cyto-keratin 19 fragment antigen 21-1,CYFRA21-1)、鳞状上皮细胞癌抗原(squamous cell carcinoma antigen,SCCA)水平,南京森贝伽生物公司提供检测试剂盒。(3)免疫功能:采用免疫荧光法检测CD3+、CD4+、NK细胞(北京同生时代公司)。(4)血管生长因子:采用ELISA法检测血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)水平,上海酶联生物提供检测试剂盒。(5)微小RNA-137(microRNA-137,miR-137)、微小RNA-155(microRNA-155,miR-155)表达量:采用实时荧光定量聚合酶链反应(qRT-PCR)检测。以U6位内参基因,采用2-ΔΔCt法计算miR-137、miR-155相对表达量。(6)生活质量评分(the research and treatment of cancer quality of life questionnairein esophageal cancer,EORTC QLQ-OES18):EORTC QLQ-OES18总分为72分,分值越高表明生活质量越差[9]。(7)不良反应:统计治疗期间不良反应发生情况,包括肝、肾功能异常、心肺损伤、胃肠道反应、白细胞减少、血红蛋白减少。
1.5 统计学方法
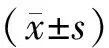
2 结果
2.1 临床疗效
单一组完全缓释2例、部分缓释23例、疾病进展30例、疾病稳定43例;联合组完全缓释5例、部分缓释48例、疾病进展42例、疾病稳定12例。联合组客观缓释率[49.53%(53/107)]高于单一组[25.51%(25/98)](χ2=12.523,P<0.001)。
2.2 肿瘤标志物
治疗前两组肿瘤标志物水平差异无统计学意义(P>0.05);治疗后两组血清CEA、CYFRA21-1、SCCA水平降低,且联合组低于单一组(P<0.05)。见表1。

表1 两组肿瘤标志物比较
2.3 免疫功能
治疗前两组免疫功能差异无统计学意义(P>0.05);治疗后两组CD3+、CD4+、NK细胞水平高于治疗前,且联合组高于单一组(P<0.05)。见表2。

表2 两组免疫功能比较
2.4 血管生长因子
治疗前两组血管生长因子差异无统计学意义(P>0.05);治疗后两组血清VEGF、EGFR、TGF-β1水平低于治疗前,且联合组低于单一组(P<0.05)。见表3。

表3 两组血管生长因子比较
2.5 miR-137、miR-155表达量及EORTC QLQ-OES18评分
治疗前两组miR-137、miR-155表达量及EORTC QLQ-OES18评分差异无统计学意义(P>0.05);治疗后两组miR-137、miR-155表达量及EORTC QLQ-OES18评分降低,且联合组低于单一组(P<0.05)。见表4。

表4 两组miR-137、miR-155表达量及EORTC QLQ-OES18评分比较
2.6 不良反应
联合组不良反应发生率与单一组差异无统计学意义(P>0.05)。见表5。

表5 两组不良反应比较[n(%)]
3 讨论
ESCC发生发展与炎症反应、亚硝胺长期刺激、遗传因素有关,常规放疗时肿瘤病灶靶区照射剂量不足,影响整体治疗效果[10]。DC可激活免疫活性细胞。CIK可精准识别、杀伤肿瘤细胞,提升机体免疫功能,DC-CIK治疗可减轻机体炎症反应,抑制肿瘤细胞侵袭、转移,增强机体抗肿瘤能力[11]。调强放疗是一种新型放疗技术,可依据肿瘤病灶形状设置高剂量照射区域,保证肿瘤病灶获得充足照射剂量,杀灭微小病灶、转移灶,并可提高患者放疗耐受性[12-13]。
本研究结果显示,联合组客观缓释率高于单一组,提示联合治疗可提高整体治疗效果。血清肿瘤标志物可纵向评价肿瘤个体病情变化,CEA、CYFRA21-1、SCCA是ESCC常见肿瘤标志物,可作为判断ESCC转移的重要指标[14]。本研究结果显示,治疗后联合组血清CEA、CYFRA21-1、SCCA水平低于单一组。其原因可能为调强放疗联合DC-CIK治疗ESCC可发挥协同作用,并可能减轻机体炎症反应,调节肿瘤标志物水平,诱导肿瘤细胞凋亡。
VEGF、EGFR、TGF-β1属于肿瘤血管生长因子,可改变肿瘤微环境,诱导内皮细胞增殖、迁移,促进ESCC细胞增殖、黏附、转移[15]。本研究结果显示,治疗后联合组血清VEGF、EGFR、TGF-β1水平低于单一组,提示联合治疗可调节肿瘤血管生长因子水平。由此可见联合治疗具有抗肿瘤血管生成作用,并可通过调节肿瘤组织中血管系统,抑制肿瘤生长。CD3+、CD4+、NK细胞可反映机体免疫功能,CD3+、CD4+可增强效应细胞抗肿瘤效果,其水平升高表明免疫功能增强,NK细胞可反映机体杀伤肿瘤效果,其水平升高表明杀伤力更强[16]。本研究结果显示,治疗后联合组CD3+、CD4+、NK细胞高于单一组,提示联合治疗可改善机体免疫力。其原因为DC-CIK对肿瘤细胞有直接杀伤作用,未破坏机体免疫系统,可增强机体免疫功能,调强放疗可杀伤肿瘤细胞,促进T细胞增殖活化,激活机体免疫系统。miRNA在ESCC发生发展过程中发挥基因调控作用,miR-137、miR-155表达水平升高可引起机体炎症反应,促进肿瘤生长、迁移及侵袭[17]。本研究结果显示,治疗后联合组miR-137、miR-155表达量低于单一组,提示联合治疗可能通过抑制miR-137、miR-155表达而抑制ESCC进展。同时本研究发现治疗后联合组EORTC QLQ-OES18评分低于单一组,其不良反应发生率与单一组比较无明显差异,提示联合治疗可改善ESCC患者生活质量,且未增加不良反应。
4 结论
调强放疗联合DC-CIK治疗ESCC效果确切,可降低血清肿瘤标志物水平,改善免疫功能、生活质量,抑制肿瘤血管生成,且具有一定安全性,其作用机制可能与抑制miR-137、miR-155表达有关。

