海曲泊帕治疗恶性肿瘤化疗相关血小板减少的效果和安全性
庞丽娜,龚帅,张胜利,张晓珂,王利叶,何炜
(郑州大学第一附属医院 肿瘤科,河南 郑州 450052)
恶性肿瘤化疗后血小板减少(chemotherapy induced thrombocytopenia,CIT)是细胞毒药物对骨髓中的巨核细胞产生作用,抑制其分化成熟,导致外周血中血小板计数(platelet count,PLT)低于正常范围。CIT是化疗后常见的毒副反应,可导致患者血小板输注率升高,住院时间延长,化疗剂量强度降低,影响治疗效果,出血风险增加,生活质量降低,严重者可能中断抗肿瘤治疗甚至死亡[1]。
目前临床治疗CIT仍以输注血液制品或皮下注射升血小板针剂为主[1]。随着血小板受体激动剂(thrombopoietin receptor agonist,TPO-RA)的问世,治疗CIT又多了一种便捷的方法。常见的TPO-RA类药物有罗米司亭、艾曲波帕、阿伐曲波帕、海曲泊帕等[2-3]。目前临床常用的TPO-RA均为第二代,以海曲泊帕为代表,作为人工合成的口服非肽类的小分子化合物,它与内源性TPO不具有同源性,不会诱导交叉反应产生自身血小板抗体[4-6]。尽管目前海曲泊帕的适应证仍局限于成人慢性免疫性血小板减少症(immune thrombocytopenia,ITP)和再生障碍性贫血,但随着对该药物更加深入的认识,目前也越来越多地应用于CIT。本研究旨在探索海曲泊帕治疗CIT的效果。
1 对象与方法
1.1 研究对象
回顾性收集2020年7月至2021年12月郑州大学第一附属医院收治的100例恶性肿瘤化疗合并CIT≥2级的患者的资料[CIT 1级(PLT≥75×109L-1)的患者可临床严密观察暂不特殊处理]。本研究方案经郑州大学第一附属医院医学伦理委员会审批。
1.2 纳入及排除标准
(1)纳入标准:恶性肿瘤经组织病理学证实;年龄≥18岁;受试者在前1周期正规化疗中PLT<75×109L-1;美国东部肿瘤合作组(eastern cooperative oncology group,ECOG)评分≤2分;未接受抗血小板治疗,或原有血小板治疗疗效欠佳或不耐受,接受海曲泊帕治疗。(2)排除标准:合并难以控制的活动性感染、骨髓侵犯、具有临床意义的凝血功能异常等。
1.3 用药方案
治疗CIT期间暂停抗肿瘤药物治疗。部分序贯治疗的患者使用的其他升血小板治疗药物也暂停(未纳入联合治疗患者),部分患者病情稳定患者可居家口服海曲泊帕,定期来院复查血常规。口服海曲泊帕乙醇胺片(江苏恒瑞医药股份有限公司,国药准字H20210021),每次5 mg,每日1次,睡前顿服。
1.4 观察指标
1.4.1一般资料
记录患者的一般资料,包括年龄、性别、患者ECOG(评分0/1分时说明体力状态好,对治疗耐受性好,治疗有效率高)。
1.4.2疗效
记录治疗后PLT水平。(1)主要疗效观察指标为PLT回升至≥100×109L-1占比、PLT较基线翻倍占比和PLT回升≥20×109L-1占比。(2)其他观察指标包括PLT<75×109L-1的持续时间,因PLT下降而减低下周期化疗强度的发生率(减低化疗剂量或推迟化疗)、血小板输注率、CIT相关出血发生率和药物相关不良反应发生率等。疗效评价标准参考我国《血液病诊断及疗效标准》[7]及参考文献[8],将药物治疗CIT的总有效率定义为:PLT回升至≥100×109L-1或PLT较治疗前上升≥20×109L-1或PLT较基线上升≥100%的患者占全部患者的百分比。为防止个别患者输注血小板引起的海曲泊帕有效率虚假提高,考虑到血小板正常代谢周期为3 d左右,收集相关数据均为输注血小板3 d以后的复查数据,此时输注的血小板已基本代谢完毕。
1.4.3不良反应
观察患者服药后是否有头痛、视物模糊、心悸、便秘或其他不适等症状;是否出现皮下出血点、瘀斑,眼底出血、鼻衄或其他的体征;记录患者用药前后的血常规和肝、肾功能、血脂的变化情况,主要包括白细胞、血红蛋白、血小板、谷丙转氨酶、谷草转氨酶、丙氨酸氨基转移酶、碱性磷酸酶、乳酸脱氢酶、肌酸激酶、胆红素和甘油三酯的数值;以及记录用药前后QT间期是否延长等心电图变化。
1.5 统计学方法
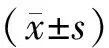
2 结果
2.1 不同特征患者疗效
海曲泊帕治疗(16±3)d后,不同性别、年龄、ECOG评分、肿瘤类型、CIT分级及有无序贯治疗的CIT患者总有效率比较,差异无统计学意义(P>0.05),见表1。

表1 不同特征CIT患者海曲泊帕治疗效果比较[n(%)]
2.2 起效时间及有效率
100例患者服用海曲泊帕后的平均起效时间为(6.6±3.4)d。PLT≤75×109L-1持续时间(8.5±4.7)d。因PLT下降而降低下周期化疗强度(降低化疗剂量或推迟化疗)的发生率为14.0%(14/100),这其中92.9%(13/14)为Ⅳ度骨髓抑制患者,1例CIT Ⅲ级患者因升血小板时间过长导致化疗周期延迟。随着时间的延长,PLT回升至≥100×109L-1占比、PLT较治疗前翻倍占比、PLT回升≥20×109L-1占比及总有效率均逐渐升高,差异有统计学意义(P<0.001)。见表2。

表2 海曲泊帕治疗期间各时段升血小板有效率/%
2.3 不良反应
2例(2.0%)患者服药后出现不良反应,均为轻度可逆性肝损伤,未发现其他相关不良反应。PLT(16±3)d升高至超过350×109L-1的患者有2例(2.0%),暂停使用海曲泊帕治疗,同时给予阿司匹林等药物预防血栓形成,1周后患者PLT恢复至正常范围。未发现血栓相关事件及CIT相关出血事件。
2.4 血小板输注次数及输注量
100例患者CIT期间血小板输注共4人次,其中1名治疗前血小板计数为2×109L-1的患者输注血小板2次,每次1个治疗量(1个治疗量的血小板容量为240~260 mL,血小板含量≥2.5×1011);其余2例Ⅳ度骨髓抑制且治疗前血小板计数在10×109L-1以下的患者输注血小板各1个治疗量。未见明显输血反应。
3 讨论
目前治疗CIT的药物为重组人白介素11和重组人血小板生成素[1]。重组人白介素11因水钠潴留增加心脏负担;重组人血小板生成素可能产生抗TPO抗体,中和内源性TPO活性,故NCCN指南并未将上述两种药物作为治疗CIT的推荐。CIT在恶性肿瘤化疗过程中常见,周期较长,是降低患者化疗剂量强度或密度的重要原因之一,也是目前临床难点之一,寻找更加安全有效的药物治疗CIT是目前需亟待解决的问题之一。
TPO-RA治疗ITP效果良好[9],但目前关于CIT方面的研究相对较少,尚缺乏大型Ⅲ期临床随机对照研究,真实世界的回顾性研究更少。本文回顾分析了海曲泊帕治疗100例恶性肿瘤CIT的效果及安全性,发现海曲泊帕治疗CIT的有效率不受年龄、ECOG评分、性别、CIT分级、病理类型或有无序贯治疗的影响,亚组分析显示差异均无统计学意义,这与李红梅等[10]的研究相似。这可能是因为海曲泊帕在跨膜区与TPO受体结合,并没有竞争性结合内源性TPO,而是与内源性TPO效应累加的结果[11]。
一项关于阿伐曲波帕治疗实体瘤CIT的大型Ⅲ期临床研究结果显示,阿伐曲波帕组和安慰剂组差异无统计学意义,可能与化疗剂量降低或化疗周期延迟占比较低有关,但阿伐曲泊帕治疗实体瘤CIT总体安全性良好[12]。Winer等[13]的研究显示,采用艾曲泊帕或安慰剂治疗以吉西他滨为基础的化疗药物引起的血小板减少发生率降低,总体安全性良好,但艾曲泊帕日剂量超过100 mg时多次发生血小板增多事件。有研究观察了4例经艾曲波帕治疗的CIT患者,发现4例PLT均恢复正常范围,恢复时间较长,中位恢复时间为18.5 d[14]。另有研究观察了6例使用艾曲波帕治疗CIT的患者,中位治疗时间长达116 d,但无患者输注血小板,几乎没有CIT达Ⅳ级,安全性良好,没有严重毒副反应,只有2例患者有轻度乏力[15]。本研究海曲泊帕的平均起效时间为(6.6±3.4) d,PLT≤75×109L-1持续时间平均为(8.5±4.7)d,海曲泊帕治疗(5±2)d的总有效率为66.0%,(10±3)d的总有效率为86.0%,(16±3)d的总有效率为95.0%。可见海曲泊帕升血小板快、有效率高且安全性好,但仍需要更加深入的研究数据支持上述结果。
海曲泊帕是我国自主研发的新型TPO-RA类药物,药代动力学研究显示海曲泊帕能够通过激活STAT、PI3K和ERK信号通路,特异性地刺激表达人TPOR细胞的增殖和/或分化,且具有更低的EC50值。海曲泊帕还可以有效上调p-RB、Cyclin D1和CDK4/6等G1期相关蛋白,使得细胞周期正常化,并通过调控BCL-XL/BAK的表达抑制细胞凋亡。此外,海曲泊帕和TPO在刺激TPO依赖的信号转导、增加细胞活性,以及抑制凋亡等方面都有协同的作用,动物实验研究发现海曲泊帕可特异性地促进裸鼠32D-MPL细胞的活力和生长,其效果远高于艾曲波帕[16],这也给本研究序贯海曲泊帕疗效好于单药提供了理论依据。
4 结论
海曲泊帕治疗恶性肿瘤化疗引起血小板减少疗效确切且不良反应发生率低,安全性好,可为治疗CIT提供新选择。

