ACBK光度法测定镍*
杨 卓,朱薛轲,杨红兵
(洛阳师范学院化学化工学院,河南 洛阳 471934)
镍是人体必需的一种微量元素,它在生物大分子的结构稳定性上、酶的合成及新陈代谢过程中起着重要作用。正常情况下,成人体内镍含量约为10 mg,血液中镍的正常浓度为0.11 μg·mL-1。但当人体中镍的含量过少或过多时,均会引起严重的病变。比如,缺乏镍会引起糖尿病、肝硬化、尿毒症、肝脂质和磷脂质代谢异常等病症;镍摄入过多会引起过敏性皮炎,大多留存于体内脊髓、脑及五脏中,影响人的身体健康。同时镍过量对水生生物也有明显的毒害作用,在繁殖、发育、生长、生理机能等方面造成影响。此外,镍具有良好的防锈,耐腐,耐高温的性能,在钢铁、镍基合金、电镀工业、军工制造业等领域都有广泛的应用,但也会造成镍污染,如冶炼镍矿石时部分矿粉随气流进入大气,含镍工业废水的排放等。因此环境中镍的测定具有重要的意义。
目前建立的测定微量镍的方法较多,有滴定法[1]、原子吸收光谱法[2-7]、原子发射光谱法[8-10]、荧光光谱法[11-13]以及分光光度法[14-21]。滴定法不适用于微量及痕量元素的分析;原子吸收光谱法、原子发射光谱法仪器价格昂贵,操作繁琐;荧光光谱法灵敏度高、检出限较低,但选择性差且存在荧光淬灭效应、散射光干扰等问题;分光光度法操作简单、分析速度快、仪器廉价,但目前建立的分光光度法多数灵敏度较低,因此寻找灵敏度更高、适用范围更广的方法测定环境中镍的含量是一件非常有价值的工作。研究发现:在pH 10.38 BR缓冲介质中,硫酸镍和ACBK共存的条件下,体系在516 nm、600 nm处的ΔA值与硫酸镍的浓度均具有良好的线性关系,其中600 nm处的线性关系最好,其相关系数r为0.997 4,ΔA=0.119 1-0.129 7c,用于环境水样中Ni2+含量的测定,回收率为99.5%~106.4%,RSD为1.0%~1.2%,结果可靠,建立了一种测定环境水样中Ni2+含量的光度法。
1 实 验
1.1 主要仪器及试剂
UV 2600型紫外可见分光光度计,日本岛津;ZNCL-BS140智能磁力搅拌器,郑州。1.0×10-3mol·L-1酸性铬兰K溶液,500 μg·mL-1硫酸镍母液,1.0 mol·L-1氯化钠溶液,2.0×10-4mol·L-1氯代十六烷基吡啶(Hexadecylpyridinium chloride,CPC),2.0×10-4mol·L-1十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS),丙酮,乙醇,不同pH的BR缓冲溶液,732阳离子交换树脂。实验用水为蒸馏水,所用试剂为分析纯。
1.2 实验方法
准确移取适量硫酸镍溶液、1 mL BR缓冲溶液及1.5 mL 1.0×10-3mol·L-1ACBK溶液于10 mL比色管中,蒸馏水定容,摇匀,在25 ℃下,静置20 min后于UV 2600紫外可见分光光度计上分别以蒸馏水和试剂空白为参比溶液扫描其吸收光谱图,并在测量波长处,分别测定体系的吸光度A及空白溶液的吸光度A0,ΔA=A-A0。
2 结果与讨论
2.1 吸收光谱
图1和图2是ACBK-Ni2+体系的UV-Vis吸收光谱图。在pH=10.38的BR缓冲溶液中,ACBK水溶液为浅蓝色,在545 nm处有一个吸收峰。硫酸镍溶液无色且在可见区无吸收。当两者共存时,溶液变为紫色,并在516 nm、548~554 nm附近各产生一个新的吸收峰,说明两者发生反应生成了新的化合物。随着Ni2+浓度的增大,ACBK-Ni2+体系在516 nm处吸收逐渐增强;554 nm处的吸收增强并左移至548 nm处;600 nm处的吸收明显减弱,出现褪色现象。由图2可以看出:在516 nm、600 nm吸收峰处ACBK-Ni2+体系的ΔA与硫酸镍的浓度均具有良好的线性关系。因600 nm处具有更好的线性关系,因此,选择600 nm作为本实验的测量波长。
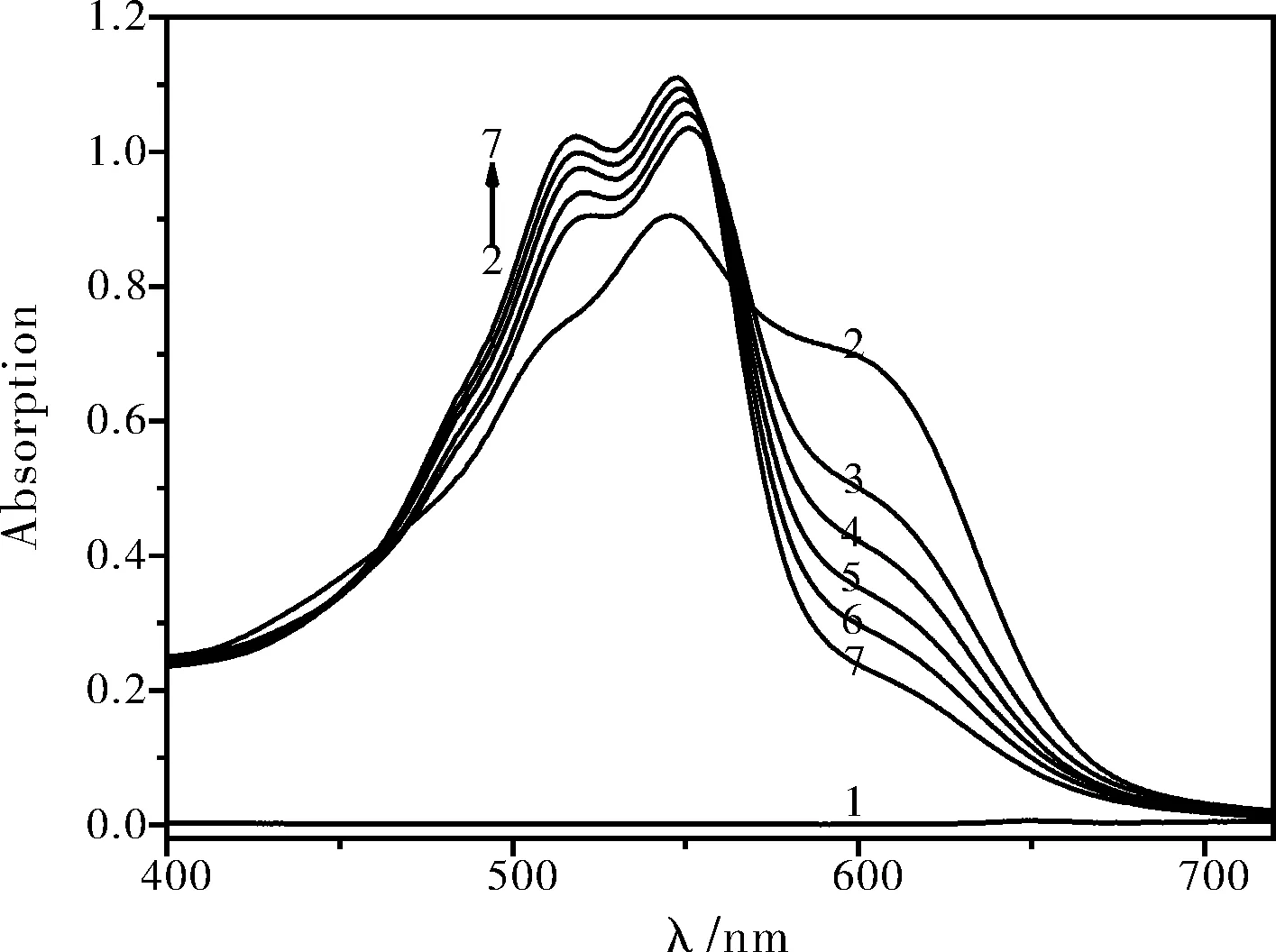
1,Ni2+;2,ACBK;3~7,ACBK + Ni2+[Ni2+]:1,2 μg·mL-1;3,2.5 μg·mL-1;4,3.0 μg·mL-1;5,3.5 μg·mL-1;6,4.0 μg·mL-1;7,4.5 μg·mL-1[ACBK]=5.0×10-5 mol·L-1,pH=10.38图1 UV-Vis 吸收光谱图(以溶剂空白为参比溶液)Fig.1 UV-Vis absorption spectra(measured against the solvent blank)
2.2 酸度的影响
在BR缓冲介质中探讨了酸度对体系吸收情况的影响,结果表明:当pH<5.0时,ACBK溶液为红色,吸光度较小且随着pH值的变化而不变,加入Ni2+后,体系的颜色不变、吸光度不变。当pH 5.0~9.0时,ACBK溶液由红色经过紫色逐渐变为蓝色,吸光度随pH值的增大而迅速增大;加入Ni2+后,体系的颜色逐渐由红色变为紫色,吸光度逐渐增大,但低于相同pH值下ACBK自身的吸收,且pH值越大ACBK-Ni2+体系的吸光度越低于ACBK的吸光度。说明:ACBK的酸型体是红色,碱型体是蓝色,碱型体的吸收远高于酸型体,且Ni2+仅与ACBK的碱型体反应,使ACBK自身的吸收在600 nm处明显降低。当pH>9.0时,ACBK溶液颜色不变,体系吸收稍降,说明ACBK在碱性较强的溶液中稳定性略微降低;ACBK-Ni2+体系溶液颜色不变,吸收基本不变,说明该体系在碱性条件下较为稳定。综上,体系最适宜的缓冲溶液酸度变化范围是pH 9.5~10.5。因此,选择1 mL pH 10.38的BR缓冲溶液来维持体系酸度。
2.3 ACBK用量的影响
探讨了ACBK用量对体系吸收情况的影响,发现:随着ACBK用量的增加,ACBK溶液由浅蓝加深至蓝色,ACBK-Ni2+体系溶液由浅粉色渐变为紫色。两个体系的吸收都逐渐增强,使以试剂空白为参比溶液的体系的吸收逐渐减弱且在ACBK用量为3.0 mL 5.0×10-4mol·L-1之后逐渐趋于稳定。因此,本实验选择的ACBK用量为3.0 mL 5.0×10-4mol·L-1。
2.4 离子强度的影响
用0.1 mol·L-1的NaCl溶液研究离子强度对体系吸收情况的影响,结果表明:随着离子强度的增大,ACBK及ACBK-Ni2+体系的吸收基本不变,说明离子强度的变化对体系吸收情况影响不大。因此在测定过程中可以忽略离子强度的影响。
2.5 有机溶剂的影响
分别探讨了乙醇、丙酮有机溶剂对体系吸收情况的影响,结果表明:当乙醇或丙酮的含量小于2.5%时,ACBK、ACBK-Ni2+体系的吸收均略有波动;当乙醇或丙酮含量大于2.5%后,各体系的吸收均为稳定。因此,在样品测定过程中,需要注意乙醇、丙酮用量对体系的影响,可选择含量为2.5%~20%。
2.6 表面活性剂的影响
探讨了表面活性剂CPC、SDBS对体系的影响,结果表明:随着CPC用量的逐渐增加,ACBK的吸收先略减小后基本稳定,ACBK-Ni2+体系的吸收先略减小后略增大。随着SDBS用量的增加,ACBK的吸收先略增大后基本稳定,ACBK-Ni2+体系的吸收先略增大后基本稳定。因此,适宜的CPC、SDBS用量范围分别为(1~2)mL 2.0×10-4mol·L-1、(1~3)mL 2.0×10-4mol·L-1。
2.7 体系的稳定性
研究了体系的反应温度和稳定时间,结果表明:随时间的增加,ACBK自身的吸收在19 ℃时逐渐降低、25 ℃和30 ℃时略微降低、35 ℃时降低较多;ACBK-Ni2+体系在19 ℃时反应缓慢,直至40 min后才趋于稳定,在25 ℃、30 ℃、35 ℃时反应比19 ℃时快速,约20 min后趋于稳定。基于此,本实验在25 ℃下反应20 min后再进行研究测定。
2.8 方法的灵敏度
在最适宜的实验条件下,分别在516 nm、549 nm、600 nm处测量ΔA值,绘制工作曲线,结果如表1所示,600 nm处线性关系最好,与已经报道的光度法[22-24]相比,灵敏度更高,摩尔吸收系数高达3.41×104L·mol-1·cm-1。
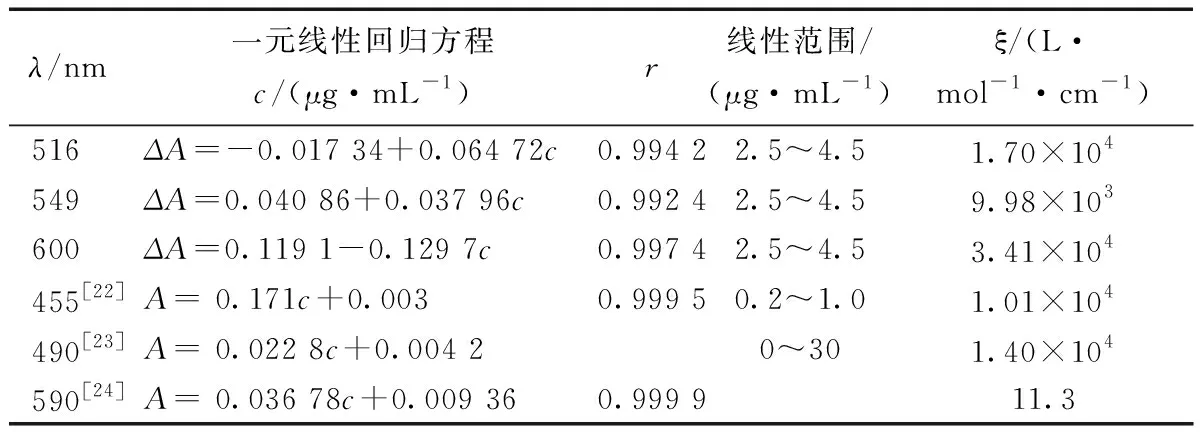
表1 相关参数Table 1 The calibration graphs and the relevant parameters
2.9 方法的选择性
考察了一些常见离子对体系的影响,结果如表2所示。大部分常见离子具有较大的允许倍量,干扰较小,而Ca2+、Mg2+、Mn2+等允许倍量较小,在实际样品的测定中要注意对这些离子进行掩蔽或分离。
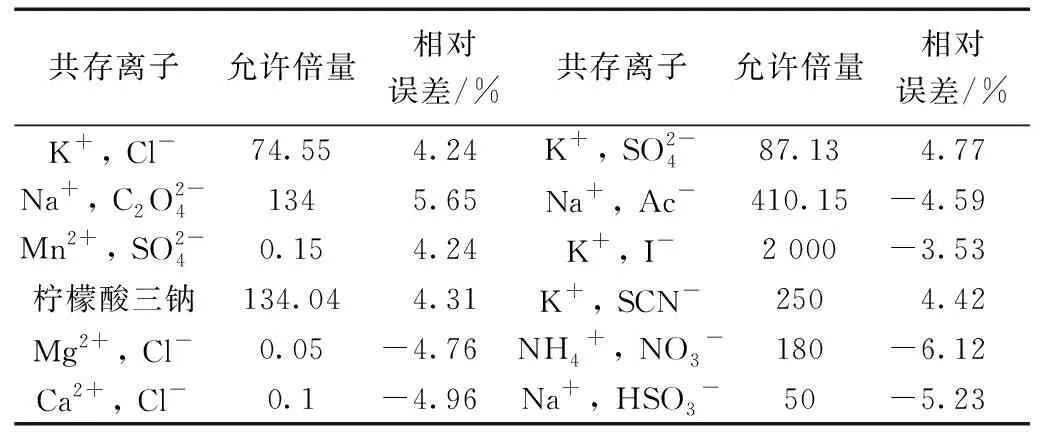
表2 共存物质的影响(Ni(II)=2 μg·mL-1)Table 2 Effects of coexisting substances (Ni(II)=2 μg·mL-1)
3 分析应用
取自来水500.00 mL于烧杯中加热煮沸10 min,冷却至室温,过滤,再经过除钙镁离子交换树脂后移至500 mL的容量瓶中,用蒸馏水定容,测得Ni2+含量为4.172 mg·L-1。移取5.00 mL水样、1.00 mL pH 10.38 BR缓冲溶液和浓度不等的Ni2+标准液于10 mL的比色管中,按2.2实验方法测定ΔA,计算得到自来水中Ni2+的含量分别为4.704 mg·L-1和5.167 mg·L-1,回收率为99.5%~106.4%,RSD为1.0%~1.2%,说明方法准确可靠(表3)。
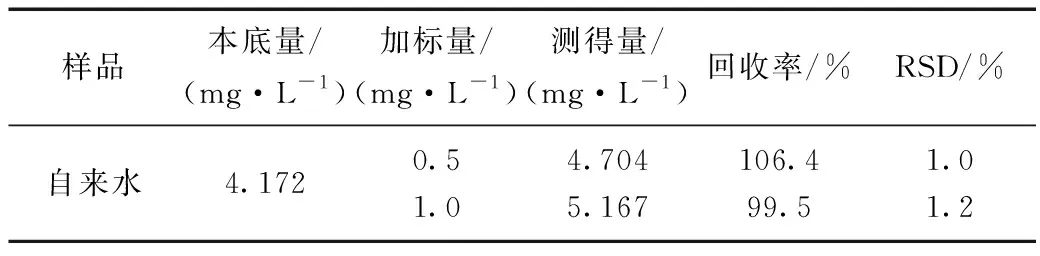
表3 水样中Ni2+含量的检测结果(n=6)Table 3 Results ofthe concent of Ni2+ in water sample (n=6)
4 结 论
在pH 9.5~10.5 BR缓冲介质中,硫酸镍与ACBK的碱型体反应生成新的化合物,探讨了酸度、ACBK用量、离子强度、有机溶剂、表面活性剂、稳定性等的影响,在最佳反应条件,体系在516 nm、600 nm处的ΔA值与硫酸镍的浓度均具有良好的线性关系,其中600 nm处的线性关系最好,其相关系数r为0.997 4,一元线性回归方程为ΔA=0.119 1-0.129 7c(c:μg·mL-1),用于环境水样中Ni2+含量的测定,回收率为99.5%~106.4%,RSD为1.0%~1.2%,结果准确可靠,据此建立了一种测定环境水样中Ni2+含量的分析方法。

