海洋放线菌次生代谢产物化学成分研究*
朱梦月
(南京医科大学康达学院药学部,江苏 连云港 222000)
新药研发是医药创新发展的核心驱动力,事关我国重要民生问题和发展需求,是人类社会健康可持续发展的重要保证。我国是医药大国,然而并非医药强国,我国原创新药发展相对缓慢,其中一个关键性因素是具有自主知识产权的先导药源分子有限。微生物作为地球上最丰富的物种资源,在生命活动过程中代谢产生的活性物质在医疗方面发挥着举足轻重的作用。微生物活性天然产物是先导药源分子的重要来源[1-2],探究其次级代谢产物,生物合成途径,有助于挖掘及重构生物合成途径以获得更多新型微生物活性天然产物[3],从而扩充药物先导化合物库,助力我国医药创新发展。
研究表明,海洋生态系统中蕴藏着丰富的微生物资源[4],在高盐、高压、低氧、低温的特殊的生境条件筛选下,海洋微生物更易进化出特殊的代谢途径,从而产生更多独特的次级代谢产物以应对环境压力。海洋放线菌中可以产生许多结构新颖、活性独特的新化合物,有蒽醌类化合物、肽类、脂类[5-6]等,许多最初被认为是由海洋生物产生的化合物已被发现是由与宿主相关的放线菌产生[7]。随着基因组测序技术和生物信息学的不断发展,越来越多的微生物基因组信息得到解析,科学家发现海洋微生物中蕴含着大量负责天然产物(次级代谢产物)生物合成的基因簇,且该数量远远大于目前鉴定的化合物结构类型数量[8-13],研究表明在标准实验室条件下,微生物中的生物合成基因簇大多处于沉默状态,意味着海洋放线菌中仍有大量新型活性天然产物亟待发掘,具有巨大的开发潜力,因此,这些海洋放线菌受到了国内外的广泛关注。
海洋放线菌次级代谢产物种类丰富,其中芳香族聚酮类化合物是由II型聚酮合成酶(PKSs)形成的天然产物,是一种生物活性强、结构多样化的细菌次生代谢物。在数代人的不懈努力下,许多II型聚酮类化合物及其半合成衍生物已作为高效药物应用于临床,如四环素类抗生素及抗肿瘤药物光神霉素和阿霉素等[14-15]。
基于海洋微生物的巨大资源优势,本文重点研究海洋来源的微生物,根据一批海洋微生物的次级代谢产物紫外图谱,推测出一株海洋放线菌的次级代谢结构上属于聚酮类化合物,聚酮类化合物其结构多样、生物活性显著,有望从中分离出活性较好的药物先导化合物。于是着重研究这一株菌,通过测序确定海洋放线菌是链霉菌属Streptomyces rishiriensis。从其次级代谢产物中分离出2个已知化合物(1、2)rishirilide A、rishirilide B(图1),结构上都属于II型聚酮类化合物。后期如分离到新化合物对生物合成后修饰研究有很重要作用,有助于发现新型酶催化机理,进而挖掘出更多新颖的II型聚酮类化合物,从而扩充新型药物先导化合物库,加速推进新型药物的研发。
1 材料与方法
1.1 仪器与材料、试剂及培养基
1.1.1 材料
90 mm培养皿、剪刀、镊子、研钵、培养皿、1 L锥形瓶、青霉素小瓶、EP管、酒精灯、涂布环、接种环、200 μL和1 mL枪头、200 μL和1 mL移液枪、层析柱、树脂、分液漏斗、旋蒸瓶、TLC硅胶板(5 cm×20 cm),烟台江友硅胶开发有限公司;柱色谱硅胶(200~300目),青岛海洋化工、反相柱色谱(ODS填料),日本YMC有限公司;凝胶柱色谱填料(Sephadex LH-20),Pharmacia Biotech公司。
1.1.2 仪器
半制备色谱柱MPLC(Agilent Eclipse XDB-C18,5 μm,250 mm×9.4 mm)分离粗膏、高效液相色谱仪HPLC(Agilient 1260 Infinity XDB-C18column,5 μm,250 mm×9.4 mm)制备纯品化合物、核磁共振仪(Bruker Avance III 400/600)测定化合物核磁共振数据(TMS为内标)、紫外测定仪(Nanodrop2000)测定紫外数据、傅里叶变换红外光谱仪(Nexus 870 FT-IR)、紫外分光光度计(detector L-7400 UV)测紫外数据、电子天平用于测量重量、高压蒸汽灭菌锅用于高温灭菌、生物安全柜、恒温培养箱、恒温摇床、超净工作台、-80 ℃超低温冰箱、超纯水仪、高速离心机、旋转蒸发仪EYELAN-1000、冷凝循环装置CA-1111等。
1.1.3 试剂
甲醇、乙腈等色谱级别溶剂,海市百灵威;乙腈等分析纯,广州金华大化学试剂公司;石油醚、乙酸乙酯、正丁醇、氘代DMSO,上海市恩拿马生物科技有限公司;二氯甲烷、缬氨酸、亮氨酸、D-FDAA等,西格玛奥德里奇有限公司。
1.1.4 培养基
分菌用马铃薯葡萄糖琼脂(PDA):将200 g左右马铃薯去皮,切成小块,加入1 L以下水,煮沸0.5 h后,用两层医用纱布过滤得滤液,加水定容至1 L,再称取2 g蔗糖和10%琼脂,混匀溶解后分装于锥形瓶中,115 ℃灭菌30 min,冷却至60 ℃,加卡那霉素和氨苄青霉素各150 mg,摇匀后倒入培养皿,冷却凝固后备用。
高氏培养基(GS):0.5 g三水合磷酸氢二钾、1 g硝酸钾、0.5 g七水合硫酸镁、0.5 g氯化钠、0.01 g七水合硫酸亚铁、10 g琼脂粉、20 g可溶性淀粉、加入1 L水,调节pH至7.4~7.6。
麦芽培养基(Malt):麦芽20 g加水煮沸0.5 h,用两层医用纱布过滤得滤液,加20 g蔗糖,1 g蛋白胨,加水定容至1 L。
纤维素脯氨酸琼脂培养基(CPA):1.0 g脯氨酸,2.5 g羧甲基纤维素钠,2.0 g丙酮酸钠,0.2 g七水合硫酸镁,0.25 g硝酸钾,0.2 g磷酸氢二钾,0.5 g氯化钙,10 mg七水合硫酸亚铁,20 g琼脂粉,1 L水溶解(纤维素钠提前用热水溶解,需要不断搅拌,培养基中还需要加入重铬酸钾,保证其终浓度在50 μg/mL)。
ISP4培养基:1.365 g磷酸氢二钾,2 g氯化铵,1 g氯化钠,2 g七水合硫酸镁,0.1 mL微量元素,2 g碳酸钙,20 g琼脂粉,10 g可溶性淀粉,1 L水溶解。
38#培养基:4.0 g酵母浸出物,5.0 g麦芽浸出物,1 mL复合维生素,4.0 g葡萄糖,20 g琼脂粉,用1 L水溶解。
TSB培养基:1 L水溶解30 mg TSB。
F培养基:20.0 g蔗糖,0.1 g酪蛋白水解物,10.0 g葡萄糖,0.25 g硫酸钾,5.0 g酵母浸出物,1.0 g六水合氯化镁,5 g MOPs,0.1 mL微量元素,1 L水溶解。
A培养基:1 g碳酸钙,4 g酵母浸出物,0.1 g溴化钾,2.0 g蛋白胨,0.04 g硫酸铁,10.0 g可溶性淀粉,1 L水溶解。
Y培养基:4.0 g葡萄糖,4.0 g酵母浸出物,10.0 g麦芽浸出物,1 L水溶解。
1.2 实验方法
1.2.1 菌种分离方法及菌种鉴定
分离方法:将南海海泥风干后称取5 g,用灭菌水37 ℃恒温悬浮2 h,将悬浮海泥的无菌水稀释成三个浓度梯度10-1、10-2、10-3,分别涂布在CPA、GS、PDA、纯琼脂培养基上,恒温37 ℃培养到长出单菌落,再用Malt、ISP4、38#培养基纯化,发现该菌株只在Malt培养基上生长,呈现零散的单孢形状。
菌种鉴定:将菌种孢子粉末沾取少量至EP管中,加入裂解液、Tris-HCl缓冲液(pH=8.0)、EDTA、NaCl和二烷基硫酸钠,置于涡旋混合仪混合,放入60 ℃水浴锅中孵育20 min,上下颠倒充分混匀。之后向混悬液中加入醋酸钾溶液,混匀后,离心10 min,吸取500 μL上清至新EP管中,再加入同体积异丙醇,EP管上下颠倒至出现白色絮状沉淀,离心5 min,撇去上清液,再在EP管中加70%乙醇,混匀后离心3 min,再撇去上清,循环操作两次将带有基因组的EP管打开于室温下晾10 min后加65 ℃热水,基因组溶解后用NanoDrop2000测浓度,并将提取的基因组片段送至擎科生物公司测序鉴定菌种。通过形态学和18S rRNA序列对比,菌株鉴定结果表明属于该海洋放线菌NA07600是Streptomyces rishiriensis。
1.2.2 菌种的发酵及提取分离方法
将海洋放线菌NA07600(Streptomyces rishiriensis)纯化到ISP4平板培养基上培养7天,长出孢子后,配制1 L TSB培养液平均分装到6个锥形瓶中,将长满孢子的ISP4培养基挑块接种至锥形瓶中,140 rpm/min、恒温28 ℃,培养至瓶中长出密集菌粒,即可作为种子液。配制Y培养基15L,每瓶封装250 mL于体积1 L的锥形瓶中,115 ℃灭菌30 min,待冷却后,接种培养液量的5%即12.5 mL种子液,30 ℃恒温、220 rpm摇床发酵8.5天,用两层纱布过滤,纱布上可得菌体,下方滤液是菌液。用乙酸乙酯萃取菌液3次,合并萃取液后旋蒸浓缩后得5.6 g粗膏。
5.6 g粗膏先用中压制备色谱MPLC分离,流动相为甲醇和水,梯度洗脱后,将洗脱液进行TLC分析,将类似组分合并后,分为7组即Fr1~Fr7。对Fr2和Fr4进一步纯化,Fr2段用正相硅胶柱初步分离后,再用凝胶柱层析和HPLC纯化,Fr4段用凝胶柱层析初步分离,再利用HPLC纯化,最终分到化合物1和2。具体分离流程如图2所示。
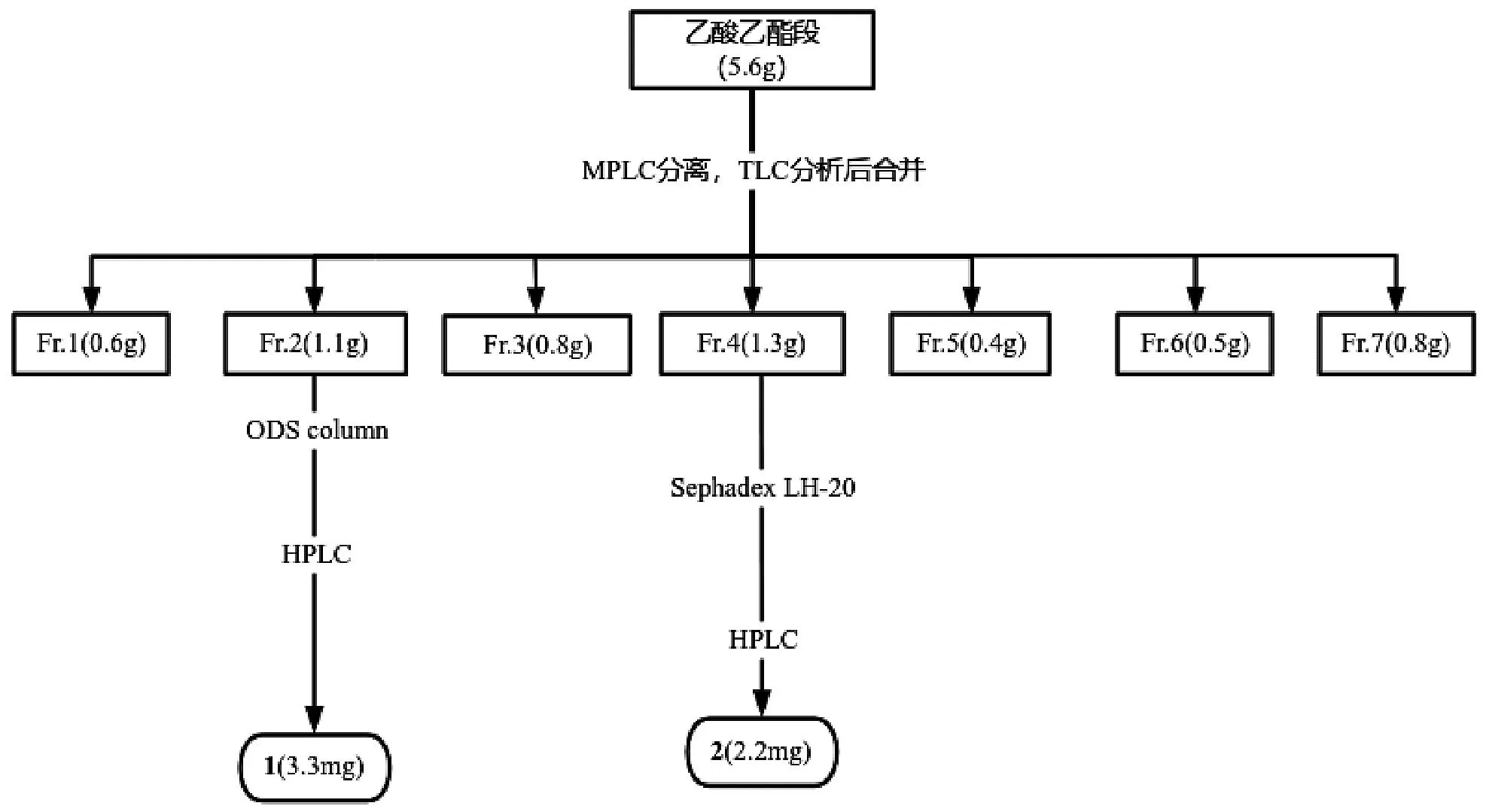
图2 化合物1和2的分离纯化流程Fig.2 Separation and purification process of compounds 1~2
2 化合物的结构鉴定
化合物1:橙红色无定形粉末,高分辨质谱HRESIMS显示m/z:401.1535[M+Na]+,合理分子式C21H24O7,不饱和度为10,核磁数据见表1。
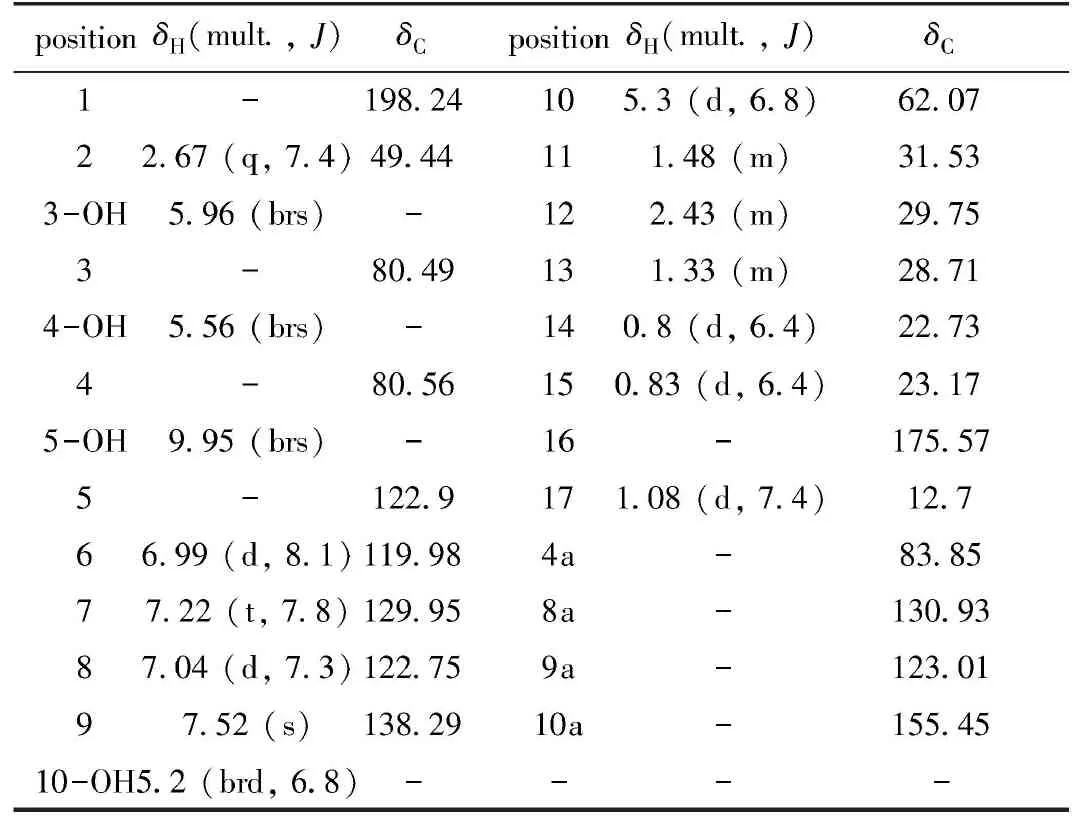
表1 化合物1的1H NMR(400 MHz)和13C NMR(100 MHz)数据归属(DMSO-d6)Table 1 1H NMR (400 MHz)and 13C NMR (100 MHz) data attribution of compound 1 (DMSO-d6)
1HNMR(400 MHz,DMSO-d6)谱中,低场区给出一个苯环上3个相邻氢信号(δH6.99,7.04,7.22),H-9和H-10两个氢间有COSY相关且与δC130.93,155.45有HMBC相关,可推断与3个相邻氢苯环相连,C-10的δC为62.97,符合C-10位连O的特征;同时H-10、H-9又与δC123.01,83.85存在HMBC相关,符合苯环连O且存在双键的特征;H-9、H-10与δC80.56,198.25存在HMBC相关,H-2与δC80.49,198.25,80.56有HMBC关联,4-OH与δC80.49,80.56有HMBC相关,3-OH与δC80.49,49.44有HMBC相关,符合三环并列特征;3-OH与δC175.75有HMBC相关,推测3-COOH与4a脱水后形成螺环,很重要的推测原因是已经分到了3-COOH化合物,一维和二维图谱都证明了三环并列存在螺环结构的合理性,查阅文献并对比确定是已知化合物rishirilide A[16](图3)。
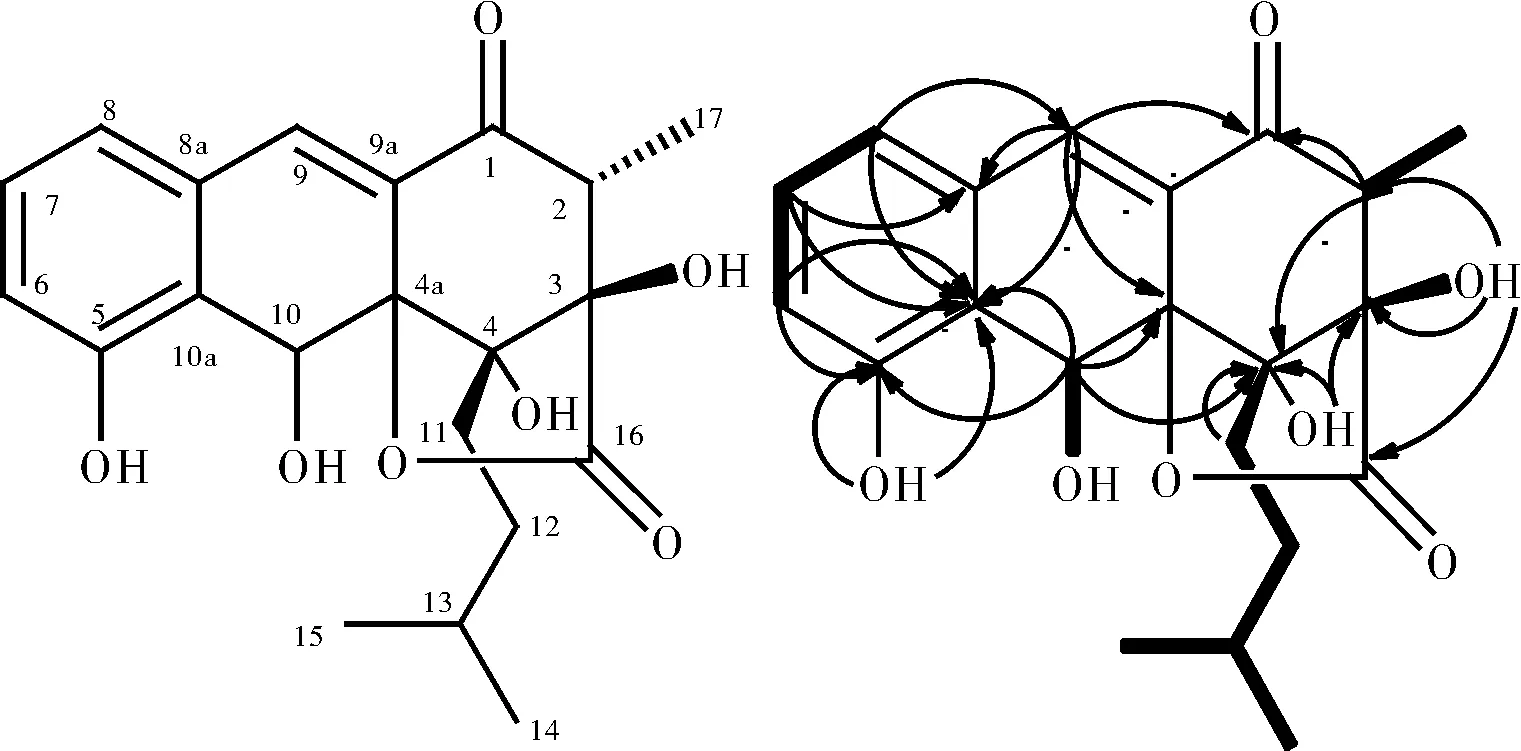
图3 化合物1的结构和二维核磁相关Fig.3 The structure of compound 1 was related to two-dimensional nuclear magnetism
化合物2:橙红色无定型粉末,高分辨质谱HRESIMS显示m/z:395.076 5[M+Na]+,分子式C21H24O6,不饱和度为10,核磁数据见表2。
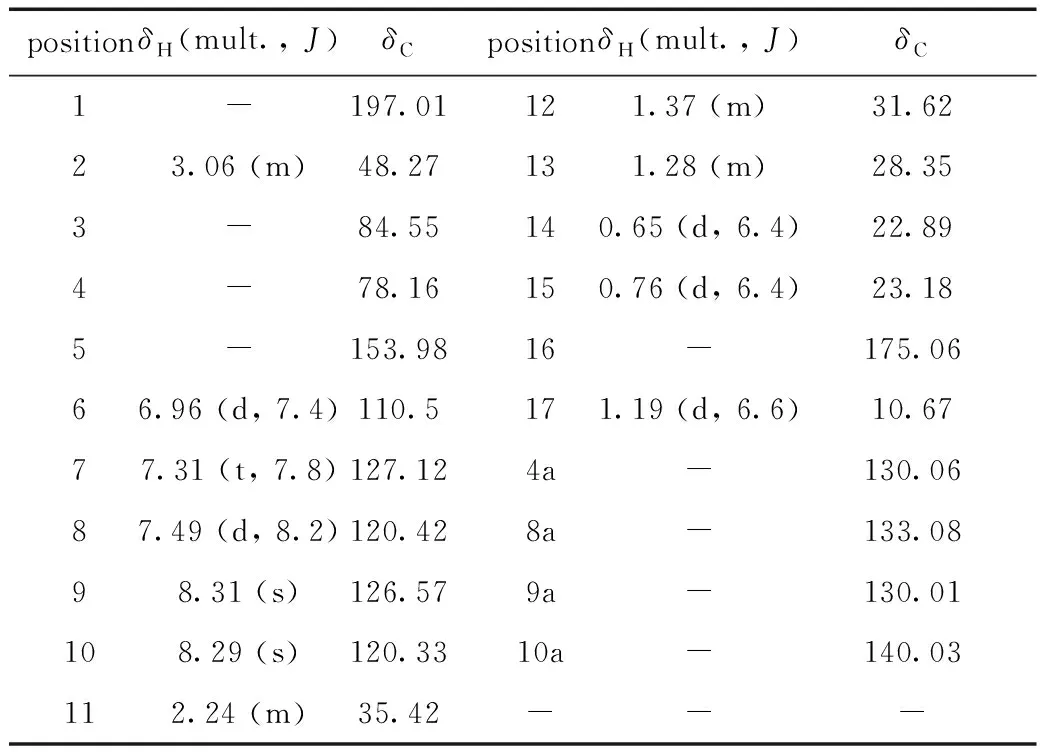
表2 化合物2的1H NMR(400 MHz)和13C NMR (100 MHz)数据归属(DMSO-d6)Table 2 1H NMR (400 MHz)and 13C NMR (100 MHz)data attribution of compound 2(DMSO-d6)
1HNMR(400 MHz,DMSO-d6)谱中,低场区也就是芳香区存在3个相邻氢的苯环(δH6.96,7.31,7.49)特征信号,δH8.31,8.29相应碳位移为δC126.57,120.33,符合苯环上单峰特征信号,13C NMR谱上有10个芳香区碳(δC110~150),符合萘环特征信号;H-2 (δH3.06)与C-16 (δC175.06)、C-3 (δC84.55)、C-1 (δC197.01)存在HMBC相关,H-9 (δH8.31)与C-1(δC197.01)有HMBC相关、H-11 (δH2.24)与C-3 (δC84.55)、C-4 (δC78.16)、C-4a (δC130.06)相关,符合三环并列特征信号,与1对比特征信号,确定2也有六元环和五碳支链,但2没有形成螺环,查阅文献并对比信号确定2是已知化合物rishirilide B[17](图4)。
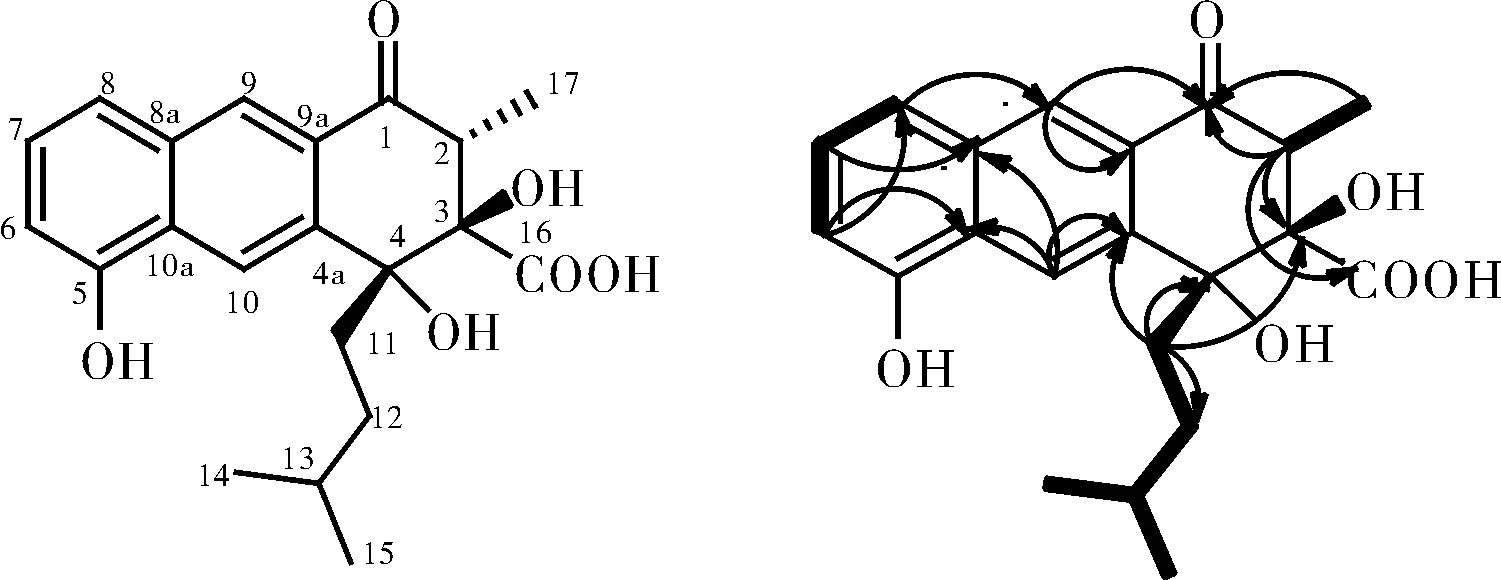
图4 化合物2的结构和二维核磁相关Fig.4 The structure of compound 2 was related to two-dimensional nuclear magnetism
3 结 论
本文研究海洋放线菌StreptomycesrishiriensisNA07600的次级代谢产物,通过发酵、分离和纯化得到聚酮类化合物1和2,此类化合物在之前被报道过具有抑制谷胱甘肽S转移酶的活性,被用于预防和治疗血栓[16],化合物1和2是一类具有多环酚醛骨架的芳香族聚酮类化合物,这一类化合物被证明具有多种生物活性,因此值得深入研究。

