Gαi1/3蛋白介导Akt-GSK3β-NFATc1信号通路调控破骨细胞分化机制研究
史册,高运,杨光辉*
(1.徐州医科大学附属宿迁医院,南京鼓楼医院集团宿迁医院骨科,江苏 宿迁 223800;2.扬州大学附属医院骨科,江苏 扬州 225100)
骨质疏松症(osteoporosis,OP)是以骨量降低、骨质脆性增加而易于骨折为特征的常见骨骼代谢性疾病,对中国居民的健康产生了严重的威胁[1]。既往研究表明,破骨细胞的数量异常增多以及功能异常活化可能是导致骨质疏松症的直接致病原因[2]。破骨细胞作为体内唯一行使骨吸收功能的细胞,由骨髓源性巨噬细胞(bone marrow-derived macrophages,BMMs)表面集落刺激因子-1受体(colony stimulating factor 1 receptor,CSF-1R)及核因子κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)受体分别与巨噬细胞集落刺激因子(macrophage colony stimulating factor,MCSF)及RANKL结合启动下游信号通路,最终分化而成[3]。MCSF属于受体酪氨酸激酶(receptor tyrosine kinases,RTKs),能促使BMMs转化为破骨细胞前体细胞并促进其增殖,同时可诱导破骨细胞前体细胞表达RANK受体增加,进一步促进破骨细胞的分化成熟[4]。近期研究发现G蛋白抑制性α亚单位1/3(Gαi1/3蛋白)在脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、干细胞因子(stem cellfactor,SCF)等RTKs介导的信号传导中发挥重要的作用[5-7],而其在同为RTKs的MCSF介导的信号传导过程中的作用尚不清楚。本研究着重探讨Gαi1/3蛋白在调控破骨细胞生成的信号传导过程中发挥的作用,为防治骨质疏松症提供新的思路。
1 材料和方法
1.1 实验动物 本实验所用8~10周龄野生型(wild type,WT)雌性C57BL/6小鼠由上海斯莱克实验动物有限公司提供[实验动物生产许可证号(SCXK(沪)2017-0005];Gαi1/3双敲除(Gαi1/3-double knock out,Gαi1/3-DKO)C57BL/6雌性小鼠由吉凯基因技术有限公司(上海)构建完成。
1.2 主要试剂与仪器 主要试剂:α-MEM培养基(Corning公司,美国);胎牛血清、0.25%胰蛋白酶(Gibco公司,美国);二甲亚砜(Abcam,中国);重组小鼠MCSF蛋白、RANKL蛋白(Abcam公司,英国);scr-shRNA、Gαi1-shRNA、Gαi3-shRNA(吉玛制药技术有限公司,中国);Gαi1、Gαi3一抗(Santa Cruz公司,美国);p-Akt473、Akt1/2/3、p-GSK3β、GSK3β、NFATc1一抗(Cell Signaling Technology公司,中国);抗酒石酸酸性磷酸酶染色试剂盒(tartrate resistant acid phosphatase,TRAP)(Sigma公司,英国)。
主要仪器:酶标仪(TECAN公司,瑞士);倒置显微镜(NIKON公司,日本),Micro CT扫描机(通用公司,美国);低温高速离心机(Thermo Fisher Scientific公司,美国)。
1.3 实验方法
1.3.1 小鼠BMMs提取及纯化 将8~10周龄野生型及Gαi1/3-DKO雌性C57/BL6小鼠断颈处死,切取下肢并剔除所附软组织,剪除股骨及胫骨两端软骨冲取髓腔内细胞,冲洗液经70 μm滤网过滤后1 200 rpm离心5 min,吸弃上清液后加入2 mL红细胞裂解液吹打重悬后静置裂解2 min,加入4 mL磷酸盐缓冲液(phosphate buffered solution,PBS)终止裂解予1 200 rpm离心5 min,弃上清即得小鼠BMMs,加入完全培养基培养24 h后吸取上清液,同法离心弃上清,加入预制培养基[α-MEM+10%胎牛血清(fetal bovine serum,FBS)+50 ng/mL MCSF],培养2~3 d所得贴壁细胞即为纯化BMMs。
1.3.2 慢病毒转染 将所得纯化BMMs以5×104/孔密度铺板于6孔培养板中,待24 h细胞数量增殖约为1×105加入依据感染复数(multiplicity of infection,MOI)=10配置的含有scr-shRNA、Gαi1-shRNA和Gαi3-shRNA的无双抗培养基(α-MEM+10%FBS),24 h后更换为无病毒培养基培养,定期于荧光显微镜下观察转染情况。
1.3.3 破骨细胞诱导分化及TRAP染色 以5×104/mL密度于6孔培养板中接种先前成功转染慢病毒BMMs,加入浓度50 ng/mL MCSF+50 ng/mL RANKL进行诱导,每2 d更换培养液至第4天破骨细胞分化成熟。依据TRAP操作说明书进行染色,使用倒置显微镜进行样本拍照,观察破骨细胞大小及数量。
1.3.4 蛋白免疫印迹(western blot,WB) 待检测预处理BMMs及分化成熟破骨细胞,使用RIPA裂解液提取蛋白。使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离总蛋白,再转印至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)上,脱脂牛奶封闭1 h,4 ℃孵育一抗Gαi1、Gαi3、p-Akt473、Akt1/2/3、p-GSK3β、GSK3β、NFATc1摇床过夜,随后二抗孵育2 h,完成后使用PBS加Tween20(PBS plus tween 20,PBST)清洗后加入电化学发光(electro-chemi luminescence,ECL)压片显影,使用Image J软件定量分析目标条带。
1.3.5 小鼠骨质疏松模型制备及给药 随机选择12只6~7周龄雌性C57/BL6小鼠分为scr-shRNA及Gαi1/3-shRNA两组各6只,喂养1周后行去势手术,术后3 d每只小鼠予肌注青霉素40 000 U预防感染。两组小鼠术后第4天腹腔麻醉下予右侧股骨干骺端微量注射慢病毒scr-shRNA及Gαi1/3-shRNA(每侧1 μL,滴度为3×108U/mL),持续7 d。
1.3.6 骨骼样本收集及Micro CT检测 4周后将两组小鼠脱颈处死,剥取右侧股骨予多聚甲醛固定,3 d后行Micro CT检查。扫描分辨率为10 μm,自生长板底部0.5 mm处开始扫描,应用内置软件对干骺端松、皮质骨进行图像重建及骨量测量。
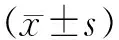
2 结 果
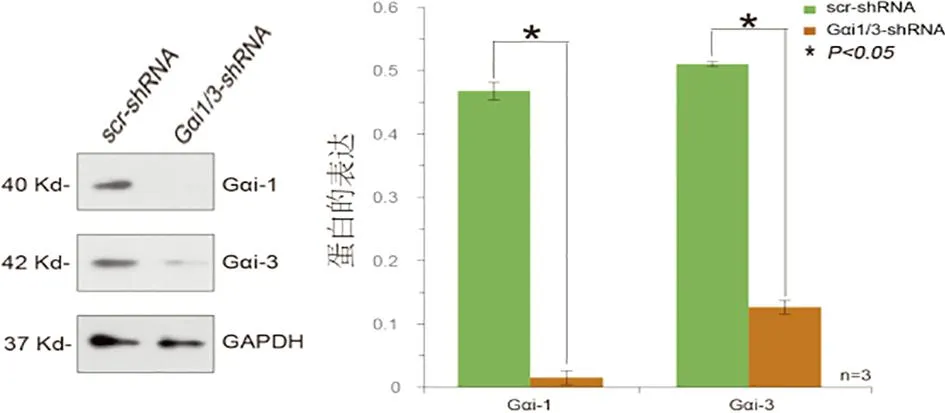
2.1 BMMs中转染shRNA慢病毒抑制Gαi1/3表达 为探讨Gαi1/3在破骨细胞分化过程中的调控作用,采用shRNA慢病毒干扰方法,通过scr-shRNA(GFP-RNA)、Gαi1-shRNA和Gαi3-shRNA转导至WT BMMs中,24 h后在荧光显微镜下观察病毒转染情况(见图1a)。转染成功后WB证实BMMs中Gαi1/3蛋白表达受到显著抑制(见图1b)。
a scr-shRNA、Gαi1-shRNA、Gαi3-shRNA 慢病毒序列及转染后荧光图
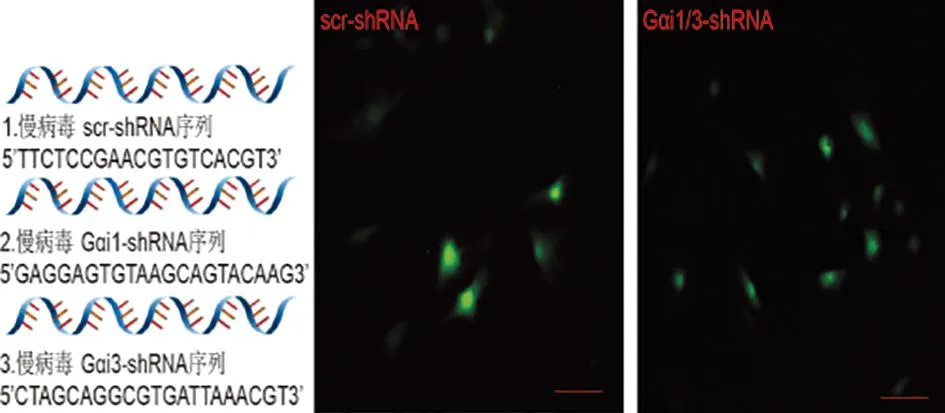
2.2 敲减Gαi1/3抑制MCSF及MCSF+RANKL诱导Akt-GSK3β-NFATc1通路的活化 scr-shRNA、Gαi1/3-shRNA转染WT BMMs成功后使用MCSF(50 ng/mL)、RANKL(50 ng/mL)、MCSF(50 ng/mL)+RANKL(50 ng/mL)处理30 min,WB检测发现与对照组相比,敲减Gαi1/3显著抑制MCSF及MCSF+RANKL诱导Akt-GSK3β-NFATc1通路活化(见图2a~b),而对RANKL诱导通路活化影响无显著抑制作用(见图2c)。
a MCSF诱导敲减Gαi1/3的BMMs中Akt-GSK3β-NFATc1通路蛋白表达
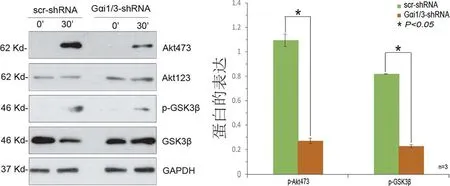
2.3 敲除Gαi1/3抑制MCSF及MCSF+RANKL诱导Akt-GSK3β-NFATc1通路的活化 为进一步研究Gαi1/3对MCSF等因子活化作用影响,提取CRISPR/Cas9-Gαi1/3-DKO雌性C57BL/6小鼠的BMMs,同样应用MCSF(50 ng/mL)、RANKL(50 ng/mL)、MCSF(50 ng/mL)+RANKL(50 ng/mL)处理30 min,WB检测发现敲除Gαi1/3显著抑制MCSF及MCSF+RANKL诱导Akt-GSK3β-NFATc1通路活化(见图3a~b),而对RANKL诱导通路活化无显著抑制作用(见图3c)。
a MCSF诱导敲除Gαi1/3的BMMs中Akt-GSK3β-NFATc1通路蛋白表达
2.4 敲减Gαi1/3抑制破骨分化关键蛋白表达及破骨细胞分化 采用WB进行检测发现敲减Gαi1/3显著抑制MCSF(50 ng/mL)+RANKL(50 ng/mL)诱导4 d的破骨细胞分化关键蛋白NFATc1的表达(见图4a),同时显著抑制破骨细胞生成数量(见图4b)。
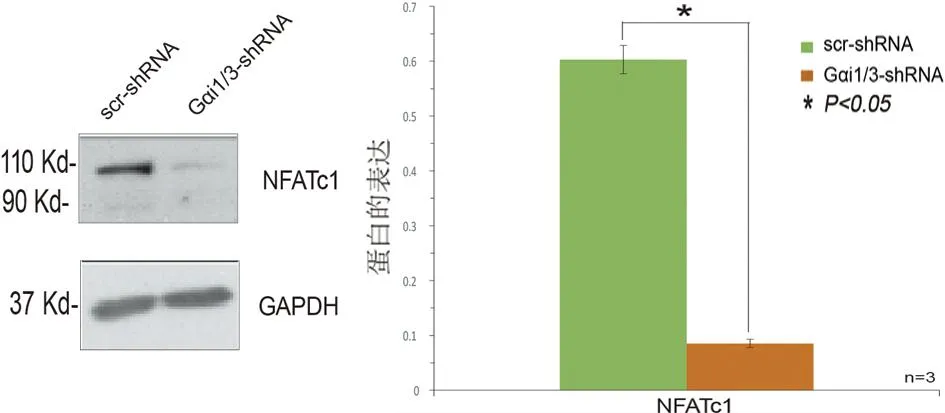
a 敲减Gαi1/3破骨细胞分化关键蛋白NFATc1的表达
2.5 敲减Gαi1/3减轻小鼠骨质疏松模型中的骨质丢失 分别向WT小鼠骨质疏松模型股骨干骺端注射scr-shRNA、Gαi1/3-shRNA,4周后行Micro CT检查敲减Gαi1/3可显著减轻骨质疏松导致骨质丢失,进一步分析显示敲减Gαi1/3对于松质骨丢失的挽救作用略高于皮质骨的丢失(见图5)。
a 小鼠骨质疏松模型股骨干骺端注射scr-shRNA、Gαi1/3-shRNA后Gαi1/3表达
3 讨 论
既往研究表明骨质疏松症主因在于骨代谢失衡骨吸收增多所致,而破骨细胞数量增多及异常活化被证实是骨吸收异常增多的主因[2]。目前治疗骨质疏松症的药物可导致下颌骨缺血性坏死、骨重建紊乱等不良反应[8],因此进一步了解骨质疏松症的发病机制,针对性开发更加安全的新型治疗药物显得愈加迫切[9-10]。
G蛋白由α、β、γ三个亚单位构成,其中Gα蛋白可分为Gi、Gs等6种类型亚基,既往研究显示G蛋白抑制性α亚基(Gαi蛋白)可以与G蛋白耦联受体(G protein-coupled receptors,GPCRs)相互结合从而发挥介导下游信号传递的作用[11]。笔者所在课题组前期研究发现G蛋白抑制性α亚单位1/3(Gαi1/3)能够介导多个RTKs诸如BDNF、VEGF、SCF等下游信号转导,通过敲减Gαi1/3可使其下游PI3K-Akt-mTOR、MAPK-Erk等通路的活化受到抑制[5-7]。
为进一步明确Gαi1/3在同属于RTKs的MCSF的信号转导过程中的作用,本研究采用MCSF和RANKL联合诱导原代BMMs分化破骨细胞,该方法接近破骨细胞体内分化微环境,目前广泛用于骨质疏松症进展调控的研究[9]。本研究采用慢病毒敲减及基因敲除策略,获取scr-shRNA、Gαi1/3-shRNA及Gαi1/3-DKO三种BMMs,研究中发现敲减、敲除Gαi1/3可显著抑制经典破骨细胞分化信号通路Akt-GSK3β-NFATc1中关键蛋白的表达,尤其是终末分化关键蛋白NFATc1[12]。同时本实验发现敲减、敲除Gαi1/3对于RANKL诱导的Akt-GSK3β通路活化无显著抑制作用,考虑RANKL不属于RTKs且Gαi1/3未参与核因子NF-κb等主要传导通路所致,与前期既往研究结果一致[13-16]。本研究Gαi1/3-shRNA BMMs中加入MCSF 50 ng/mL+RANKL 50 ng/mL联合诱导4 d进行染色显示生成的破骨细胞的细胞核较少及体积明显缩小,且生成数量显著减少,提示敲减Gαi1/3对于BMMs向破骨细胞分化有显著的抑制作用。最后体内实验显示,在小鼠骨质疏松模型中股骨干骺端注射Gαi1/3-shRNA可显著抑制去势雌鼠的骨质丢失,且对松质骨的丢失有更强的逆转趋势,进一步证实Gαi1/3蛋白在骨质疏松进程中扮演关键角色。
既往研究显示MCSF对破骨细胞祖细胞的存活和增殖是必需的,同时MCSF含量与破骨细胞数量密切相关,MCSF基因缺陷可导致小鼠先天性骨质硬化症,而外源性补充MCSF可促进骨硬化症小鼠体内破骨细胞数量增多恢复骨吸收功能[17]。目前对于MCSF调控破骨细胞分化的研究主要集中在MCSF受体c-fms及相关信号通路[18],而本研究着重于探讨Gαi1/3蛋白对于破骨细胞分化的调控作用,从而进一步明确MCSF调控破骨细胞分化的分子机制并对其进行干预,对于预防和治疗骨质疏松具有重要的临床意义。
综上所述,本研究从分子、细胞及在体实验初步解析Gαi1/3蛋白通过介导Akt-GSK3β-NFATc1信号通路调控破骨细胞分化机制,可为临床治疗骨质疏松提供新的思路和治疗靶点。

