程序性死亡受体1 抑制剂联合化疗治疗食管癌的疗效及对患者免疫功能的影响
王建新,时沛,李颖璐,孙义长
南阳医学高等专科学校第一附属医院肿瘤内科,河南南阳 4730000
食管癌是临床常见的消化道恶性肿瘤,多数患者由于食管受压导致食管狭窄进食困难,营养状况往往较差[1-2]。随着中国老龄化的加剧,食管癌的发病率逐渐上升,食管癌患者早期可无明显症状,多数患者确诊时已进展为晚期,失去了手术治疗的机会[3]。晚期食管癌患者多采用姑息性化疗,但多数患者对常规的化疗药物如紫杉醇、顺铂等的敏感性较差,不能取得令人满意的结果,无法获得较好的生存获益,有研究采用多西他赛治疗食管癌,疗效较好[4]。近年来,生物免疫治疗逐渐应用于恶性肿瘤患者的治疗中,其中程序性死亡受体1(programmed cell death 1,PDCD1,也称PD-1)抑制剂在非小细胞肺癌、胃癌等的免疫治疗中取得了显著的疗效[5-6]。因此,本研究探讨生物免疫治疗联合化疗治疗食管癌的疗效,现报道如下。
1 资料与方法
1.1 一般资料
选取2021 年1 月至2022 年10 月南阳医学高等专科学校第一附属医院收治的102 例晚期食管癌患者。纳入标准:①符合《食管癌规范化诊治指南》[7]中关于食管癌的诊断标准;②近3 个月无化疗及免疫治疗史;③临床分期为Ⅲ~Ⅳ期。排除标准:①对化疗不耐受;②严重感染;③合并其他部位恶性肿瘤;④继发性食管癌;⑤存在语言、精神功能障碍,无正常沟通能力。根据纳入和排除标准,本研究共纳入102 例晚期食管癌患者,依据治疗方法的不同分为多西他赛组(n=50)和单抗组(n=52),多西他赛组患者给予多西他赛化疗,单抗组患者在多西他赛组的基础上联合卡瑞利珠单抗治疗。多西他赛组中,男28例,女22例;年龄43~75岁,平均(57.43±2.35)岁;体重指数18.23~24.26 kg/m2,平均(20.15±1.03)kg/m2;病程3~25 个月,平均(13.28±1.03)个月;临床分期:Ⅲ期38 例,Ⅳ期12例。单抗组中,男29 例,女23 例;年龄42~75 岁,平均(57.38±2.32)岁;体重指数18.26~24.29 kg/m2,平均(20.17±1.06)kg/m2;病程3~26 个月,平均(13.11±1.06)个月;临床分期:Ⅲ期39 例,Ⅳ期13例。两组患者性别、年龄、体重指数、临床分期比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 治疗方法
多西他赛组患者给予多西他赛化疗:第1 天,多西他赛75 mg/m2静脉滴注,用药前1 天、用药当天、用药后1 天口服地塞米松片8 mg,每天2次。单抗组患者在多西他赛化疗的基础上联合卡瑞利珠单抗治疗:第1 天,卡瑞利珠单抗200 mg静脉滴注。21 天为1 个疗程,两组患者均治疗3个疗程。
1.3 观察指标和评价标准
①依据实体瘤疗效评价标准[8]评估两组患者的临床疗效:完全缓解,目标病灶彻底消失,持续1个月;部分缓解,目标病灶最大径之和与基线相比减少≥30%,持续1 个月;疾病稳定,目标病灶最大径之和与基线相比减少<30%或增加<20%;疾病进展,目标病灶最大径之和与基线相比增加≥20%或出现新病灶。客观缓解率=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。②治疗前后,抽取两组患者外周静脉血5 ml,采用流式细胞仪检测两组患者的免疫功能指标,包括CD3+、CD4+、CD8+。③治疗前后,采用欧洲癌症研究与治疗组织生命质量测定量表(European Organization for Research and Treatment of Cancer quality of life questionnaire core 30,EORTC QLQ-C30)[9]评估两组患者的生活质量,包括躯体功能、社会功能、认知功能、情绪功能、角色功能5 个维度,每个维度总分均为100 分,评分与生活质量呈正比。④比较两组患者治疗过程中的不良反应发生情况,包括甲状腺功能减退、发热、胃肠道反应、贫血、乏力、高脂血症、肝功能损伤、皮肤不良反应、心脏毒性。
1.4 统计学方法
采用SPSS 21.0 软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 临床疗效的比较
单抗组患者的客观缓解率为55.77%(29/52),与多西他赛组患者的38.00%(19/50)比较,差异无统计学意义(χ2=3.231,P=0.072);单抗组患者的疾病控制率为71.15%(37/52),高于多西他赛组患者的52.00%(26/50),差异有统计学意义(χ2=3.960,P=0.047)。(表1)

表1 两组患者的临床疗效[n(%)]
2.2 免疫功能指标的比较
治疗前,两组患者CD3+、CD4+、CD8+水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者CD3+、CD4+水平均高于本组治疗前,CD8+水平均低于本组治疗前,单抗组患者CD3+、CD4+水平均高于多西他赛组,CD8+水平低于多西他赛组,差异均有统计学意义(P<0.05)。(表2)
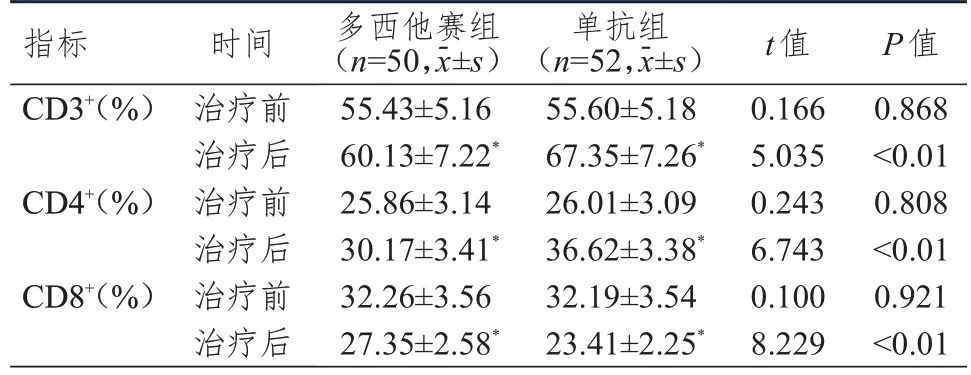
表2 治疗前后两组患者免疫功能指标的比较
2.3 生活质量的比较
治疗前,两组患者EORTC QLQ-C30 量表各维度评分比较,差异均无统计学意义(P>0.05)。治疗后,两组患者EORTC QLQ-C30 量表各维度评分均高于本组治疗前,单抗组患者EORTC QLQ-C30量表各维度评分均高于多西他赛组,差异均有统计学意义(P<0.05)。(表3)
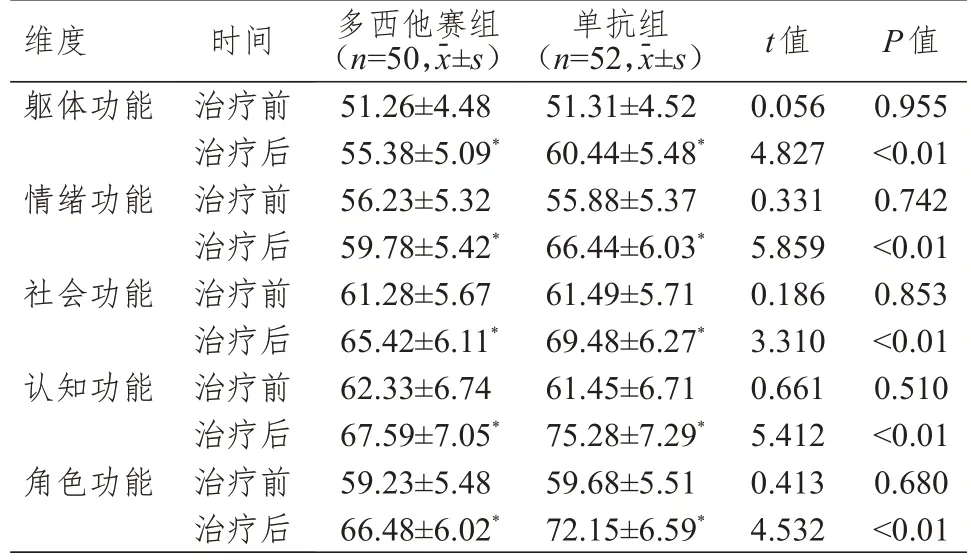
表3 治疗前后两组患者EORTC QLQ-C30量表评分的比较
2.4 不良反应发生情况的比较
单抗组患者的不良反应总发生率为61.54%(32/52),与多西他赛组患者的56.00%(28/50)比较,差异无统计学意义(χ2=0.323,P=0.570)。(表4)

表4 两组患者的不良反应发生情况[n(%)]
3 讨论
目前,食管癌的发病机制尚不十分明确,多与居住环境、遗传因素、饮食不健康、进食过烫食物有关,随着医疗技术的不断发展,食管癌的治疗方法不断涌现,但晚期食管癌患者的5 年生存率仍较低[10]。晚期食管癌患者身体机能较差,且对化疗药物适应性不佳,因此,如何有效治疗食管癌是目前亟需解决的问题[11]。
多西他赛能够抑制细胞有丝分裂,作用于细胞周期的G2/M 期,可诱导肿瘤细胞凋亡[12-13]。但部分患者对铂类药物和紫杉类药物的耐药性较强,影响了治疗效果[14]。随着社会的进步与发展,免疫治疗逐渐成为不可或缺的治疗方案,PD-1成为多种恶性肿瘤治疗的重要靶点之一。PD-1 是Ⅰ型跨膜糖蛋白,可在成熟的T细胞中表达,研究发现,PD-1与免疫应答的负调控机制相关,且在食管癌患者T 细胞中的表达异常高于其他淋巴细胞,因此,认为PD-1 与肿瘤细胞的增殖及淋巴结转移有关[15-16]。PD-1 能够促进淋巴结中抗原特异性T 细胞凋亡,有效抑制自身免疫性疾病,但同时也不利于免疫系统杀伤肿瘤细胞[17]。PD-1 抑制剂是可阻断PD-1的药物,能够激活免疫系统攻击肿瘤细胞;PD-1 人源化单克隆抗体包括纳武利尤单抗、帕博利珠单抗、特瑞普利单抗及卡瑞利珠单抗等[18-19]。免疫治疗药物主要通过与PD-1受体结合,促使毒性T细胞活化,发挥免疫功能,从而抑制肿瘤细胞生长,发挥抗肿瘤作用。研究显示,PD-1抑制剂治疗食管癌具有良好的抗肿瘤活性,且安全性较高[20-21]。本研究结果显示,单抗组患者的疾病控制率为71.15%,高于多西他赛组患者的52.00%,差异有统计学意义;治疗后,两组患者的免疫功能指标及EORTC QLQC30 量表各维度评分均有所改善;但两组患者治疗期间的不良反应发生情况无明显差异。提示PD-1抑制剂联合化疗治疗晚期食管癌的疗效确切,可改善患者的生活质量,增强免疫力,且不良反应较少。
综上所述,PD-1 抑制剂联合化疗治疗晚期食管癌的疗效确切,可改善患者的生活质量和免疫功能,且不良反应较少。

