CDK4/6抑制剂联合NSAI 一线治疗绝经后HR 阳性HER2 阴性晚期乳腺癌疗效和安全性的Meta 分析△
黄玉,石印青,张思宇,杜立新
1山西大同大学医学院,山西大同 037009
2大同市第三人民医院普外科,山西大同 0370000
晚期乳腺癌中激素受体阳性(hormone receptor positive,HR+)、人表皮生长因子受体2 阴性(human epidermal growth factor receptor 2 negative,HER2-)是最常见的亚型[1],内分泌治疗仍然占据核心地位,主要包括选择性雌激素受体调节剂、选择性雌激素受体下调剂、第三代芳香化酶抑制剂(aromatase inhibitor,AI)和促黄体生成素释放激素类似物等,但将近50%的HR+晚期乳腺癌患者会出现继发耐药,导致复发和进展,使其疗效受限[2-5]。近年来,随着周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4/6 抑制剂研究的深入,CDK4/6 抑制剂[以瑞博西利(Ribociclib)、哌柏西利(Palbociclib)和阿贝西利(Abemaciclib)为主]联合内分泌治疗已成为HR+/HER2-晚期乳腺癌的优先推荐治疗方案,显著延长了患者的无进展生存期(progression-free survival,PFS),同时改善了单纯内分泌治疗抵抗的不足,为HR+晚期乳腺癌的治疗注入了新的活力[6-8]。关于CDK4/6抑制剂联合内分泌治疗的Meta 分析中鲜有对内分泌治疗药物种类、绝经状态、治疗线别等影响疾病结局的混杂因素进行分类研究。本研究采用荟萃分析评估CDK4/6 抑制剂联合非甾体类芳香化酶抑制剂(nonsteroidal aromatase inhibitor,NSAI)一线治疗绝经后HR+/HER2-晚期乳腺癌的疗效和安全性,现报道如下。
1 资料与方法
1.1 文献检索策略
对中国知网、维普中文科技期刊数据库、万方数据库、中国生物医学文献数据库、PubMed、EMbase、Web of Science、Cochrane Library、ClinicalTrials.gov 等数据库进行检索,检索时间为建库至2022年11 月30 日。检索词以主题词和自由词相结合。中文检索词包括“晚期乳腺癌”“细胞周期蛋白依赖性激酶4/6 抑制剂”“内分泌治疗”“芳香化酶抑制剂”“非甾体类芳香化酶抑制剂”“瑞博西利”“哌柏西利”“阿贝西利”“来曲唑”“阿那曲唑”。英文检索词包括“advanced breast cancer”“CDK4/6 inhibitors”“endocrine therapy”“aromatase inhibitors”“nonsteroidal aromatase inhibitors”“Ribociclib”“Palbociclib”“Abemaciclib”“Letrozole”“Anastrozole”。
1.2 纳入和排除标准
纳入标准:①研究类型。CDK4/6 抑制剂联合内分泌治疗HR+/HER2-晚期乳腺癌的Ⅱ/Ⅲ期临床随机对照试验(randomized controlled trial,RCT)。②研究对象。经病理学或细胞学检查确诊的HR+/HER2-晚期乳腺癌患者;一线治疗;绝经后;美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分为0~2 分。③干预措施。试验组患者采用CDK4/6 抑制剂联合NSAI 治疗,对照组患者采用单纯NSAI 或联合安慰剂治疗。④结局指标。a. 中位无进展生存期(median progression-free survival,mPFS)和中位总生存期(median overall survival,mOS),同时对mPFS 和mOS 两项指标进行年龄、ECOG 体力状况评分、转移部位、是否曾接受化疗和内分泌治疗、无治疗间隔期等因素的亚组分层分析。b. 客观缓解率(objective response rate,ORR)和临床获益率(clinical benefit rate,CBR),包括对所有可测量病灶的ORR和CBR 分析。c. 所有等级的不良反应和3~4 级不良反应。
排除标准:①重复发表的文献;②非中英文文献;③数据不可提取、无全文、无完整数据、研究类型不符、其他恶性肿瘤研究;④综述、会议报告、病例报告、Meta 分析及与本研究无关的文献;⑤早期乳腺癌的辅助治疗或新辅助治疗研究;⑥回顾性、临床前或Ⅰ期临床研究。同一研究多次发表提取最新结果数据。
1.3 资料提取与偏倚风险评估
由两名评价员根据纳入和排除标准独立进行文献筛选,提取资料并交叉核对,如存在分歧与第三人商讨达成共识。采用Cochrane 协作网偏倚风险评价工具对纳入的RCT 进行7 项评估:随机分配、分配隐藏、研究者和受试者的盲法、研究结局的盲法、结局数据完整性、选择性报告、其他偏倚来源。偏倚风险分为低风险、高风险和不清楚的风险。
1.4 统计学方法
采用RevMan 5.3 软件对数据进行统计分析。首先进行异质性检验,P>0.10 且I2<50%表示具有同质性,选择固定效应模型分析;P≤0.10 且I2≥50%表示具有异质性,选择随机效应模型分析,必要时采用敏感性分析检验结果的稳定性。纳入研究的结局指标包括生存资料(mOS、mPFS)和二分类变量资料(ORR、CBR 和AE)两种类型,分别采用风险比(hazard ratio,HR)和危险比(risk ratio,RR)及其95%CI 作为效应分析统计量。采用Stata 14.0 软件的漏斗图和Egger’s 检验分析主要结局指标mPFS、ORR、CBR 的发表偏倚。以P<0.05 为差异有统计学意义。
2 结果
2.1 文献筛选流程及结果
初筛获得文献3147篇,最终纳入11篇文献[9-19],共5 项RCT,其中MONALEESA-2 研究3 篇[9-11],MONARCH-3研究1篇[12],PALOMA-1研究3篇[13-15],PALOMA-2 研究3 篇[16-18],PALOMA-4 研究1 篇[19]。共纳入2332 例研究对象,其中试验组1359 例,对照组973 例。文献筛选流程见图1。
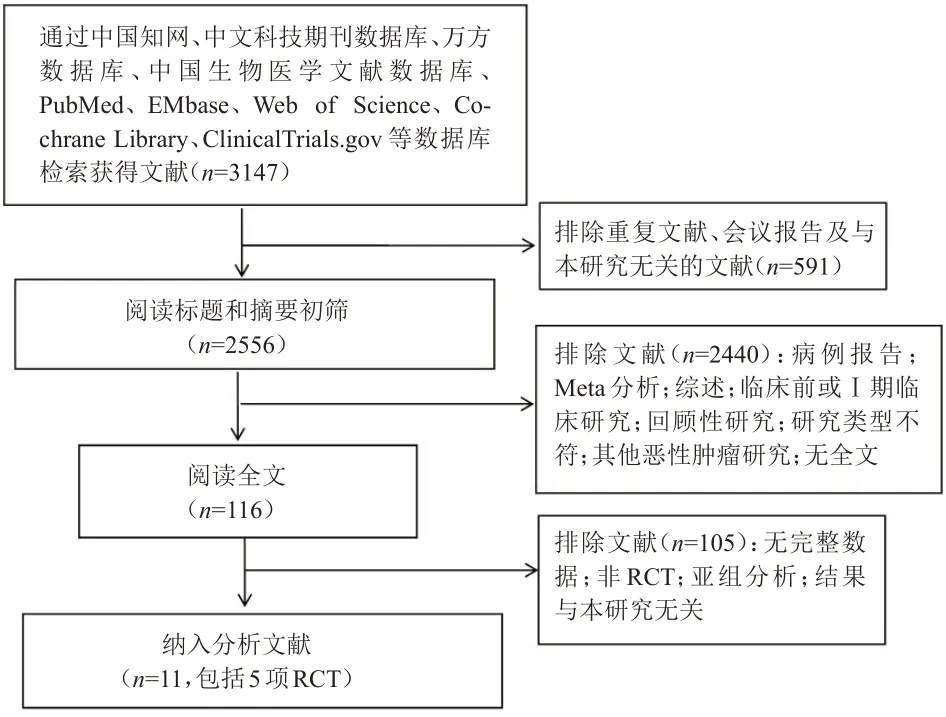
图1 文献筛选流程
2.2 纳入研究的基本特征及质量评价
纳入文献均为英文文献。两组受试者的基线资料均具有可比性。PALOMA-4 研究均为亚洲人,MONALEESA-2、MONARCH-3、PALOMA-1 和PALOMA-2 研究均以白种人为主。药物干预中,CDK4/6 抑制剂研究包括瑞博西利1 项,阿贝西利1 项,哌柏西利3 项;非甾体类药物研究包括来曲唑5 项,阿那曲唑1 项。除PALOMA-2 研究中12例患者ECOG 体力状况评分为2 分外,其他均为0~1 分。纳入研究的基本特征见表1。质量评价结果显示,纳入的5 项研究中除PALOMA-1 是开放性试验外,其他均为双盲,数据完整性和选择性报告研究结果均为低风险,是否有其他偏倚尚不清楚(图2)。

表1 纳入研究的基本特征
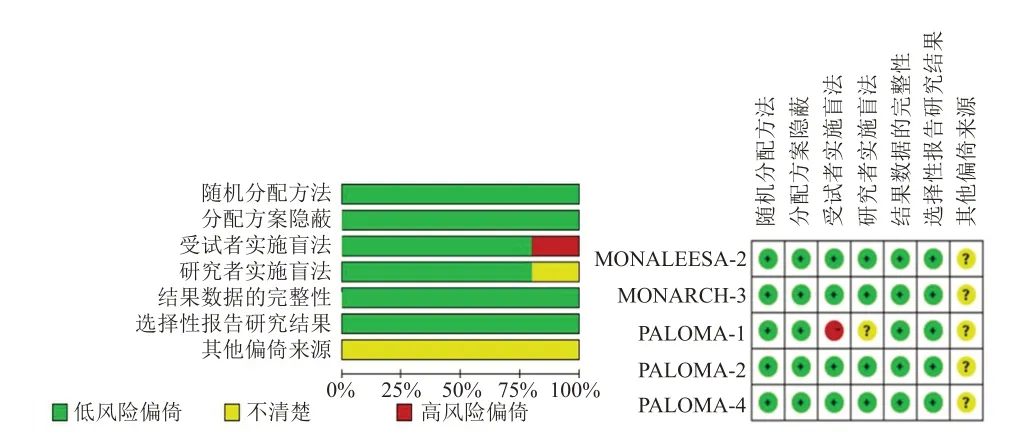
图2 纳入研究的偏倚风险评估结果
2.3 Meta 分析结果
2.3.1 mOS MONALEESA-2[11]和PALOMA-1[15]两项研究报道了mOS。异质性检验结果显示,P=0.43,I2=0%,采用固定效应模型。Meta 分析结果显示,试验组患者的mOS 明显长于对照组,差异有统计学意义(HR=0.79,95%CI:0.66~0.94,P<0.01)(图3)。由于其他3 项研究尚未报道终点结果,纳入分析的样本量有限,因此在年龄、ECOG 体力状况评分、转移部位、是否曾接受化疗和内分泌治疗等亚组分析中mOS 尚无确切的定论。

图3 HR+/HER2-晚期乳腺癌患者mOS的Meta分析森林图
2.3.2 mPFS 5 项研究[10,12,14,17,19]报道了mPFS。异质性检验结果显示,P=0.62,I2=0%,采用固定效应模型。Meta 分析结果显示,试验组患者的mPFS 明显长于对照组,差异有统计学意义(HR=0.58,95%CI:0.52~0.64,P<0.01)(图4)。亚组分析结果显示,无论年龄是否≥65 岁、ECOG 体力状况评分为0 分或1~2 分、内脏转移或骨转移、是否曾接受化疗或内分泌治疗,试验组患者的mPFS 均明显长于对照组(P<0.01)(表2)。
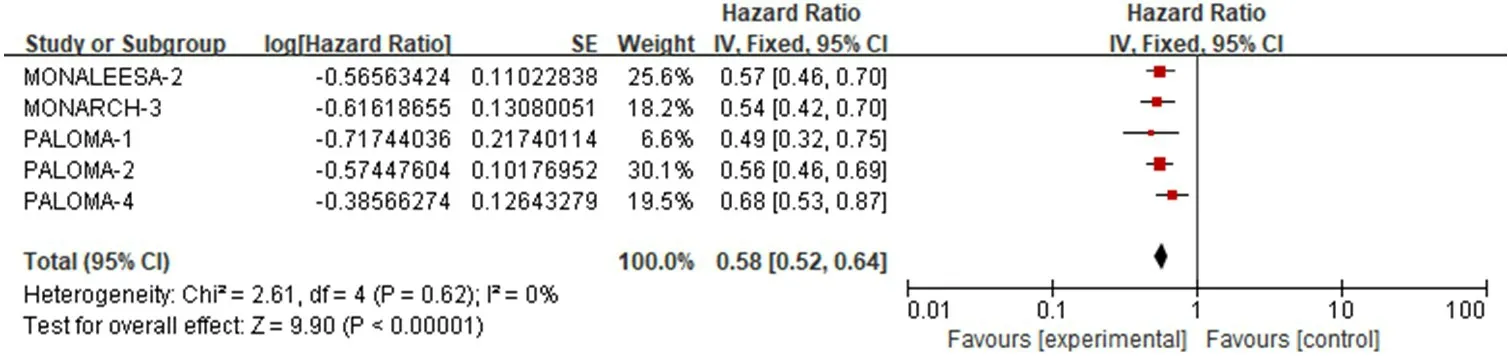
图4 HR+/HER2-晚期乳腺癌患者mPFS的Meta分析森林图
2.3.3 ORR 5 项研究[9,12-13,16,19]报道了ORR。对所有入组患者的ORR 进行分析,异质性检验结果显示,P=0.69,I2=0%,采用固定效应模型;Meta 分析结果显示,试验组患者的ORR 明显高于对照组,差异有统计学意义(RR=1.31,95%CI:1.17~1.47,P<0.01)(图5)。对具有可测量病灶患者的ORR[9,12,16,19]进行分析,异质性检验结果显示,P=0.60,I2=0%,采用固定效应模型;Meta 分析结果显示,试验组患者的ORR 明显高于对照组,差异有统计学意义(RR=1.30,95%CI:1.17~1.45,P<0.01)(图6)。
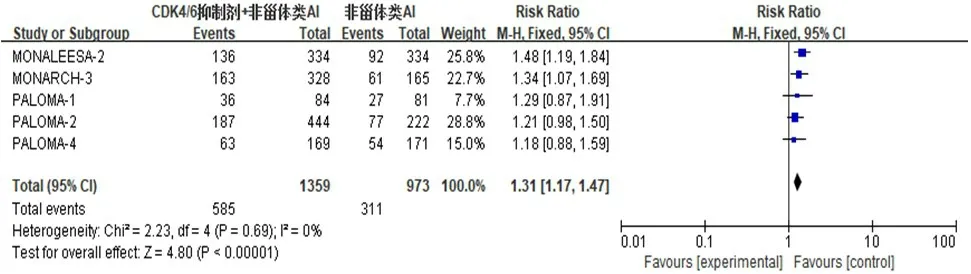
图5 所有入组HR+/HER2-晚期乳腺癌患者ORR的Meta分析森林图

图6 具有可测量病灶HR+/HER2-晚期乳腺癌患者ORR的Meta分析森林图
2.3.4 CBR 5 项研究[9,12-13,16,19]报道了CBR。对所有入组患者的CBR 进行分析,异质性检验结果显示,P=0.02,I2=67%,采用随机效应模型;Meta 分析结果显示,试验组患者的CBR 明显高于对照组,差异有统计学意义(RR=1.13,95%CI:1.03~1.23,P<0.01)(图7)。对具有可测量病灶患者的ORR[9,12,16,19]进行分析,异质性检验结果显示,P=0.11,I2=50%,采用随机效应模型;Meta 分析结果显示,试验组患者的CBR 明显高于对照组,差异有统计学意义(RR=1.11,95%CI:1.05~1.18,P<0.01)(图8)。对上述两项指标进行敏感性分析,删除任意一项研究均不会影响研究结果,说明研究结果是稳定可靠的。
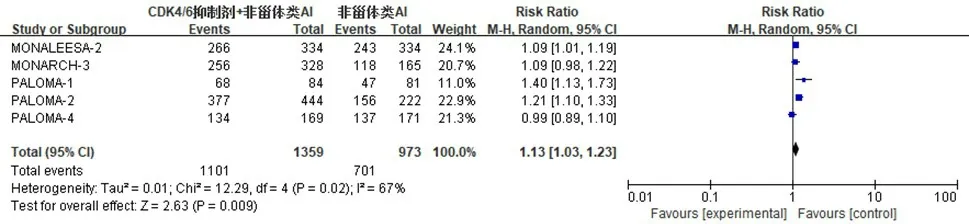
图7 所有入组HR+/HER2-晚期乳腺癌患者CBR的Meta分析森林图
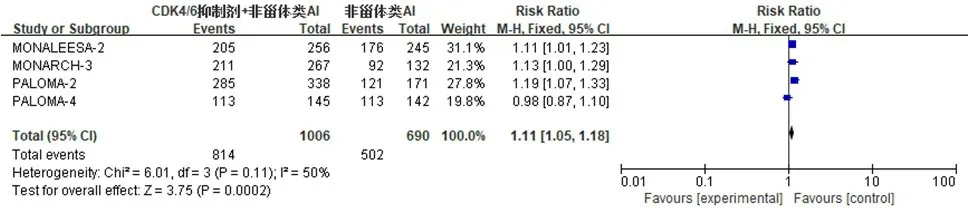
图8 具有可测量病灶HR+/HER2-晚期乳腺癌患者CBR的Meta分析森林图
2.3.5 安全性 5 项研究[9,12,15-16,19]报道了不良反应。对所有等级的不良反应进行分析,异质性检验结果显示,P<0.10,I2=94%,采用随机效应模型;Meta分析结果显示,试验组患者不良反应总发生率高于对照组,差异有统计学意义(RR=1.09,95%CI:1.01~1.17,P<0.05)(图9)。对3~4 级不良反应发生率[9,12,16,19]进行分析,异质性检验结果显示,P=0.01,I2=73%,采用随机效应模型;Meta 分析结果显示,试验组患者3~4 级不良反应发生率明显高于对照组,差异有统计学意义(RR=2.90,95%CI:2.31~3.65,P<0.01)(图10)。敏感性分析显示,结果是稳定可靠的。试验组患者中性粒细胞减少、白细胞减少、贫血、血小板减少等血液学不良反应发生率分别为72.5%、39.9%、28.3%、24.4%,分别明显高于对照组患者的7.1%、5.0%、7.1%、2.8%,差异均有统计学意义(RR=11.71,95%CI:6.74~20.33,P<0.01;RR=8.91,95%CI:6.68~11.87,P<0.01;RR=3.92,95%CI:3.08~4.99,P<0.01;RR=10.33,95%CI:5.93~18.00,P<0.01)。
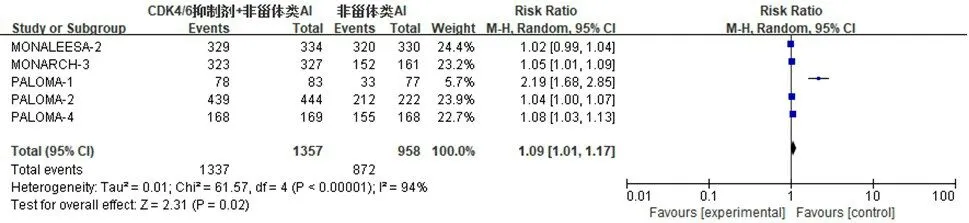
图9 HR+/HER2-晚期乳腺癌患者所有等级不良反应发生率的Meta分析森林图
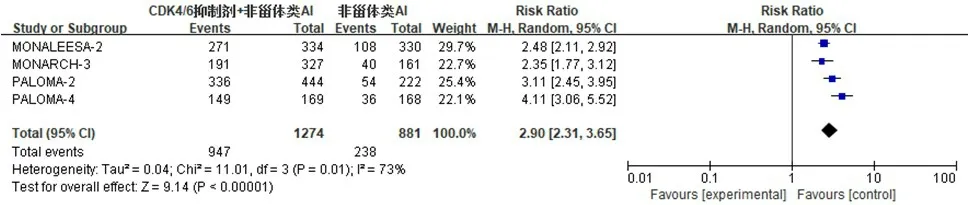
图10 HR+/HER2-晚期乳腺癌患者3~4级不良反应发生率的Meta分析森林图
2.4 发表偏倚
对mPFS、ORR、CBR 结果绘制漏斗图,并分别进行Egger’s 检验,未发现发表偏倚(P=0.464、0.631、0.464)。(图11)
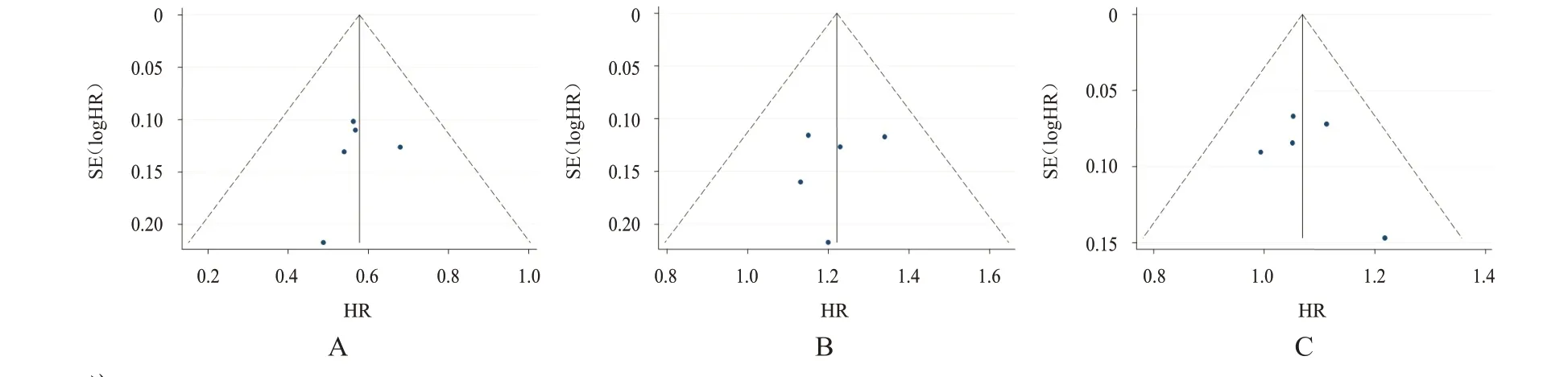
图11 HR+/HER2-晚期乳腺癌患者mPFS、ORR、CBR发表偏倚的漏斗图
3 讨论
CDK4/6 抑制剂联合内分泌治疗的主要机制是联合阻断CDK4/6 与雌激素受体(estrogen receptor,ER)通路,抑制细胞从G1期进入S 期,从而达到抑制肿瘤细胞生长的目的,该联合模式已成为临床上HR+晚期乳腺癌的标准治疗方案。目前的研究热点以瑞博西利、哌柏西利和阿贝西利联合他莫昔芬、第三代AI(来曲唑、阿那曲唑、依西美坦)和氟维司群为主。在生存时间方面,郑嘉铌[20]的荟萃分析纳入9 项研究共5043 例晚期乳腺癌患者,结果显示,与单纯内分泌治疗相比,CDK4/6 抑制剂联合内分泌治疗明显延长了患者的总生存期(overall survival,OS)(HR=0.76,95%CI:0.67~0.84,P<0.01)和PFS(HR=0.54,95%CI:0.50~0.58,P<0.01);Dai 等[21]对6 篇RCT 共3421 例乳腺癌患者的OS 和9 篇RCT 共4920 例乳腺癌患者的PFS 进行分析,结果显示,与单纯内分泌治疗相比,CDK4/6 抑制剂联合内分泌治疗明显延长了患者的OS(HR=0.76,95%CI:0.69~0.84,P<0.01)和PFS(HR=0.56,95%CI:0.52~0.60,P<0.01),同样的结论还见于Li等[22]、Piezzo等[23]、Lin等[24]和Schettini等[25]的研究中。与上述研究相比,本研究仅纳入了CDK4/6 抑制剂联合NSAI 治疗模式的RCT,得出的结论与上述研究一致,且亚组分析结果显示,试验组患者mPFS获益不受年龄、ECOG 体力状况评分、内脏转移或骨转移情况及是否曾接受化疗或内分泌治疗影响。
在疗效方面,秦泽敏[26]的研究结果显示,与单纯内分泌治疗相比,CDK4/6 抑制剂联合内分泌治疗明显提高了晚期乳腺癌患者的ORR(RR=1.67,95%CI:1.47~1.91,P<0.01),而CBR 比较,差异无统计学意义(RR=0.59,95%CI:0.75~1.19,P=0.64);在Dai 等[21]的研究中,与单纯内分泌治疗组患者相比,CDK4/6 抑制剂联合内分泌治疗组患者的ORR(RR=1.43,95%CI:1.27~1.62,P<0.01)和CBR(RR=1.24,95%CI:1.08~1.41,P<0.01)均明显较高;在Piezzo 等[23]的研究中,CDK4/6 抑制剂联合内分泌治疗组患者的ORR(RR=1.67,95%CI:1.47~1.91,P<0.01)和CBR(RR=0.59,95%CI:0.75~1.19,P<0.01)均明显高于单纯内分泌治疗组。本研究中,对所有入组患者的ORR 进行分析,结果显示,试验组患者的ORR 明显高于对照组(RR=1.31,95%CI:1.17~1.47,P<0.01);对具有可测量病灶患者的ORR 进行分析,结果显示,试验组患者的ORR明显高于对照组(RR=1.30,95%CI:1.17~1.45,P<0.01)。对所有入组患者的CBR 进行分析,结果显示,试验组患者的CBR 明显高于对照组(RR=1.13,95%CI:1.03~1.23,P<0.01);对具有可测量病灶患者的CBR 进行分析,结果显示,试验组患者的CBR明显高于对照组(RR=1.11,95%CI:1.05~1.18,P<0.01)。进一步说明CDK4/6 抑制剂联合NSAI 一线治疗绝经后HR+/HER2-晚期乳腺癌患者能够获得更好的临床效益。
在安全性方面,研究显示,CDK4/6 抑制剂联合内分泌治疗HR+/HER2-晚期乳腺癌的不良反应总发生率和3~4 级不良反应发生率均有不同程度的增加,以血液学不良反应为主,其次是消化系统不良反应[20-26]。本研究结果显示,试验组患者不良反应总发生率和3~4 级不良反应发生率均高于对照组,试验组患者表现出血液学不良反应较多,以中性粒细胞减少、白细胞减少、贫血和血小板减少较为常见。CDK4/6 抑制剂联合NSAI 在不良反应方面与CDK4/6 抑制剂联合内分泌治疗未表现出较大差别。Onesti 和Jerusalem[27]发现,不同类别CDK4/6 抑制剂的不良反应有所不同,哌柏西利和瑞博西利表现出较高的血液学毒性,主要是中性粒细胞减少;阿贝西利的消化道毒性较高,主要是1~2 级腹泻;另外,瑞博西利还具有较高的肝脏毒性、呼吸系统毒性且会造成QT 间期延长。相关研究表明,尽管CDK4/6 抑制剂联合内分泌治疗乳腺癌的不良反应发生率较单纯内分泌治疗高,但多为1~2 级,均在可耐受范围内且恢复较快,不影响患者的生活质量,且尚未见因严重不良反应导致治疗中断或患者死亡的报道[28-29]。
综上所述,CDK4/6 抑制剂联合NSAI 作为绝经后HR+/HER2-晚期乳腺癌的一线治疗方案,能够显著提高临床疗效,延长生存期,同时治疗期间需重点评估血液学不良反应,从而更好地发挥该治疗模式的临床优势。对于OS,未来仍需要更多样本量、更长时间随访获得更稳定的数据,为CDK4/6 抑制剂联合内分泌治疗乳腺癌提供更高级别的循证医学证据。

