多层螺旋CT、MRI 单独及联合检查对脑胶质瘤的诊断价值△
姚俊,李辉,赵卫鹏,冉纯杰
安康市中心医院影像中心,陕西安康 7250000
脑胶质瘤是临床常见的颅内恶性肿瘤,通常来源于神经元细胞与神经系统胶质细胞,属原发性肿瘤,占颅内肿瘤的40%~50%,可根据其细胞种类的不同分为少突胶质细胞瘤、星形细胞瘤、髓母细胞瘤、室管膜瘤等多种类型,脑胶质瘤的类型不同,其治疗方案及预后效果也各不相同[1-2]。确诊脑胶质瘤后,由于肿瘤不断扩大,患者颅内处于高压状态,可出现头痛、呕吐等症状,由于脑组织不断受到肿瘤压迫,可出现神经功能受损现象,严重威胁患者的生命安全[3]。临床通常采用手术或放化疗治疗脑胶质瘤,多根据患者自身的实际情况选择治疗方式,治疗效果较好,但不同类型的脑胶质瘤患者的预后也存在差异,因此,采用及时有效的方法明确诊断脑胶质瘤,对改善患者的预后有重要意义[4]。多层螺旋CT(multi-slice spiral CT,MSCT)是临床常用的诊断方法,可有效探查病变部位,并对严重程度进行诊断,但MSCT 无法清晰地显示脑胶质瘤的边界情况,且对部分脑胶质瘤的诊断不具有特异性,诊断效果欠佳[5]。MRI 具有分辨率高、无辐射的优点,扫描速度较快,可多方位成像,诊断价值较高[6]。本研究探讨MSCT、MRI 单独及联合检查对脑胶质瘤的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年5 月至2022 年5 月安康市中心医院收治的疑似脑胶质瘤患者。纳入标准:①经病理检查确诊为脑胶质瘤或脑部良性病变;②未合并先天性的颅内疾病;③均接受MSCT、MRI 检查;④病历资料完整。排除标准:①合并精神行为异常及认知功能障碍;②合并其他类型的恶性肿瘤;③存在MRI、CT 检查禁忌证。依据纳入和排除标准,本研究共纳入80 例疑似脑胶质瘤患者,其中男43 例,女37 例;年龄21~50 岁,平均(38.45±5.83)岁;病程1~38 个月,平均(19.31±3.42)个月;体重43~76 kg,平均(59.46±10.79)kg;病理结果:脑胶质瘤70 例,脑膜瘤8 例,脑脓肿2 例;脑胶质瘤病理类型:少突胶质细胞瘤11 例,星形细胞瘤22 例,髓母细胞瘤17 例,室管膜瘤20 例;脑胶质瘤分级:Ⅰ级36 例,Ⅱ级22 例,Ⅲ级12 例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 检查方法
所有患者首先接受MSCT 检查,检查前嘱患者禁食禁水4 h,患者取仰卧位,双手放置于头部上方,保持平稳呼吸,扫描参数:层厚10 mm,管电压120 kV,管电流150 mA,矩阵512×512,扫描速度0.5 s/r,旋转时间0.35 s,扫描时间5.92~9.07 s。采用高压注射器经肘静脉血管注射碘海醇注射液100 ml,注射速率3.5 ml/s,注射后行增强扫描,上传扫描数据至工作站进行处理,对原始图像进行薄层重建。随后再对所有患者进行MRI 扫描,将患者双臂放于身体两侧,采用相控阵表面线圈序列,进行矢状位、横断位、冠状位扫描,并进行自旋平面回波技术成像,扫描参数设置为层厚5 mm,层距1 mm,回波时间45 ms,重复时间6000 ms,视野220~320 mm,矩阵256×256,成像采集时间48 s,采集4 次,增强扫描使用高压注射器于肘静脉注射钆喷酸葡胺注射液,剂量为0.1~0.2 mmol/kg。
1.3 统计学方法
采用SPSS 24.0 软件对所有数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示;采用Kappa 检验进行一致性分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 影像特征
80 例疑似脑胶质瘤患者,经病理学检查确诊为阳性70 例(脑胶质瘤),阴性10 例(脑膜瘤8 例,脑脓肿2 例)。CT 平扫显示,胶质瘤主要表现为均匀或不均匀的低密度影,少数为混合影,其中30 例患者可见钙化影;MSCT 扫描显示,10 例星形细胞瘤患者未见明显强化,12 例星形细胞瘤患者明显强化且伴有不同程度的囊变液化坏死低密度区,5例呈花环状强化。MRI 平扫显示,胶质瘤实质部分主要表现为长T1、长T2信号;10 例患者累及8 个脑叶,10 例患者累及10 个脑叶,70 例患者均累及颞叶、额叶;MRI 增强扫描显示,脑胶质瘤以边缘强化和结节强化为主。
2.2 MSCT、MRI 单独及联合检查对脑胶质瘤的诊断价值
MSCT+MRI 检查诊断脑胶质瘤的结果与病理检查结果的一致性良好(Kappa=0.89),其诊断灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为97.14%、90.00%、96.25%、98.55%、81.82%,均高于二者单独检查。(表1、表2)
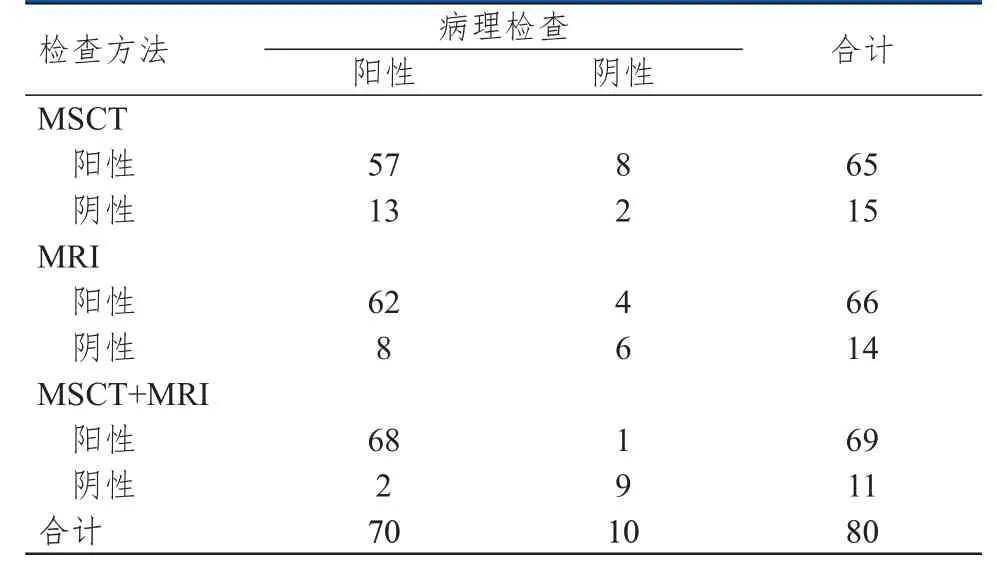
表1 MSCT、MRI 单独及联合检查诊断脑胶质瘤的结果与病理检查结果的对照
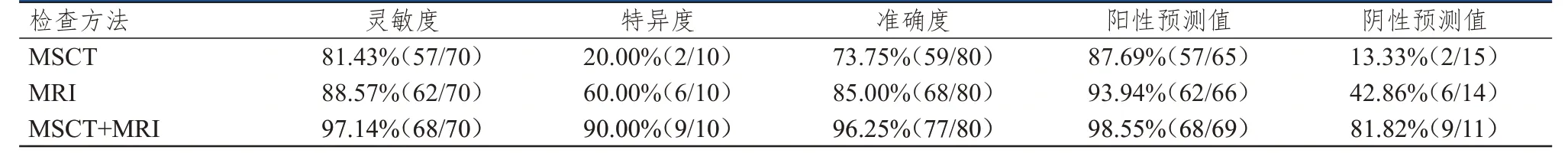
表2 MSCT、MRI 单独及联合检查对脑胶质瘤的诊断价值
2.3 MSCT、MRI 单独及联合检查对脑胶质瘤病理类型的检出情况
MSCT+MRI 检查对脑胶质瘤病理类型的总检出率为97.14%(68/70),高于二者单独检查的81.43%(57/70)和88.57%(62/70),其中MSCT+MRI 检查对少突胶质细胞瘤、星形细胞瘤、髓母细胞瘤、室管膜瘤的检出率均高于二者单独检查。(表3)
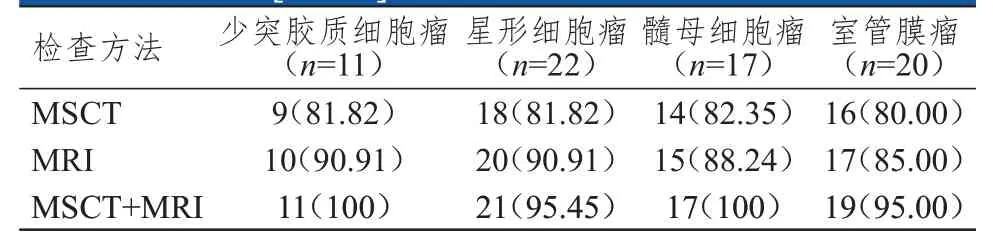
表3 MSCT、MRI 单独及联合检查对脑胶质瘤病理类型的检出情况[n(%)]
3 讨论
研究发现,脑胶质瘤好发于21~50 岁,31~40 岁为发病高峰期,且男性发病率高于女性[7]。统计数据显示,脑胶质瘤发病率为(3~8)/10 万,且不同病理类型脑胶质瘤发病率也不相同,其中以星形细胞瘤最常见,占所有病理类型的17.4%[8]。脑胶质瘤作为颅内常见的恶性肿瘤,患者的预后并不理想,且脑胶质瘤患者的5 年生存率不足5%,严重威胁患者的生命健康[9]。目前,影像学检查是诊断脑胶质瘤的重要方式,其检查结果对患者的手术治疗具有重要的参考价值,因此,影像学检查对脑胶质瘤的诊断及治疗有重要意义[10]。
MSCT 是临床常见的检查方式,该检查具有较强的定位显示作用,但对脑胶质瘤边界的显示效果欠佳,无法单纯用于脑胶质瘤的诊断,影像学参考价值欠佳[11]。随着影像学技术的发展,MRI 在脑部疾病诊断中的应用也越来越广泛,与MSCT 检查相比,MRI 检查对人体软组织的分辨率较高,且可进行多序列、多方位成像,具有较高的诊断价值[12]。脑胶质瘤是来源于神经外层的肿瘤,临床症状具有多样性,检查者可通过观察患者的临床症状,对肿瘤部位进行初步评估,为后续影像学检查提供参考[13]。临床诊断中,MSCT、MRI 检查均是常见的脑胶质瘤诊断方法,通常高级别脑胶质瘤的恶性程度较高,相较于低级别脑胶质瘤的强化程度更为明显,在MSCT 图像中呈花环状强化,是MSCT 检查较为典型的影像学表现;脑胶质瘤在MRI检查中以额叶、颞叶受累多见,肿瘤恶性程度较高者水肿程度较高,肿瘤边界较为模糊,注射造影剂后,不同级别脑胶质瘤的强化程度不一,高级别脑胶质瘤的边缘存在明显强化;MSCT+MRI检查可根据脑胶质瘤的病理特征及强化特点进行诊断[14]。
本研究结果显示,MSCT+MRI 检查对脑胶质瘤病理类型的总检出率为97.14%,高于二者单独检查的81.43%和88.57%,其中MSCT+MRI 检查对少突胶质细胞瘤、星形细胞瘤、髓母细胞瘤、室管膜瘤的检出率均高于二者单独检查,与龙春琴等[15]研究结果基本相符。这可能是因为脑胶质瘤的影像学表现通常具有多变性,多数恶性程度较低的脑胶质瘤边界较为清晰,采用MSCT 检查可清晰探查,且MRI 检查多以实性或囊性为主,由于MRI 可选择多个参数进行检查,对人体软组织具有较高的分辨率,图像清晰度较高,成像质量较好,能够提高脑胶质瘤的检出率。MSCT+MRI 检查通过对肿瘤位置及肿瘤性质进行诊断,有效提高了诊断效能[16]。
本研究结果显示,80 例疑似脑胶质瘤患者,经病理学检查确诊为脑胶质瘤70 例;MSCT+MRI 检查诊断脑胶质瘤的结果与病理检查结果的一致性良好(Kappa=0.89),与陈永汉等[17]的研究结果一致。这可能是因为MSCT 检查对脑胶质瘤边界的分辨率较差,常需与脑多发性瘤进行鉴别诊断,由于无法准确探查病变部位的肿瘤性质,存在一定的误诊现象;MRI 通过多序列扫描,在弥漫性生长的肿瘤的诊断中具有优势;MSCT+MRI 检查可有效判断脑胶质瘤的强化特征,探查病灶囊性坏死情况,判断病变范围,可有效降低临床误诊率[18]。
本研究结果显示,MSCT+MRI 检查诊断脑胶质瘤的灵敏度、特异度、准确度、阳性预测值、阴性预测值分别为97.14%、90.00%、96.25%、98.55%、81.82%,均高于二者单独检查,与李耀锋等[19]的研究结果基本相符。分析其原因可能在于:脑胶质瘤在MSCT 检查中表现为混杂密度或低密度的肿块,其肿瘤边界与脑质的分界较为模糊,且脑胶质瘤多伴有钙化或囊性坏死,患者病情较轻时,其颅内占位的效应相对较轻,强化程度较低甚至无强化;当患者颅内占位较为严重时,其强化较为明显,部分患者表现为囊中有瘤或瘤中有囊的现象,其本质区域的强化较为明显,囊壁则呈现出不同程度的强化。MRI 检查对人体软组织的分辨率较高,通过多方位、多序列扫描,评估肿瘤的恶性程度;MSCT+MRI 检查可有效分辨患者脑胶质瘤的病变位置与恶性程度,有效提高诊断准确度[20]。
综上所述,MSCT+MRI 检查对脑胶质瘤具有较高的诊断价值,能够帮助诊断脑胶质瘤的病理类型,为临床诊断及治疗提供参考。

