羌活根际土壤微生物群落结构特征及其对次生代谢产物的影响
王红兰 朱文涛 崔俊芳 杨萍 杜玖珍 孙辉 周毅 蒋舜媛
摘要[目的]科學评估羌活主产区土壤生态系统健康状况,揭示土壤微生物与羌活的互作关系。[方法]以羌活根际土壤为研究对象,分别采用高通量测序技术和高效液相色谱法(HPLC)测定土壤微生物群落结构组成和羌活次生代谢产物含量,进一步采用冗余分析和相关性分析方法研究根际土壤微生物对羌活次生代谢产物的影响。[结果]羌活根际土壤细菌优势门类群为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和拟杆菌门(Bacteroidetes),真菌优势门类群为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和球囊菌门(Glomeromycota)。属水平上,细菌优势属为Vicinamibacter(0.80%~9.11%)、土生单胞菌属Terrimonas(0.66%~7.72%)和硝化螺旋菌属Nitrospira(1.18%~4.46%);真菌优势属为被孢霉属Mortierella(0.01%~14.19%)、四孢菌属Tetracladium(0.18%~14.32%)和黄豆菌属Kotlabaca(0.01%~24.96%)。冗余分析表明羌活根际土壤微生物群落结构主要受土壤pH及养分含量影响,其中Colletotrichum和Botryichum与pH呈显著负相关(P<0.05),Bradyrhizobium与有机质亦呈显著负相关(P<0.05),Candidatus_Udaeobacter、Scutellospora和Enterocarpus均与速效磷和速效氮呈显著正相关(P<0.05)。羌活次生代谢产物羌活醇与毛壳菌属(Chaetomium)、丝盖伞属(Inocybe)和米拉珊瑚属(Melanophyllum)呈显著负相关(P<0.05),异欧前胡素则与毛壳菌属(Chaetomium)和腐质霉属(Humicola)呈显著正相关(P<0.05)。[结论]该研究结果为科学评估羌活主产区土壤生态系统健康状况和微生物-羌活互作关系提供数据支撑。
关键词羌活;根际土壤;微生物群落;结构特征;高通量测序;理化因子;次生代谢产物
中图分类号S 154.3文献标识码A文章编号0517-6611(2023)24-0173-06
doi:10.3969/j.issn.0517-6611.2023.24.039
Characteristics of Rhizosphere Soil Microbial Community Structure and Its Effects on Secondary Metabolites of Notopterygium incisum
WANG Honglan1, ZHU Wentao1, CUI Junfang2 et al
(1.Sichuan Academy of Chinese Medicine Sciences, Chengdu,Sichuan 610041;2. Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu,Sichuan 610299)
Abstract[Objective] To scientifically evaluate the health status of the soil ecosystem in the main production areas of N. incisum, and reveal the interaction relationship between soil microorganisms and N. incisum.[Method]Taking the rhizosphere soil of N. incisum as the research object, highthroughput sequencing technology and highperformance liquid chromatography (HPLC) were used to determine the composition of soil microbial community structure and the content of secondary metabolites of N. incisum. Furthermore, redundancy analysis and correlation analysis methods were used to study the impact of rhizosphere soil microbiota on secondary metabolites of N. incisum.[Result]The results showed that the dominant bacterial at the phylum level were Proteobacteria, Acidobacteria and Bacteroidetes, and the Ascomycota, Basidiomycota and Glomeromycota were identified as the dominant phyla of fungi. At the genus level, the dominant genera of soil bacteria were Vicinamibacter, Terrimonas and nitrospira, which accounted for 0.80%-9.11%, 0.66%-7.72% and 1.18%-4.462%, respectively. For fungi, the dominant genera were Mortierella, Tetracladium and Kotlabaca, which accounting for 0.01%-14.19%, 0.18%-14.32% and 0.01%-24.96%, respectively. Redundancy analysis showed that the microbial community structure of the rhizosphere soil of N. incisum was mainly affected by soil pH and nutrient content. Colletotrichum and Botryichum showed significant negative correlation with pH (P<0.05), while Bradyrhizobium also showed significant negative correlation with organic matter (P<0.05). Candidatus_ Udaeobate, Scutellospora and Enterocarpus were significantly positively correlated with available phosphorus and available nitrogen (P<0.05).The notopterol content were significantly negatively correlated with Chaetomium, Inocybe and Melanophyllum (P<0.05), respectively, while isoimperatorin content was significantly positively correlated with Chaetomium and Humicola (P<0.05), respectively. [Conclusion]The results of this study can provide data support for scientific assessment of soil ecosystem characteristics and microbialN. incisum interactions in the main N. incisum production area.
Key wordsNotopterygium incisum;Rhizosphere soil;Microbial community;Structural characteristics;Highthroughput sequencing;Physical and chemical factors;Secondary metabolites
羌活(Notopterygium incisum Ting ex H.T.Chang)是伞形科(Umbelliferae)羌活属(Notopterygium de Boiss.)多年生药用植物,是传统中藏羌医药体系常用大宗药材羌活(Notopterygii Rhizoma et Radix )最重要的基源植物[1]。羌活野生资源主要分布于川、陕、甘、青、藏等地,2010年以来四川甘孜、阿坝及甘肃宕昌等地开始人工栽培。目前有关羌活的研究多集中于种子种苗繁育[2-3]、集约化栽培技术[4-6]及药材化学品质[7]等方面,对密切影响羌活药材产量和品质的根际微生态系统鲜有报道。根际是地球上物质和能量循环、信息交换最活跃的界面之一,也是植物-微生物-土壤三者相互作用密切的一个复杂的生态系统[8]。根际微生物是联系植物群落与土壤养分循环的关键纽带[9],在向植物提供养分、增强养分的有效性、帮助植物转化吸收土壤养分等方面发挥巨大作用[10-11]。同时,根际微生物可通过多种方式促进药用植物的生长发育[12]和有效成分的合成积累[13],对提高药用植物的抗病虫害能力[14]、缓解连作障碍[8]和拮抗病原微生物[15-16]等具有重要的作用。因此,该研究以川西北羌活产区根际土壤为研究对象,采用PacBio单分子测序技术,结合16S rDNA和ITS全长测序测定微生物群落多样性和组成结构,阐明羌活根际土壤微生物群落结构特征,并对该时期土壤微生物多样性与土壤理化因子、羌活次生代谢产物含量进行相关性及冗余分析,揭示微生物對羌活次生代谢产物的影响,为科学评估羌活主产区土壤生态系统特征和微生物-羌活互作关系提供数据支撑。
1材料与方法
1.1研究地概况
选取羌活道地产区阿坝藏族羌族自治州境内4个较早开始人工栽培羌活的代表性研究地为研究对象,分别位于马尔康市、小金县、松潘县和黑水县境内。研究地的基本概况:①马尔康样地(MEK),位于马尔康市马尔康镇纳足村(102°27′23″E,31°30′28″N),属高原亚寒带气候,海拔2 960 m,年平均气温8~9 ℃,年降水量750 mm。②小金县样地(XJ),位于小金县两河口镇大板村(102°25′22″E,31°32′48″N),属高原亚温带气候,海拔3 263 m,年平均气温10 ℃,年降水量614 mm。③松潘县样地(SP),位于松潘县岷江乡北定关村(103°43′22″E,31°21′28″N),属青藏高原季风气候,海拔2 531 m,年平均气温7~8 ℃,年降水量730 mm。④黑水县样地(HS),位于黑水县沙石多镇杨柳秋村(102°48′18″E,32°06′09″N),属季风高原型气候,海拔2 771 m,年平均气温9 ℃,年降水量620 mm。
1.2植物和根际土壤样品采集
在4个研究区域,选取地形地貌相似、栽培管理措施相近的羌活种植地块,按“S”布点方式,分别设置10 m×10 m的样地,采集羌活植株和根际土壤样本。将羌活植株连根系整体取出,轻轻抖动去除根围土壤,将根及根表附着的土壤作为根际土壤。利用无菌毛刷采集根部附着紧密的土壤,混合3个植株的根际土壤样本,作为1个根际土壤样本,以等量混合均匀地装入2 mL 冻存管;收集用于次生代谢产物含量检测的羌活地下部分;另取0~30 cm分散土样(约1 kg)用于土壤理化性质的测定。每个研究地块根际土样重复3次(MEK1、MEK2、MEK3、XJ1、XJ2、XJ3、SP1、SP2、SP3、HS1、HS2、HS3),分散土样及植物样重复9次。样品采集时间为2021年10月。
1.3样品预处理和保存
于60 ℃烘干羌活地下部分,磨成粉末状(过3号筛)后放入真空干燥箱内待用。在-80 ℃超低温冰箱中保存根际土壤样本,用于微生物多样性的检测。将土样分散自然风干,除去碎石、根系等杂物,经碾磨后过2 mm 筛测定土壤pH、全氮含量、全磷含量、全钾含量、速效氮含量、速效磷含量和速效钾含量,过0.125 mm筛后测定土壤有机质含量。
1.4根际土壤理化性质常规分析
土壤酸碱度用酸碱度测定仪(土水比1∶10)测定;土壤有机质含量按重铬酸钾氧化容量法测定;采用硫酸加速剂消解-凯氏法测定全氮含量;采用氢氧化钠熔融钼锑抗比色法测定全磷含量;全钾含量采用熔焰光度法(将氢氧化钠熔化)进行测定;采用碱解扩散法测定速效氮含量;速效磷含量的测定采用0.5 mol/L碳酸氢钠浸提-钼锑抗比色法;速效钾含量采用NH4OAC浸出法-火焰光度法测定。上述检测方法参考《土壤农化分析(第3版)》[17]。
1.5根际土壤微生物群落结构分析
取0.25 g土壤样品,用试剂盒(PowerSoil DNA Isolation kit)提取土壤总DNA,通过细菌16S rRNA V1~V9区全长引物27F(5′-AGRGTTTGATYNTGGCTCAG-3′)、1492R(5′-TASGGHTACCTTGTTASGACTT-3′),真菌ITS rRNA 全长引物ITS1(5′-CTTGGTCATTTAGAGGAAGTAA-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)分别进行引增合成。再用电泳检测,检测后提纯,提纯后用Qubit定量PCR产物,等量混样后按PCR浓度进行高通量顺序。
对原始下机的Sub-reads进行校正得到CCS序列,通过Barcode序列识别不同样本的CCS序列并去除嵌合体,得到高质量的CCS序列,利用Cutadapt v2.7(错误率0.2)识别正向引物和反向引物,抛弃不含引物的CCS序列,过滤CCS长度,将序列聚类在相似度97%的水平上,以测序所有序列的0.005%作为阈值,过滤OTU。利用Usearch软件在97%的相似度水平上聚类Tags,获取OTU,并基于Silva(细菌)和Unite(真菌)分类数据库对OTU进行分类注释。
1.6羌活次生代谢产物分析
精密称定0.400 g 粉末置锥形瓶内,精密加入5 mL甲醇,称定质量,超声处理(250 W,50 kHz)30 min,冷却后称定质量,用甲醇将减损质量补足,摇匀,滤净,连续滤液。参考《中国药典》方法采用高效液相色谱测定羌活醇和异欧前胡素的含量,试验条件为Durashell C18 色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈-水(44∶56),检测波长 310 nm。
1.7数据处理
利用CANOCO 5.0软件对土壤细菌和真菌群落多样性数据与对应的土壤理化因子数据进行RDA分析,其相对丰度设置为前20属水平;数据整理和统计分析分别采用Excel 2010和SPSS 22.0软件,显著性水平设为0.05;图形处理采用Adobe Illustrator CS5、Excel 2010软件。
2结果与分析
2.1根际土壤微生物群落结构测序结果
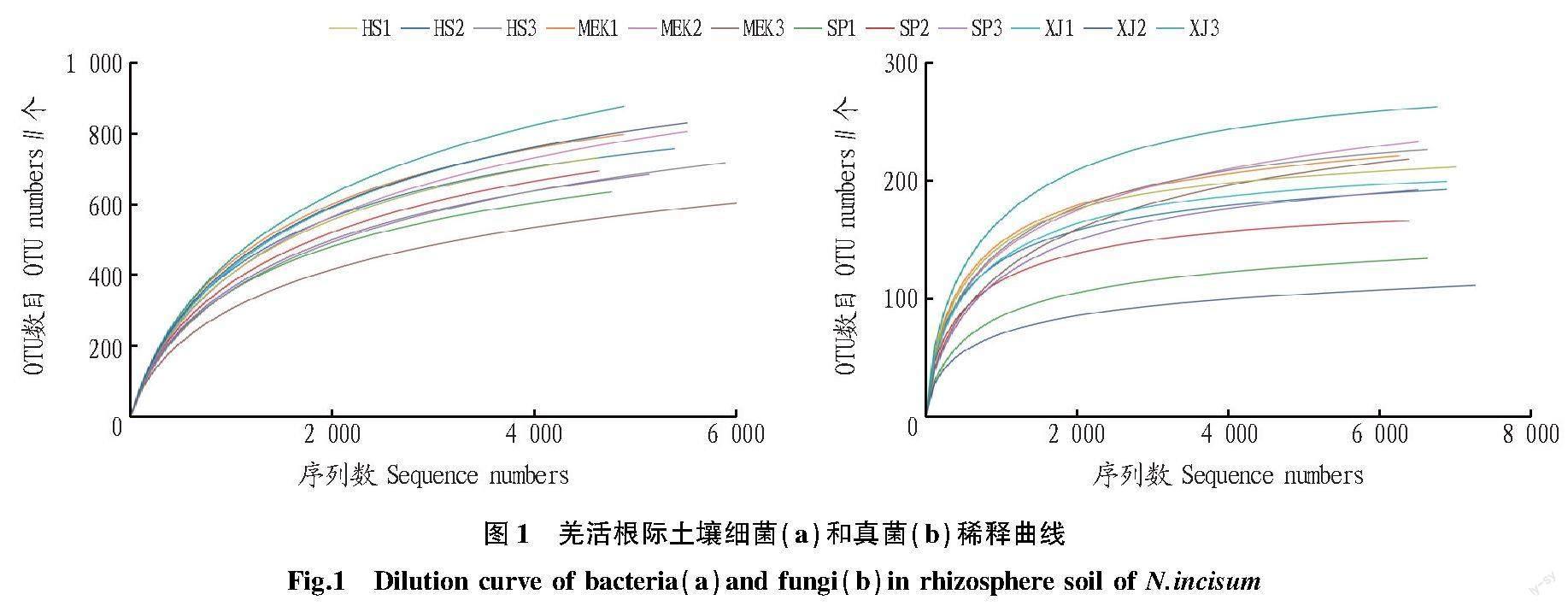
该研究共获得细菌序列89 457条CCS,每个样品平均产生7 544条CCS;获得真菌序列90 034条CCS,每个样品平均产生7 503条CCS。经过质量过滤和去除嵌合体后,平均每个样本产生7 384条细菌优质CCS,有效率为98%;平均每个样本产生7 455条真菌优质CCS,有效率为99%。稀释曲线(图1)分析表明,当细菌测序量达到4 000、真菌测序量达到3 000时,曲线逐渐趋于平缓,表明测序深度足够大,所得到的数据量可对各样本中的物种和分类信息进行综合全面反应。
2.2细菌和真菌群落的丰富性与多样性分析
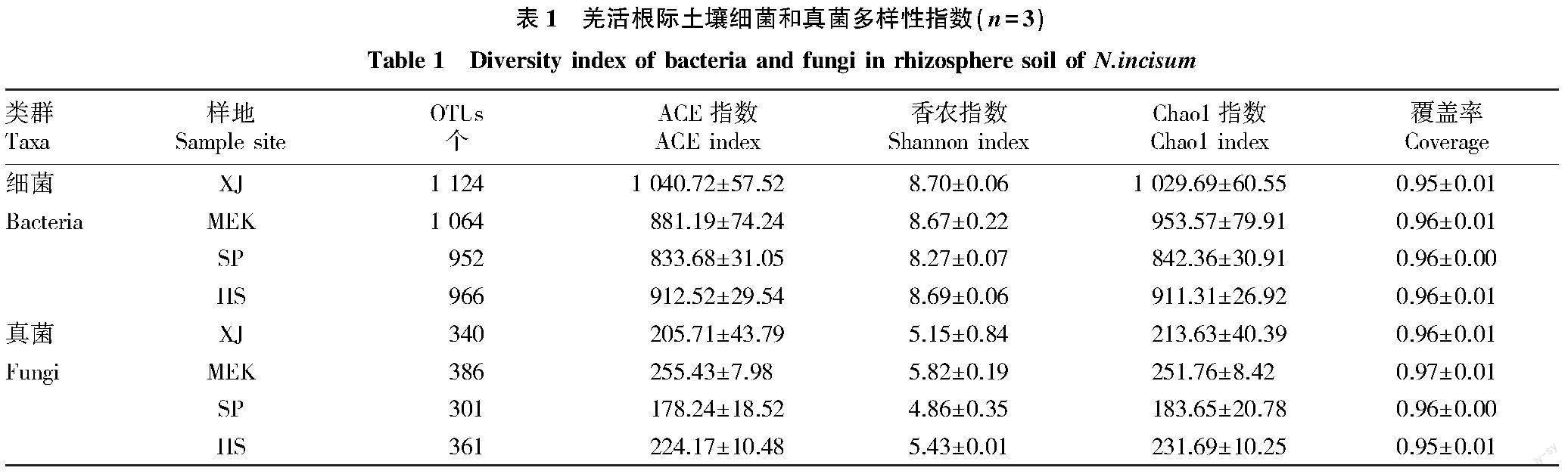
川西北地区羌活根际土壤细菌和真菌多样性指数统计分析结果(表1)表明,细菌OTUs数目平均值为1 026.5个,真菌OTUs数目平均值为347.0个;细菌和真菌的ACE指数平均值分别为917.03 和215.89,香农指数平均值分别为8.58和5.32,Chao1指数平均值分别为934.23和220.18。由此表明,土壤微生物群落结构在羌活根际比较丰富。
2.3细菌和真菌群落组成分析
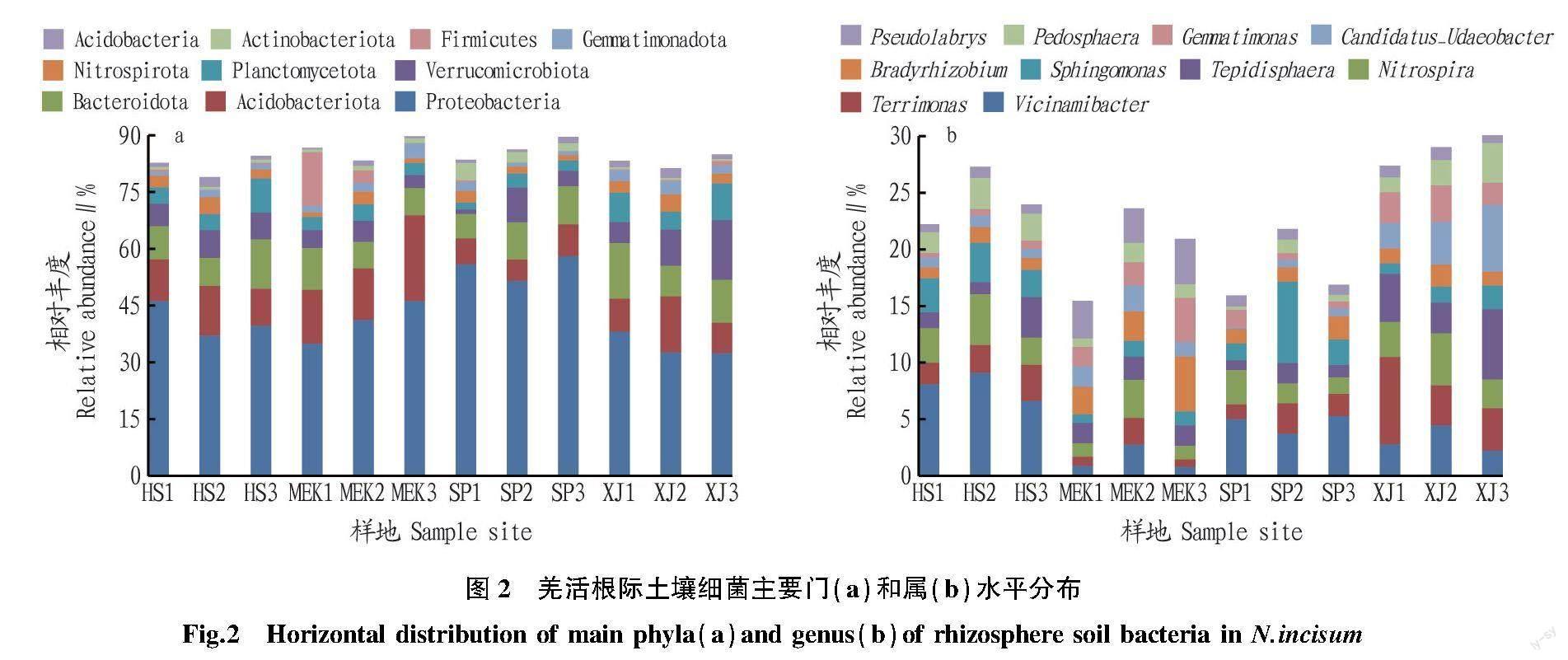
姜活根际土壤细菌主要门和属水平的物种分布情况如图2所示。由图2可知,羌活根际土壤细菌门类群主要为变形菌门(Proteobacteria,37.10%~61.92%)、酸杆菌门(Acidobacteria,7.15%~23.07%)、拟杆菌门(Bacteroidota,6.95%~14.89%)、疣微菌门(Verrucomicrobiota,1.33%~15.36%)、浮霉菌门(Planctomycetota,1.89%~11.51%)、芽单胞菌门(Gemmatimonadota,2.54%~5.96%)、硝化螺旋菌门(Nitrospirota,1.08%~4.42%)、Acidobacteriota(0.43%~4.42%)、放線菌门(Actinobacteriota,0.50%~4.72%),厚壁菌门(Firmicutes,0.05%~12.40%);羌活根际土壤优势菌属水平的菌群主要为Vicinamibacter(0.80%~9.11%)、土生单胞菌属(Terrimonas,0.66%~7.72%)、硝化螺旋菌属(Nitrospira,1.18%~4.46%)、芽单胞菌属(Gemmatimonas,0.86%~6.17%)、鞘氨醇单胞菌属(Sphingomonas,0.74%~7.19%)、缓生根瘤菌属(Bradyrhizobium,0.98%~4.85%)、Candidatus_Udaeobacter(0.15%~5.91%)、Tepidisphaera(0.38%~3.92%)、Pedosphaera(0.29%~3.51%)、Pseudolabrys(0.67%~4.00%),其中Vicinamibacter、土生单胞菌属、硝化螺旋菌属丰度占前三位。
姜活根际土壤真菌主要门和属水平物种分布情况如图3所示,真菌门的类群主要是子囊菌门(Ascomycota,34.42%~67.81%)、担子菌门(Basidiomycota,8.93%~50.52%)、球囊菌门(Glomeromycota,1.07%~28.31%)、丝孢菌门(Mortierellomycota,0.51%~14.5%)、轮孢菌门(Rozellomycota,0.49%~18.81%)、壶菌门(Chytridiomycota,0.26%~7.20%)、油壶菌门(Olpidiomycota,0.03%~0.12%)和芽枝霉门(Blastocladiomycota,0.093%)。经鉴定,在属水平上具有优势的真菌(图3b)主要有被孢霉属(Mortierella,0.01%~14.19%)、四孢菌属(Tetracladium,0.18%~14.32%)、黄豆菌属(Kotlabaea,0.01%~24.96%)、肠果菌属(Enterocarpus,0.06%~17.26%)、Plectosphaerella(0.01%~15.11%)、Coprinellus(0~21.79%)、毛葡孢属(Botryotrichum,0~10.44%)、镰刀菌属(Fusarium,0.31%~4.679%)、盾孢囊霉属(Scutellospora,0~9.42%)、炭疽菌属(Colletotrichum,0~16.81%)。
2.4根际土壤微生物群落与土壤因子的冗余分析
从川西北地区羌活根际土壤理化性质特征(表2)可以看出,土壤pH在 6.62~7.09,表明羌活适宜在中性土壤中生长。土壤有机质含量在21.81~25.34 g/kg,按照全国第二次土壤普查营养成分分级标准,该区域有机质含量可达三级水平,说明有机质含量较高。土壤全氮、全磷和全钾含量分别为1.90、0.60和15.26 g/kg;速效氮、速效磷和速效钾含量分别为35.11、18.00 和53.86 mg/kg,表明该区耕作层土壤养分含量处于中等水平。
从土壤细菌和真菌群落多样性与对应的土壤理化因子的RDA分析结果(图4)可以看出,速效磷(AP)、全氮(TN)、速效氮(AN)、速效钾(AK)等养分因子影响了羌活根际土壤细菌群落结构;其中速效磷、速效氮和速效钾均与Candidatus_Udaeobacter呈显著正相关,全氮与Sphingomonas呈显著负相关,有机质(SOM)与Bradyrhizobium呈显著负相关。土壤pH和养分因子对羌活根际土壤真菌类群影响均较大;其中土壤pH与Colletotrichum和Botryichum呈显著负相关,全氮(TN)、全磷(TP)和速效钾(AK)均与Fusarium呈显著负相关;速效磷(AP)和速效氮(AN)均与Scutellospora和Enterocarpus呈显著正相关。由此表明,羌活根际土壤微生物群落结构与土壤pH和养分含量之间存在着密切的联系。
2.5根际土壤微生物群落与羌活次生代谢产物的关联性分析
4年生家种羌活地下部分羌活醇含量为4.29~7.93 mg/g,异欧前胡素含量为1.84~5.43 mg/g(表3)。羌活醇和异欧前胡素总含量最高可达12.92 mg/g(1.292%),远高于药典标准(0.14%),表明羌活移栽4年后其特征成分含量远高于商品药材标准。
羌活次生代谢产物与根际土壤微生物菌群的相关分析见表4。羌活醇与uncultured_bacterium_C_Subgroup_5、毛壳菌属(Chaetomium)、丝盖伞属(Inocybe)、米拉珊瑚属(Melanophyllum)均呈显著负相关;异欧前胡素与uncultured_bacterium_C_Subgroup_5、uncultured_bacterium_F_Pedosphaeraceae、毛壳菌属(Chaetomium)呈显著正相关,与uncultured_bacterium_O_Rokubacteriales、腐质霉属(Humicola)呈极显著正相关,与uncultured_bacterium_C_Alphaproteobcteria呈极显著负相关。由此可见,羌活次生代谢产物的积累与根际土壤微生物群落结构有密切的联系。
3讨论
药用植物根际微生物中的细菌具有很高的类群多样性,主要类群有芽孢杆菌属、假单胞菌属、黄杆菌属、固氮菌属、根瘤菌属,其中最常见的是芽孢杆菌属和假单胞菌属[4]。有报道指出,当归根际土壤优势细菌属主要有芽孢杆菌属、假单胞菌属、固氮菌属和硝化菌属等[18],人参根际土壤优势细菌属为假单胞菌属[19],附子的优势细菌属为Lactoccus、Pseudolabrys、Bradyrhizobium、Rhodanobacter、Pseudonocardia等[20]。该研究结果发现羌活根际土壤优势细菌属为Vicinamibacter、土生单胞菌属(Terrimonas)、硝化螺旋菌属(Nitrospira)、芽单胞菌属(Gemmatimonas)和鞘氨醇單胞菌属(Sphingomonas)等。这些优势菌属的功能主要是促进土壤养分的转化速率和提高植物的抗逆能力[21]。其中土生单胞菌属和鞘氨醇单胞菌属中的部分细菌不仅能够降解土壤中除草剂、农药等有机污染物,还可以固定大气中的氮供植物利用[22],促进土壤氮循环。这可能是导致羌活栽培区土壤速效氮含量较低(35.11 mg/kg,按全国第二次土壤普查养分分级标准处于五级水平)的原因之一。
对土壤真菌而言,西洋参根际土壤的优势属为丝核菌属(Rhizoctonia)、腐皮镰刀菌属(Fusariumsolani)和Phytophthoracactorum[23],而人参的优势属有毛霉菌属、根霉菌属、青霉菌属、镰刀菌属和木霉菌属等[24]。该研究结果发现,羌活根际土壤中优势真菌属为被孢霉属(Mortierella)、四孢菌属(Tetracladium)、黄豆菌属(Kotlabaea)、肠果菌属(Enterocarpus)、Plectosphaerella、Coprinellus、毛葡孢属(Botryotrichum)、镰刀菌属(Fusarium)、盾孢囊霉属(Scutellospora)和炭疽菌属(Colletotrichum)等。研究表明,镰刀菌属真菌是导致人参[19]、太子参[25]和黄连[26]等根茎类药材发生根腐病的主要致病菌。该研究发现,羌活根际土壤中大量存在被孢霉属、镰刀菌属和炭疽菌属等致病真菌。据田间试验观察,羌活移栽3年后少量植株会出现根腐病,随着种植年限的延长,根腐病发生频率增加,大量定殖于羌活根际土壤的被孢霉属、镰刀菌属和炭疽菌属可能是引发羌活发生根腐病的主要致病真菌。下一步可收集羌活根腐病植株样本进行致病性测定,明确其病原真菌,探究其致病因子及病原菌与羌活互作机制,有效修复羌活根际土壤生态环境以防止羌活野生变家种过程中发生大规模土传病害。
药用植物根际土壤微生物群落结构易受土壤pH、有机质和营养元素含量等土壤基本理化因子的影响[27]。王钰等[26]研究发现,黄连根际土壤细菌群落结构与pH呈显著负相关,与速效氮磷钾及有机质含量呈显著正相关,表明根际土壤理化因子可通过影响植物根系生命活动从而影响土壤微生物学性质。该研究RDA分析结果发现羌活根际土壤微生物群落结构与土壤pH、速效氮磷钾及有机质含量呈显著相关关系。可能是因为土壤pH是影响土壤养分转化和有效性的主要因素之一[24],它可以通过调节土壤有机质的可溶性来调节土壤微生物的分解、运移土壤有机质和养分元素,从而影响土壤微生物群落结构和多样性。
根际微生物通过对药用植物中相关基因的表达进行调控,调控次生代谢物的合成,进而影响次生代谢物的积累[1]。研究表明,板蓝根根际显著富集的伯克霍尔德菌 (Burkholderia sp.)可促进有效物质靛蓝的积累[28],假单胞菌和泛菌(Pantoea sp.)对丹参中酚类物质迷迭香酸、丹酚酸 B 的积累具有显著促进作用[29]。该研究结果发现毛壳菌属(Chaetomium)与羌活醇呈显著负相关(P<0.05),而与异欧前胡素呈显著正相关(P<0.05),说明毛壳菌属可促进异欧前胡素的积累,而抑制羌活醇的积累。但有关根际微生物如毛壳菌属如何调控羌活有效成分羌活醇和异欧前胡素的积累与合成尚不清楚,下一步可结合多种组学方法开展相关研究,如蛋白组学和转录组学等。
4结论
该研究通过测定川西北羌活主产区根际土壤微生物群落结构、理化性质及羌活次生代谢产物含量,并进行冗余分析和相关性分析,得到如下基本结论:①羌活根际土壤微生物多样及物种丰富,细菌以Vicinamibacter、土生单胞菌属(Terrimonas)和硝化螺旋菌属(Nitrospira)为优势属,真菌以被孢霉属(Mortierella)、四孢菌属(Tetracladium)和黄豆菌属(Kotlabaea)为优势属。②羌活根际土壤微生物易受土壤pH及养分含量的调控,与土壤pH和速效氮磷钾及有机质含量呈显著相关关系。③根际土壤微生物显著影响羌活次生代谢产物羌活醇和異欧前胡素的积累。
参考文献
[1] 国家药典委员会.中华人民共和国药典:2020年版 一部[S].北京:中国医药科技出版社,2020:183-184.
[2] LI A H,JIANG S Y,YANG G,et al.Molecular mechanism of seed dormancy release induced by fluridone compared with cod stratification in Notopterygium incisum[J].BMC plant biology,2018,18(1):1-11.
[3] 李爱花,蒋舜媛,郭娜,等.中药植物羌活种子休眠解除的代谢组分析[J].中国农业科技导报,2021,23(5):44-51.
[4] 杨萍,王红兰,孙辉,等.野生抚育下羌活根状茎生长特性与品质相关性研究[J].中国中药杂志,2020,45(4):739-745.
[5] 尹青岗,熊超,王晓蓉,等.羌活无公害规范化栽培体系研究[J].中药材,2019,42(3):698-703.
[6] 王红兰,杨萍,孙辉,等.羌活野生和栽培产地土壤水力学性质的对比研究[J].中国中药杂志,2020,45(16):3805-3811.
[7] ZHENG X K,WEN R,LIU Y N,et al.Nitric oxide inhibitory phenolic constituents isolated from the roots and rhizomes of Notopterygium incisum[J].Bioorganic chemistery,2022,128:1-11.
[8] 祝蕾,严辉,刘培,等.药用植物根际微生物对其品质形成的影响及其作用机制的研究进展[J].中草药,2021,52(13):4064-4073.
[9] 丛微,喻海茫,于晶晶,等.人参种植对林地土壤细菌群落结构和代谢功能的影响[J].生态学报,2021,41(1):162-171.
[10] 朱永官,彭静静,韦中,等.土壤微生物组与土壤健康[J].中国科学:生命科学,2021,51(1):1-11.
[11] 彭政,郭秀芝,徐扬,等.药用植物与根际微生物互作的研究进展与展望[J].中国中药杂志,2020,45(9):2023-2030.
[12] 张海珠,李杨,张彦如,等.菌根真菌处理下滇重楼对营养元素的吸收和积累[J].环境化学,2019,38(3):615-625.
[13] XIE Z C,CHU Y K,ZHANG W J,et al.Bacillus pumilus alleviates drought stress and increases metabolite accumulation in Glycyrrhiza uralensis Fisch.[J].Environmental and experimental botany,2019,158:99-106.
[14] ZHOU N,MEI C M,ZHU X Y,et al.Research progress of rhizosphere microorganisms in Fritillaria L.medicinal plants[J].Front bioeng biotechnology,2022,10:1-12.
[15] 吴红淼,张晟恺,焦艳阳,等.微生物菌肥对太子参连作障碍和药理作用的改良效应[J].中国生态农业学报,2021,29(8):1315-1326.
[16] SHENG M M,JIA H K,ZHANG G Y,et al.Siderophore production by rhizosphere biological control bacteria Brevibacillus brevis GZDF3 of Pinellia ternata and its antifungal effects on Candida albicans[J].Journal of microbiol biotechnol,2020,30(5):689-699.
[17] 鲍士旦.土壤农化分析[M].3版.北京:中国农业出版社,2000.
[18] 姜小凤,郭凤霞,陈垣,等.种植模式对当归根际细菌群落多样性及代谢通路的影响[J].应用生态学报,2021,32(12):4254-4262.
[19] 王勇,何舒,熊冰杰,等.不同栽培模式对人参根际土壤微生物多样性的影响研究[J].中草药,2021,52(17):5303-5310.
[20] 刘世鹏,韦洁敏,李智,等.连作对附子根际土壤微生物群落结构的影响[J].中国微生态学杂志,2020,32(5):520-526.
[21] 蒋靖怡,王铁霖,池秀莲,等.基于高通量测序的紫花丹参与白花丹参根际细菌群落结构研究[J].中国中药杂志,2019,44(8):1545-1551.
[22] 王琪,王红兰,孙辉,等.蚕豆间作对羌活次生代谢产物及根际土壤微生物多样性的影响[J].中国中药杂志,2022,47(10):2597-2604.
[23] CHEN G Z,XUE Y,YU X,et al.The structure and function of microbial community in rhizospheric soil of American ginseng(Panax quinquefolius L.)changed with planting years[J].Current microbiology,2022,79(9):1-13.
[24] FANG X X,WANG H Y,ZHAO L,et al.Diversity and structure of the rhizosphere microbial communities of wild and cultivated ginseng[J].BMC microbiology,2022,22(1):1-12.
[25] 高慧芳,許佳音,孟婷,等.太子参根际土壤微生物多样性及其与土壤主要理化因子的相关性[J].福建农业学报,2021,36(3):345-357.
[26] 王钰,潘媛,伍晓丽,等.不同种植模式下黄连根际土壤理化特性及细菌群落结构变化[J].中国中药杂志,2021,46(3):582-590.
[27] 曹宏杰,王立民,徐明怡,等.五大连池新期火山熔岩台地不同植被类型土壤微生物群落的功能多样性[J].生态学报,2019,39(21):7927-7931.
[28] ZENG M J,ZHONG Y J,CAI S J,et al.Deciphering the bacterial composition in the rhizosphere of Baphicacanthus cusia(NeeS)Bremek [J].Scientific reports,2018,8(1):1-11.
[29] YOU H,YANG S J,ZHANG L,et al.Promotion of phenolic compounds production in Salvia miltiorrhiza hairy roots by six strains of rhizosphere bacteria [J].Engineering in life sciences,2018,18(3):160-168.

