MLR 联合FT3 对HBV 相关慢加急性肝衰竭患者生存状况的预测效果
何 萌 王 丽
新乡市第二人民医院检验科(河南新乡 453000)
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)是指合并慢性肝病的患者随病情进展而出现的急性肝功能恶化,伴随器官功能衰竭和短期高病死率等临床特征,预后较差[1]。其中乙型肝炎病毒(hepatitis B virus,HBV)相关ACLF为我国主要的ACLF类型,短期病死率较高,目前肝移植为临床中仅有的有效治疗方案,因此积极评估和预测患者的预后对临床治疗有重要价值[2]。目前常用的评估HBV-ACLF患者预后的方法需要基于多个脏器功能,评估的准确度和便捷性受限[3]。单核细胞-淋巴细胞比率(monocyte lymphocyte ratio,MLR)在肝细胞癌评估中与临床常用的监测指标NLR有相似的预测性能,为人体免疫系统的重要细胞功能指标,考虑NLR在临床中已有较多相关研究,本研究对MLR的预测效果进行了评估[4-5]。同时考虑甲状腺激素的合成、代谢、排出等过程与肝脏相关,肝细胞受损时会对甲状腺激素水平产生影响[6],本研究对血清游离三碘甲腺原氨酸(free triiodothyronine,FT3)水平进行监测,以评估甲状腺激素水平与ACLF患者预后的相关性。同时为提高临床指标的预测效能,本研究将MLR与FT3联合应用,分析其对HBV-ACLF患者生存状况的预测效果,现报道如下。
1 资料与方法
1.1 一般资料
纳入我院在2019年1月—2022年1月期间收治的HBV-ACLF患者共187例进行研究,其中男153例、女34例,年龄为34~69岁,平均(46.15±5.97)岁。本研究方案已通过医院伦理委员会审核(伦理批件号:201901006),且所有患者均签署知情同意书。
1.2 HBV-ACLF诊断标准
血清HBsAg阳性,且符合《肝衰竭诊治指南(2018)》[7]中相关标准。
1.3 纳入标准
①确诊为HBV-ACLF;②年龄≥18周岁;③各项资料均完整。
1.4 排除标准
①合并其他肝炎病毒感染;②妊娠期或哺乳期;③存在肝脏或肝外肿瘤;④合并垂体、呼吸衰竭、甲状腺疾病;⑤既往有3个月以上的抗凝、抗病毒、免疫抑制治疗史。
1.5 研究指标
对187例HBV-ACLF患者的资料进行回顾性分析,包括年龄、性别、肝硬化、原发性腹膜炎、肺部感染、肝肾综合征、上消化道出血、电解质紊乱、终末期肝病模型(model for end stage liver disease,MELD)、单核细胞-淋巴细胞比率(monocyte lymphocyte ratio,MLR)、中性粒细胞与淋巴细胞计数比值(neutrophil to lymphocyte ratio,NLR)、国际标准化比值(international normalized ratio,INR)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、白蛋白(albumin,Alb)、甲胎蛋白(alpha fetal protein,AFP)、肌酐(creatinine,Cr)、Na、白细胞计数(white blood cell count,WBC)、总胆红素(total bilirubin,TBIL)、FT3、血清胆固醇、总血清胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、乙肝病毒脱氧核糖核酸(hepatitis B virus deoxyribonucleic acid,HBV DNA)、恩替卡韦/替诺福韦。
1.6 随访及分组
随访患者90 d的生存状况,其中69例死亡患者设为死亡组,其余118例存活患者设为存活组。其中各血清学指标均为入院第1天时的检测结果。
1.7 统计学方法
2 结 果
2.1 2组各项资料的单因素分析
死亡组患者的大部分的指标(约20个)均异于存活组,差异均有统计学意义(P<0.05),仅性别、肺部感染比例、Alb水平、TG、HBV DNA及用药情况(恩替卡韦/替诺福韦),差异无统计学意义。见表1。
2.2 HBV-ACLF患者死亡的影响因素分析—多因素Logistic回归
分析设计:建立非条件Logistic回归模型,以本研究资料为样本,以HBV-ACLF患者死亡预后为因变量,赋值:死亡=1,存活=0。从上述单因素分析(表1)中P<0.05的指标/因素中选择自变量。自变量选择原则/方法如下:(1)强共线的指标仅选择其一,如ALT、AST仅选择前者,MLR、NLR、INR亦选择前者;(2)所有指标均进行降维转化,如连续性指标按中位数转化成两分类变量(≥中位数=1,<中位数=0);(3)部分临床症状和当时病情有关,处理后已纠正或缓解的,不考虑纳为自变量(如原发性腹膜炎、电解质紊乱等)。回归过程采用逐步后退法(α退=0.10,α进=0.05)。
回归结果:见表3。包括M L R ≥0.6 0、FT3≤2.50 pmol/L在内的7个因素均为HBV-ACLF患者死亡的影响因素(P<0.05)。其中MLR是危险影响因素(OR>1),FT3是保护因素(OR<1.0)。见表2和表3。
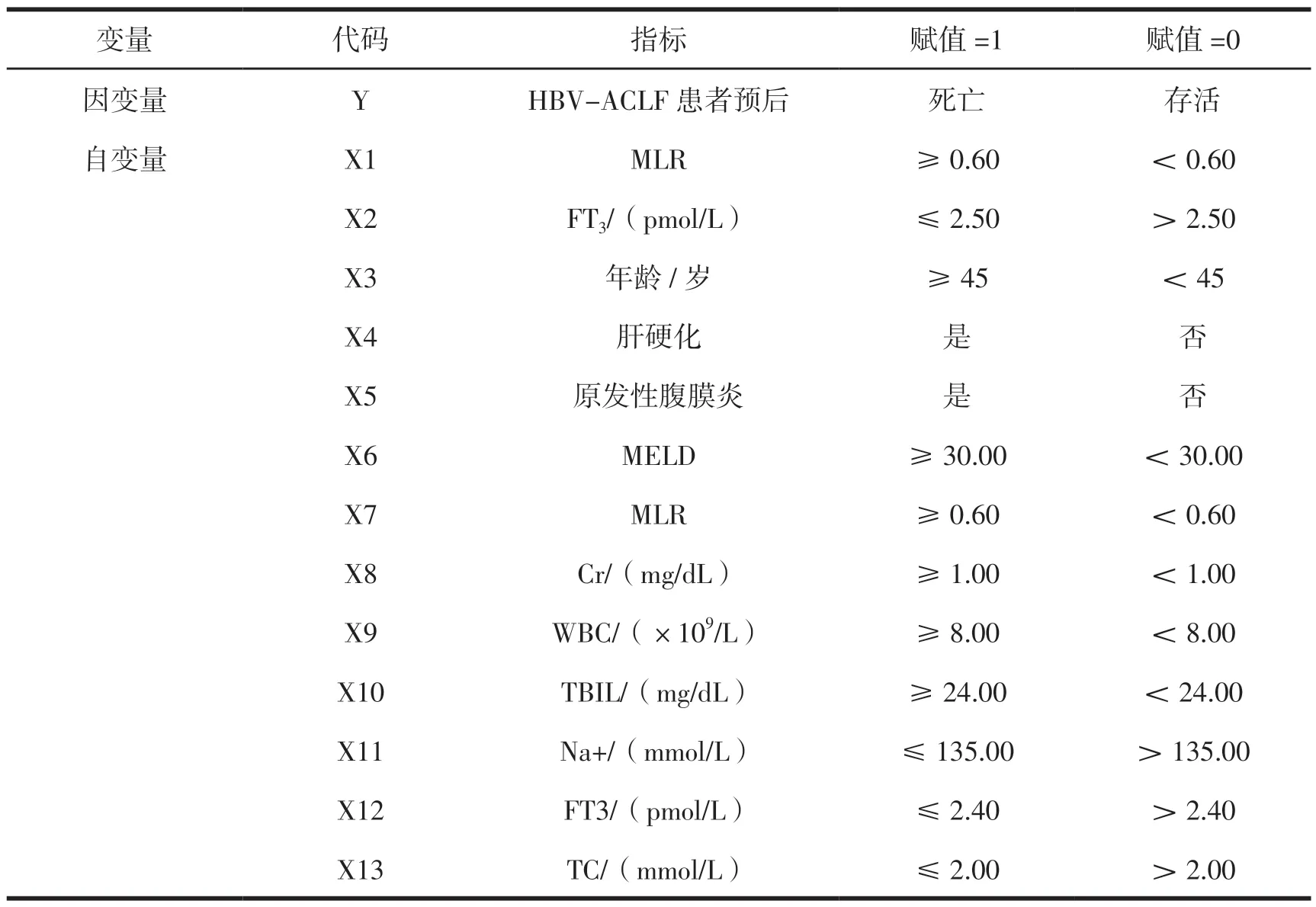
表2 回归哑变量设计/赋值
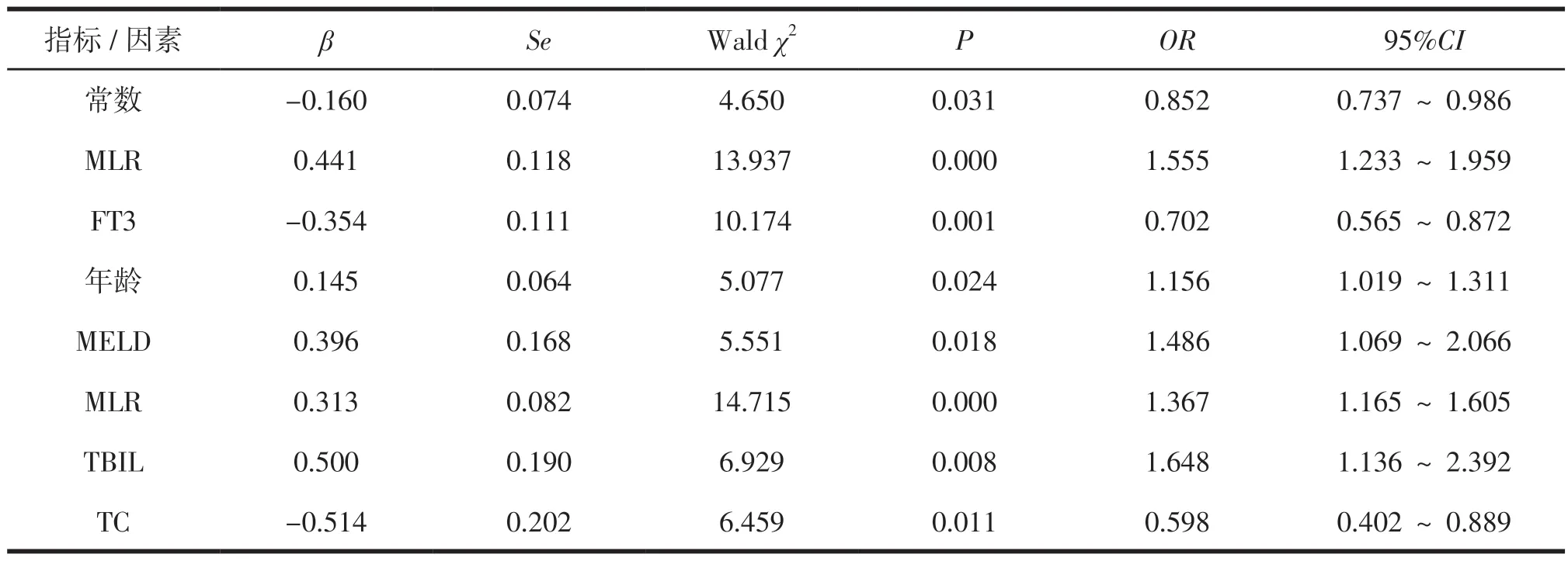
表3 2组各项资料的Logistic多因素分析
2.3 MLR联合FT3对HBV-ACLF死亡的预测效能
进一步探讨MLR、FT3两指标对HBV-ACLF死亡的预测效能,以死亡组(n=69)为阳性样本,以存活组(n=118)为阴性样本,进行ROC分析。
(1)单独应用(MLR、FT3):各样本的两指标值分别输入至ROC分析软件,以软件拟合之ROC曲线计算曲线下面积AUC及95%置信区间,并按实测样本计算敏感度、特异度、准确度。
(2)联合应用(LogP模式,MLR+FT3):径以上述Logistic回归结果,建立风险评估/预测模型,以其Ln(P/1-P)=0.441×MLR -0.354×FT3为联合应用的虚拟概率量指标,再行ROC分析。
分析结果显示:MLR、FT3两指标单独及联合应用(MLR+FT3)时,对HBV-ACLF死亡的预测效能:ROC-AUC(0.95CI)分别为0.680(0.395~0.944)、0.730(0.484~0.966)、0.871(0.810~0.928),显见联合应用诊断效能很高,AUC及灵敏度、特异度、准确度均较各单独应用指标有明显提升。见表4和图1。
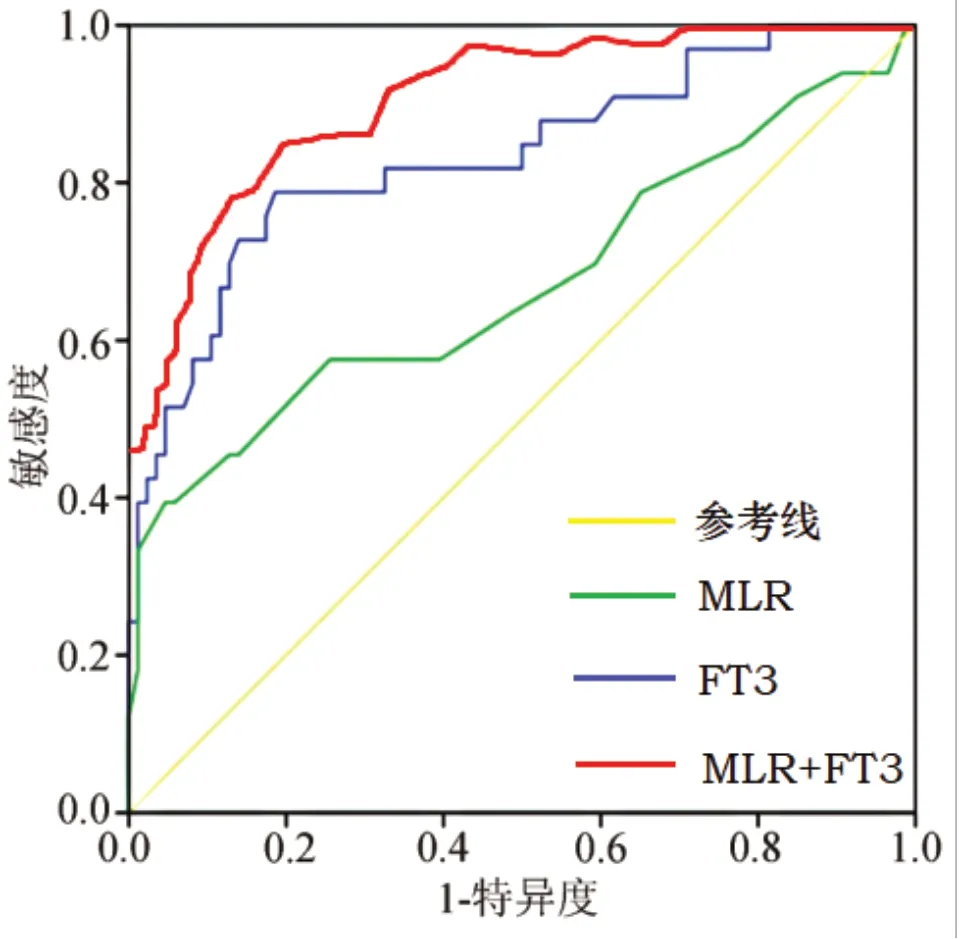
图1 MLR 联合FT3 对HBV-ACLF 死亡预测的ROC 曲线

表4 MLR联合FT3对HBV-ACLF死亡的预测效果
3 讨 论
ACLF是急性、亚急性和慢性肝衰竭等患者常见的疾病类型,其短期病死率较高,预后较差[8]。虽然近年来肝脏移植手术和人工肝等技术的不断进步,但因肝源短缺、手术费用昂贵、血源受限等因素的影响,ACLF患者的病死率仍然居高不下[9]。因此临床研究学者对于ACLF患者,尤其是我国多发的HBV-ACLF患者的发病机制、诊断方法、治疗方法、预后影响因素等展开了大量的研究[10-11]。但是目前临床对于患者生存状况的预测指标仍然较少,现存的预测方法也会受到多种因素限制而准确率较低,因此本研究积极探究了HBV-ACLF患者生存状况的预测指标,并展开了分析。
在本研究中对187例HBV-ACLF患者展开了分析,结果显示MLR≥0.60、FT3≤2.50 pmol/L均为HBV-ACLF患者死亡的危险因素(P<0.05)。单核细胞为机体免疫系统中的重要组分,其在内源性炎症过程中发挥调控作用,例如单核细胞及其衍生的巨噬细胞在动脉粥样硬化等心血管疾病的发生、发展中均有促进作用,单核细胞可促进巨噬细胞、炎性树突状细胞等分化产生促炎性细胞因子等,这些物质可进一步促进心血管疾病的发生和发展[12-13]。因此外周血单核细胞水平升高提示机体存在较强的炎症反应,多发心血管疾病,目前临床中也将单核细胞表型调节作为预防和治疗心血管疾病的新方向[14]。同时临床中已经明确淋巴细胞数量减少会增大不良心脏事件的发生率。因此MLR将上述两种独立炎症标志物相结合能够获取较多的累加信息,可有效预测HBVACLF患者机体的炎症反应情况,进而预测患者的生存状况,评估其肝移植需求的紧迫性,为临床治疗提供参考。进一步分析FT3与HBV-ACLF患者生存状况的相关性,发现FT3水平较低的患者死亡率较高,可能是由于该类患者病情相对较重,肝功能受损严重,此时肝细胞内甲状腺素无法在肝细胞内转移为总三碘甲状腺原氨酸,进而影响了血清FT3水平[15-16];同时肝衰竭时患者的ALB合成降低,会造成甲状腺激素结合能力降低,进一步降低FT3水平,因此FT3水平降低的患者生存率较低[17-18]。进一步探究结果显示 MLR、FT3、MLR+FT3对HBV-ACLF患者死亡均有一定的预测价值,但MLR+FT3的预测价值高于其他单项预测。提示两种指标联合应用的临床预测价值较高,且该两项指标可简单获取,费用低,能够被患者所接受,具有较佳的临床应用价值。
但本研究尚存一定局限性,文中所采用的回顾性观察研究法所纳入的病例数量相对较少,今后可进一步通过前瞻性研究方法,纳入更多样本量行多中心研究,以探究MLR和FT3与HBV-ACLF患者死亡的关系和作用机制。
综上所述,MLR≥0.60、FT3≤2.50 pmol/L均为HBV-ACLF患者死亡的危险因素,且二者联合应用对HBV-ACLF患者死亡有较佳的预测价值。

