狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
刘深云, 王佳丽, 袁星光, 王彩蝶, 涂婉钧, 周雯润, 李红亮, 吴 帆
(中国计量大学生命科学学院, 浙江省生物计量及检疫检验重点实验室, 杭州 310018)
狄斯瓦螨Varroadestructor是蜜蜂的一种外寄生螨,依靠吸食蜜蜂蛹和成虫的脂肪体和血淋巴生存繁殖,这导致蜜蜂体质衰弱和发育不良(Ramseyetal., 2019)。同时,狄斯瓦螨还携带有多种病毒,使蜜蜂出现残翅和畸形等症状,致使蜂群变弱直至崩溃消亡(Wilfertetal., 2016)。目前,狄斯瓦螨已成为全球养蜂业威胁最大的蜜蜂病虫害之一(Traynoretal., 2020)。狄斯瓦螨整个生活周期都依赖于宿主蜜蜂,寄生过程包括繁殖期(reproductive phase)和携播期(phoretic phase)两个阶段,繁殖期寄生于封盖巢房内的幼虫和蛹,携播期寄生于工蜂的胸部和腹部等(Zakaretal., 2014)。所以,宿主化学物质和外界环境的变化对狄斯瓦螨生活史有重要影响。研究表明,狄斯瓦螨可以感知化学物质、光和温度等因素的细微变化,但并没有证据表明狄斯瓦螨对光和温度等的感知能力与宿主定位和寄生有关(Rosenkranzetal., 2010; Smolińskietal., 2021)。比如温度,蜂箱内正常温度维持在34.5~35.0 ℃,但狄斯瓦螨偏好的温度却是32.5~33.4 ℃(秦瑶等, 2018)。所以,宿主自身的化学物质对调节狄斯瓦螨寄生、繁殖和产卵等行为却有重要的影响。法国研究者Le Conte等(1989)在意大利蜜蜂Apismelliferaligustica雄蜂幼虫提取物中鉴定出10种酯类物质,称为幼虫酯类信息素(brood ester pheromone, BEP),行为观察实验中这些酯类物质对狄斯瓦螨有吸引作用,且昆虫触角电位仪(electroantennography, EAG)实验也表明狄斯瓦螨对这些化学物质有反应(Light et al., 2020)。随后,他们又发现这些酯类物质的含量在不同日龄幼虫以及同日龄的工蜂幼虫和雄蜂幼虫之间有差异(Slessoretal., 2005),这可能是狄斯瓦螨对不同幼虫选择寄生的原因之一。由于这种长链脂肪酸的酯类物质沸点高而挥发性低,很难远距离发挥作用,且研究者在Y型嗅觉仪的引诱实验中没有观察到狄斯瓦螨对这些酯类的偏好性选择(Pernaletal., 2005)。Maisonnasse等(2009)和Pinnelli等(2016)利用固相微萃取(solid-phase microextraction, SPME)和气相色谱-质谱联用(gas chromatography-Mass spectrometer, GC-MS)在幼虫中鉴定到一种挥发性成分——β-罗勒烯,发现它在狄斯瓦螨寄生的幼虫和非寄生的幼虫中含量不同,且电生理反应表明狄斯瓦螨对其有反应。目前,对于狄斯瓦螨如何识别幼虫酯类信息素或β-罗勒烯的作用机理还不清楚。
化学感受是自然界中最原始和最早出现的感受方式之一,而基于嗅觉系统的化学识别又是节肢动物门普遍存在的化学感受方式(Leal, 2013)。研究者已经确定有多种蛋白参与这个过程,其中气味结合蛋白(odorant-binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)和尼曼-匹克C2型蛋白(Niemann-Pick type C2 proteins, NPC2)等是化学感受系统的第1个参与者,负责结合和转运气味或信息素分子通过淋巴液到达受体蛋白(Leal, 2013; 吴帆等, 2021)。早期,Iovinella等(2018)通过蛋白质组技术在狄斯瓦螨嗅觉相关的器官中(包括前足和口器等组织)鉴定到了几个NPC2蛋白,而这些NPC2与幼虫化学物质结合作用的相关研究还未见报道。本研究通过克隆狄斯瓦螨VdesNPC2b,以pET-30a载体构建原核表达体系,诱导VdesNPC2b重组蛋白表达;然后通过荧光竞争结合实验检测VdesNPC2b与主要蜜蜂幼虫信息素油酸甲酯和β-罗勒烯的结合力,并利用变温实验分析VdesNPC2与油酸甲酯和β-罗勒烯结合机制;最后,利用同源建模和分子对接模拟分别初步分析VdesNPC2b与β-罗勒烯结合时的结构和关键氨基酸。本研究对于了解狄斯瓦螨的寄生机制和生物防治具有重要意义。
1 材料与方法
1.1 主要材料和试剂
狄斯瓦螨由福建农林大学动物科学学院提供,从意大利蜜蜂工蜂幼虫的巢房中抓取,取样时间为2020年8月份,加入200 μL RNAlater,投入液氮速冻后于-70 ℃冰箱保存。RNAlater试剂和SDS-PAGE凝胶试剂盒购买于碧云天,RNAqueous®-Micro Kit微量总RNA提取试剂盒购于Ambion公司,反转录试剂盒PrimeScript Reverse Transcriptase System、凝胶回收试剂盒和质粒提取试剂盒、pMD18-T载体、以及实验中所用限制性内切酶均购自TaKaRa公司,Ni2+琼脂糖柱购买于北京全式金生物公司,大肠杆菌EscherichiacoliDH5α、BL21(DE3)感受态细胞和pET-30a表达载体为本实验室自备,氨苄青霉素(ampicillin)、卡那霉素(kanamycin)和甲醇等化学试剂均购自上海生工公司,1-NPN(纯度>97%)购买于梯希爱(TCI)公司,蜜蜂幼虫信息素化合物油酸甲酯(纯度>99%)和β-罗勒烯(纯度>90%)购买于Sigma-aldrich。
1.2 总RNA提取及cDNA合成
利用RNAqueous®-Micro Kit试剂盒提取狄斯瓦螨总RNA,然后用PrimeScript Reverse Transcriptase System试剂盒合成cDNA第1链。
1.3 狄斯瓦螨VdesNPC2b基因克隆和序列分析
基于狄斯瓦螨基因组测序结果(NCBI参考序列号: XM_022793576.1)设计扩增VdesNPC2b开放读码框(open reading frame, ORF)的引物,并在正反向引物中分别引入BamH Ⅰ和Hind Ⅲ限制酶切位点(下划线标识),正向引物NPC2b-F:5′-GGATCCATGCTTAGATTTGTCATGCTGGCT-3′;反向引物NPC2b-R:5′-AAGCTTCTATTCGTCATCCTCTTGATT GTCT-3′。以1.2节cDNA为模板扩增目的基因,PCR反应体系: 2×EasyTaq PCR SuperMix 25 μL, 正反向引物(10 μmol/L)各1.5 μL, cDNA模板2 μL, ddH2O 20 μL。PCR反应程序: 95 ℃预变性3 min; 95 ℃变性30 s, 59 ℃退火30 s, 72 ℃延伸1 min, 35个循环;最后72 ℃延伸10 min。产物经1.5%琼脂糖凝胶电泳,回收目的片段并与pMD18-T连接构建克隆载体,菌液PCR鉴定阳性克隆后送去测序。测序结果经Editseq软件分析,获得VdesNPC2bORF,并预测氨基酸序列。然后利用BLASTX软件(http:∥blsat.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性比对,利用MegAlign比对以及MEGA5.0软件的邻接(neighbor-joining)法构建系统进化树,使用在线信号肽软件SignalP 6.0 Server(http:∥www.cbs.dtu.dk/services/SignalP)预测信号肽序列。
1.4 狄斯瓦螨VdesNPC2b重组蛋白与纯化
分析确定信号肽后设计引物用于表达不含信号肽重组蛋白。正向引物pNPC2b-F:5′-GGATCCGG AGAACTCTACAAGGTCCA-3′;反向引物pNPC2b-R:5′-AAGCTTCTATTCGTCATCCTCTTGATTG-3′。提取重组pMD18-T质粒进行BamHⅠ和HindⅢ酶切,回收产物连接至pET-30a,连接产物全部转化至大肠杆菌DH5α感受态细胞中,测序验证后将重组质粒转入BL21(DE3)感受态细胞中。以1∶100(v/v)将含pET-30a/VdesNPC2b质粒的BL21(DE3)细菌接种至200 mL LB培养基中,37 ℃ 220 r/min培养至OD600达0.8时加入终浓度为1 mmol/L的IPTG,在30 ℃ 200 r/min条件诱导培养5 h。收集菌液进行裂解,超声破碎后离心分上清和沉淀,通过12%聚丙烯酰胺凝胶电泳检测。确定表达后利用Ni2+琼脂糖柱(全式金ProteinIso Ni-NTA Resin)纯化,具体方法见操作说明,利用含有8 mol/L尿素的PBS进行复性和透析,然后用BCA试剂盒(全式金Easy Ⅱ Protein Quantitative Kit)配制标准溶液,用酶标仪(瑞士TECAN Genios)测定蛋白浓度。
1.5 荧光竞争结合实验
以1-NPN作为VdesNPC2b与配基结合特性研究的竞争性荧光报告子,用1-NPN进行连续滴定,记录蛋白荧光发射光谱,直至蛋白最大荧光值猝灭终止。然后依据竞争结合实验研究VdesNPC2b与油酸甲酯和β-罗勒烯结合力。首先把能使蛋白峰值完全猝灭的1-NPN量加入到浓度为1 μmol/L VdesNPC2b蛋白中,然后将甲醇配制的浓度为10 mmol/L的油酸甲酯和β-罗勒烯滴定蛋白,记录荧光发射光谱和最大荧光值。根据下列方程计算配基解离常数(KD值):KD=[IC50]/(1+[1-NPN] K1-NPN)。公式中[IC50]为替换50%的1-NPN时的候选配基浓度,[1-NPN]是反应平衡时混合物中游离的1-NPN浓度,K1-NPN为VdesNPC2b与1-NPN结合时的解离常数。
1.6 VdesNPC2b与油酸甲酯和β-罗勒烯的结合机制分析
为分析VdesNPC2b与油酸甲酯和β-罗勒烯相互作用机制,本研究通过荧光光谱变温试验测试22和32 ℃下油酸甲酯和β-罗勒烯对1 μmol/L VdesNPC2b荧光猝灭变化,分析油酸甲酯和β-罗勒烯的猝灭机制。荧光猝灭方式包括动态和静态猝灭,分析方程为:F0/F=1+Kqτ0[Q]=1+KSV[Q],公式中F0和F分别为配基加入前后体系的荧光强度;Kq为荧光猝灭速率常数;τ0为无配基时荧光分子的平均寿命;[Q]为配基的浓度;KSV为双分子猝灭过程常数。若结合过程为动态猝灭,则KSV随温度升高而增大;若结合过程为静态猝灭,则KSV随温度升高将减小(Atrahimovichetal., 2012)。双对数方程:lgF0-F/F=lgKA+nlg[Q],公式中F0, F和[Q]的含义与猝灭方程相同,KA是表观结合常数。配基与蛋白之间的相互作用力可以通过变温实验计算得来的吉布斯自由能(ΔG)、焓变(ΔH)、熵变(ΔS)的能量变化反应。维持稳态的作用力主要是氢键、范德华力、静电力、疏水作用力等,热力学关系为:ΔG=-RTlnK=ΔH-TΔS,ΔH=RT1T2ln(K0,2/K0,1)T2-T1,ΔS=-(ΔH-ΔG)/T。其中R为气体常数,T为热力学温度(T1为相对低温,T2为相对高温), K为结合常数。ΔG, ΔH和ΔS可以反映蛋白与小分子之间的主要作用力。当ΔH<0,ΔS>0时,维持二者主要作用力为疏水作用和静电作用;当ΔH<0,ΔS<0时,维持二者的主要作用力表为氢键和范德华力;当ΔH>0,ΔS>0,维持二者稳态的作用力为疏水作用(Zhangetal., 2023)。
1.7 同源建模和分子对接模拟
利用在线软件SWISS-MODLE(http:∥swissmodel.expasy.org/)分析比对,预测VdesNPC2b蛋白结构。在NCBI的Pubchem Compound数据库中找到β-罗勒烯(CID_5281553)三维结构,把预测的蛋白结构和β-罗勒烯输入到MVD软件中,进行分子对接模拟。通过复合物能量、是否形成氢键及其强弱和不同氨基酸供能等方面分析,找到VdesNPC2b与β-罗勒烯结合模型及可能关键氨基酸。
2 结果
2.1 狄斯瓦螨VdesNPC2b序列
克隆获得狄斯瓦螨VdesNPC2b(GenBank登录号: OR463903)的531 bp ORF全长序列,编码176个氨基酸,蛋白分子量约为19.54 kD,等电点约为4.56, 其中强酸性氨基酸(谷氨酸和天冬氨酸) 26个,强碱性氨基酸(精氨酸和赖氨酸)16个。VdesNPC2b蛋白有信号肽,信号肽切割位置位于N端第16和17位氨基酸(YA-GE)之间。VdesNPC2b二级结构主要为β折叠,在此基础上形成具有结合腔的高级结构。
序列比对表明VdesNPC2b序列与梅氏热厉螨Tropilaelapsmercedesae附睾分泌蛋白E1(GenBank登录号: OQR78448.1)、巴氏新小绥螨NeoseiulusbarkeriNPC2-3(GenBank登录号: QWT69288.1)、西方盲走螨GalendromusoccidentalisNPC2(GenBank登录号: XP003748537.1)等蛋白的氨基酸序列一致性超过50%(分别为74.17%, 52.30%和52.00%)而聚在一起,与阿根廷蚂蚁LinepithemahumileNPC2(XP012215342.1)和大腹圆蛛AraneusventricosusNPC2(GenBank登录号: GBM63140.1)等多种蛛形纲(Arachnida)或昆虫纲(Insecta)物种相关蛋白氨基酸序列一致性在30%左右(图1)。
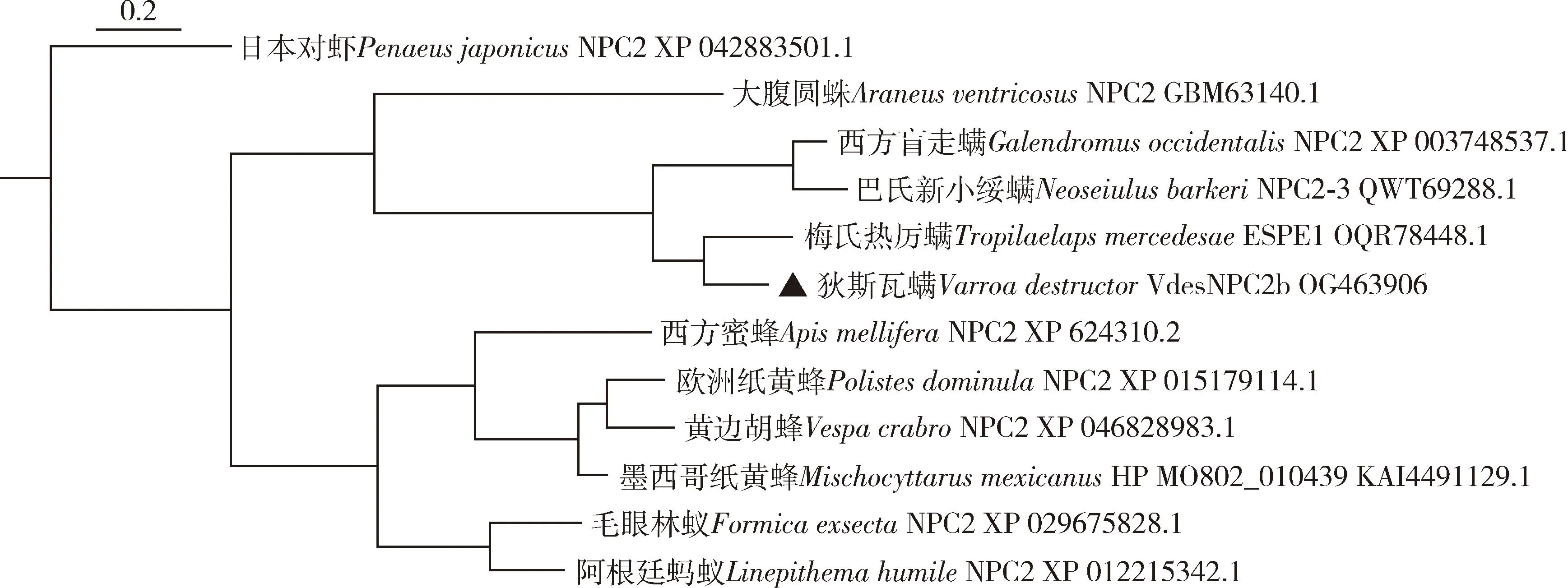
图1 邻接法构建的基于氨基酸序列的狄斯瓦螨VdesNPC2b和其他物种同源蛋白系统进化树
2.2 VdesNPC2b蛋白表达及配基结合
成功表达VdesNPC2b重组蛋白,其以上清形式表达,经镍柱纯化后用含梯度尿素的PBS透析,获得目的蛋白(图2)。1-NPN滴定结果表明,其与VdesNPC2b蛋白较好,K1-NPN值为2.06 μmol/L(图3: A),可以作为配基结合力分析的荧光报告子。荧光竞争结合分析结果显示,VdesNPC2b与油酸甲酯和β-罗勒烯的KD值分别为2.89和3.49 μmol/L(图3: B)。
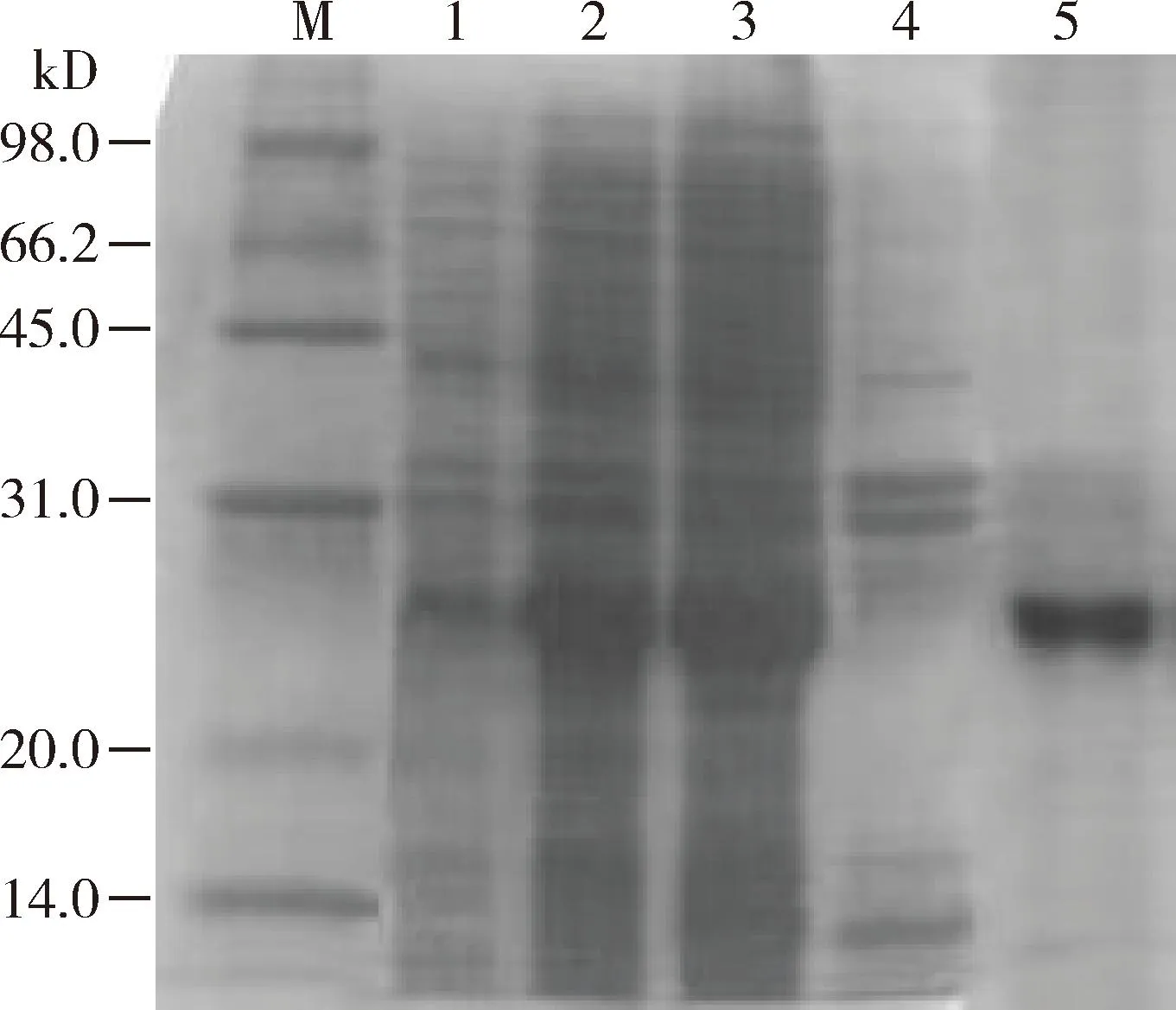
图2 VdesNPC2b重组蛋白诱导表达及纯化

图3 VdesNPC2b重组蛋白与1-NPN(A)和油酸甲酯和β-罗勒烯(B)竞争结合曲线
2.3 VdesNPC2b与油酸甲酯和β-罗勒烯的结合机制
在22和32 ℃两个不同温度下, 油酸甲酯和β-罗勒烯滴定VdesNPC2b的荧光值均发生规律性变化。Stern-Volmer方程显示,当温度上升时,油酸甲酯和β-罗勒烯猝灭VdesNPC2b的斜率Ksv升高(图4),表明两者结合过程为动态猝灭,其他参数见表1。
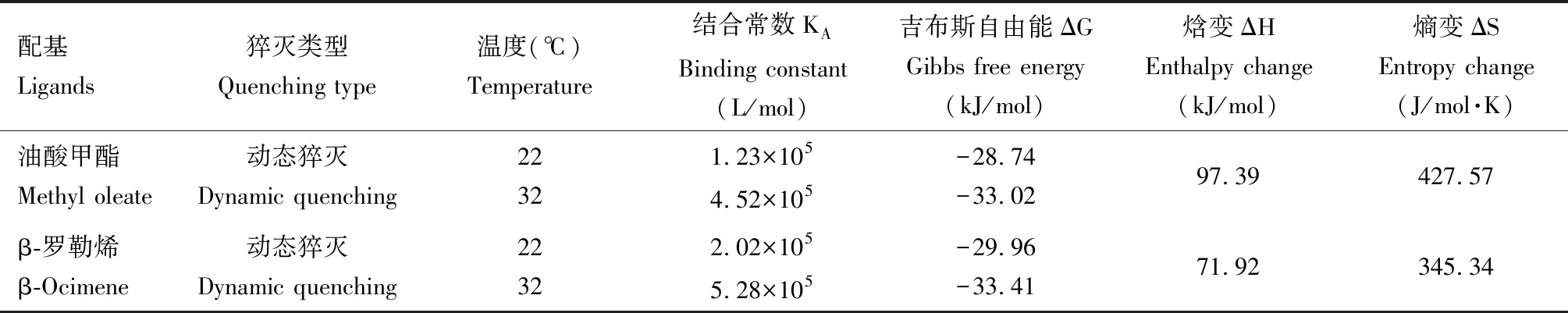
表1 22和32 ℃温度下VdesNPC2b与油酸甲酯和β-罗勒烯的结合常数(KA)和热力学参数
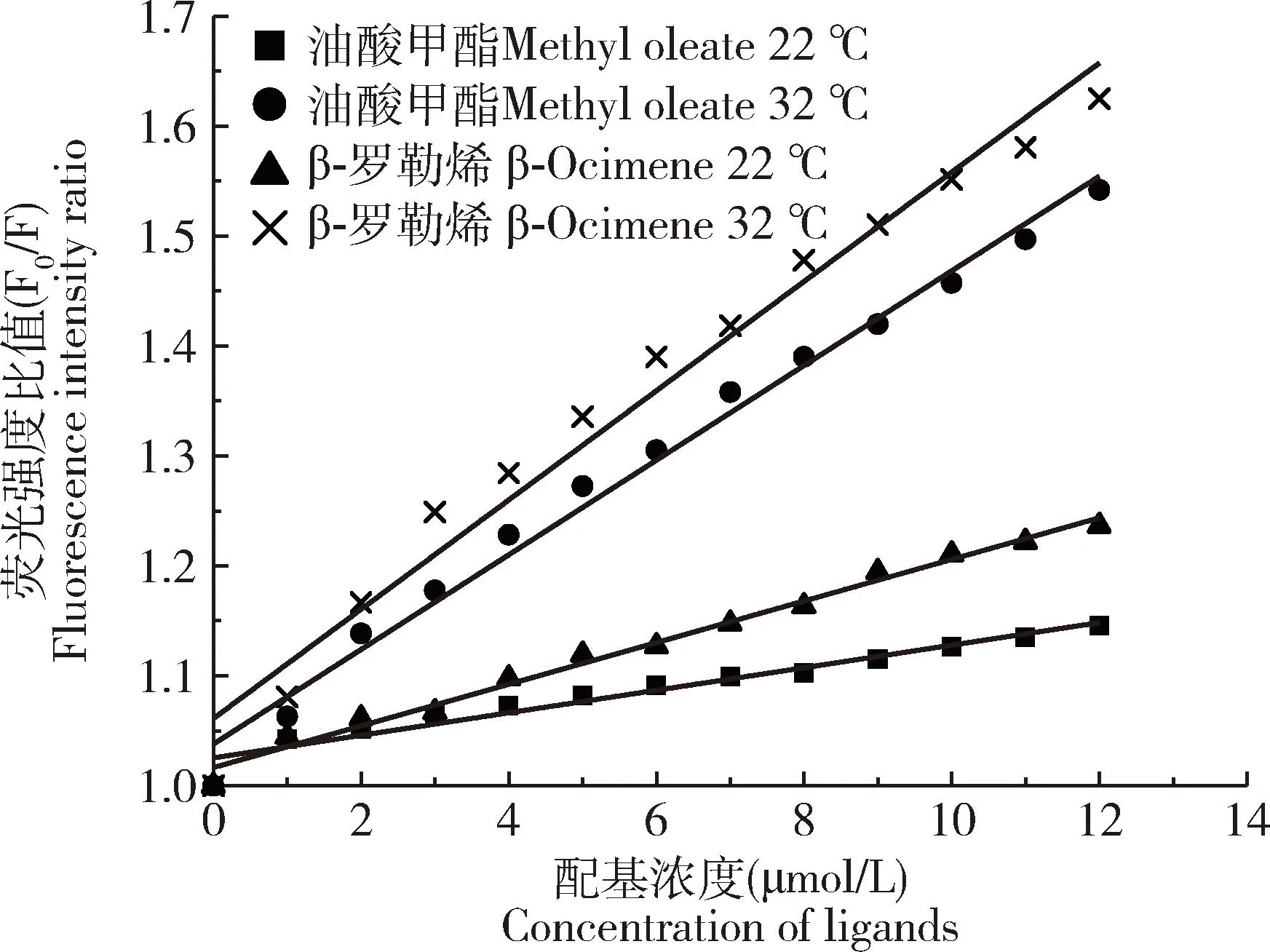
图4 22和32 ℃温度下油酸甲酯和β-罗勒烯对VdesNPC2b荧光猝灭的Stern-volmer图
进一步分析表明,油酸甲酯和β-罗勒烯在与VdesNPC2b结合时吉布斯自由能△G<0,说明它们的结合是自发进行的,不需要额外的外部作用力;焓变△H>0和熵变△S>0,说明维持VdesNPC2b蛋白和油酸甲酯和β-罗勒烯的相互作用力为疏水作用力(Zhangetal., 2023)。
2.4 同源建模和分子对接模拟结果
蛋白氨基酸序列比对显示,VdesNPC2b与粉尘螨DermatophagoidesfarinaeDerf2蛋白(2f08.1)相似度达到30.73%,基于其结构模拟确定VdesNPC2b的二级结构主要为6个β-折叠,在此基础上形成的高级结构内部具有1个潜在的配基结合腔(图5: A)。

图5 重组蛋白VdesNPC2b同源建模(A)及其与β-罗勒烯分子对接模拟(B)
MVD软件对接模拟结果表明,β-罗勒烯可以在VdesNPC2b的结合腔中结合(图5: B),多个氨基酸对维持二者的稳态发挥作用,关键氨基酸位点可能是Leu68,Ile103和Phe107等。
3 讨论
本研究以狄斯瓦螨嗅觉蛋白VdesNPC2b为研究对象,初步探索了VdesNPC2b蛋白识别蜜蜂幼虫信息素油酸甲酯和β-罗勒烯的功能及其结合机制,这对于探索高效的狄斯瓦螨生物防治具有重要意义。
NPC2蛋白是节肢动物中一类具有化学结合和转运功能的新型结合蛋白,近年来受到越来越多的关注。通过转录组和蛋白质组分析,研究者在狄斯瓦螨中发现了 6 个潜在的NPC2家族蛋白, 而且它们在化学感受器官中有表达(Eliashetal., 2017; Iovinellaetal., 2018)。进一步对VdesNPC2进行基因干扰,发现它能有效地影响狄斯瓦螨对宿主的选择和取食,也会导致其繁殖力和存活率降低(Ngansoetal., 2021),说明VdesNPC2在狄斯瓦螨寄主识别中发挥作用。本研究扩增了VdesNPC2b,结构分析确定它具有NPC2家族特征的MD-2-related lipid-recognition (ML)结构域,蛋白序列比对发现,其与已报道的相关蛋白相似度超过50%的只有梅氏热厉螨、巴氏新小绥螨和西方盲走螨的相关蛋白,表明该邻域相关蛋白的研究还较少。其中,巴氏新小绥螨NPC2-3蛋白已有报道其与嗅觉识别相关,可能参与取食等行为(Lietal., 2020)。VdesNPC2b的二级结构主要为6个β-折叠(图5),在此基础上形成具有结合腔的高级结构,有研究表明这种易变的β-折叠结构使其有利于结合长链脂肪酸、醇和醋酸盐等化学物质(Zhengetal., 2018),而狄斯瓦螨的寄主蜜蜂幼虫的信息素正好就是长链脂肪酸的酯类物质,这就暗示VdesNPC2b蛋白可能与识别蜜蜂幼虫酯类信息素有关。
幼虫酯类信息素是最早研究的蜜蜂信息素之一,包括油酸甲酯等10种长链酯类物质,在蜂群中的行为引诱实验表明这些物质可以吸引狄斯瓦螨,说明它们对狄斯瓦螨具有刺激作用(Le Conteetal., 1989)。然而,研究人员利用Y型嗅觉仪研究不同浓度幼虫酯类信息素对狄斯瓦螨的引诱作用时,并没有显著的引诱效果 (Pernaletal., 2005)。这可能是因为10种酯类物质的沸点高(约为200 ℃),挥发性很低,所以很难在较远距离的情况下对狄斯瓦螨发挥作用。随后,研究者在蜜蜂幼虫中鉴定了另一种挥发性的信息素——β-罗勒烯 (Maisonnasseetal., 2010),发现它可以协同幼虫酯类信息素在远距离刺激工蜂的哺育行为(Wuetal., 2019)。本研究中,我们发现VdesNPC2b对油酸甲酯和β-罗勒烯都有较强的结合力(图3),表明狄斯瓦螨有可能利用β-罗勒烯进行远距离定位寄主,同时利用油酸甲酯等幼虫酯类信息素来识别寄主和确定寄生行为。最近,研究者在有狄斯瓦螨寄生的蜜蜂幼虫中鉴定到另一种酯类物质——十四酸乙酯,电生理和Y型嗅觉仪结果表明狄斯瓦螨对其具有显著的吸引作用(Liuetal., 2022)。所以,通过分析蜜蜂幼虫的化学物质来进行狄斯瓦螨的防治具有可行性。如果研究清楚酯类信息素、β-罗勒烯和十四酸乙酯的协同作用,将能更好地对狄斯瓦螨进行生物防治。本研究中,我们还发现VdesNPC2b与油酸甲酯和β-罗勒烯的结合机制为动态猝灭(图4),即在高温时(32 ℃)它们的结合力比低温(22 ℃)下更强,而蜜蜂蜂群的温度一般能维持(34±0.5) ℃ (Tautzetal., 2003),所以VdesNPC2在高温时与幼虫信息素结合力强更有利于狄斯瓦螨通过嗅觉系统识别寄主。此外,信息素成分的比例差异也会影响化学感受的功能 (吴帆等, 2023),目前我们尚未分析不同比例的幼虫酯类信息素和β-罗勒烯对狄斯瓦螨的影响,后续将深入研究。
- 昆虫学报的其它文章
- 基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
- 红火蚁告警信息素2-乙基-3,6-二甲基吡嗪在天然橡胶塞和PVC管载体中的释放规律及田间验证

