基于转录组数据的中华按蚊细胞色素P450超家族基因不同发育阶段、成蚊不同组织和吸血前后不同时期雌成蚊的表达模式分析
郭迎澳, 陈 斌
(重庆师范大学昆虫与分子生物学研究所, 媒介昆虫重庆市重点实验室, 重庆 401331)
中华按蚊Anophelessinensis隶属于双翅目(Diptera)蚊科(Culicidae)按蚊属Anopheles,是中国和及东南亚国家疟疾、丝虫病和乙型脑炎的主要传播媒介之一,造成严重的公共卫生问题(Maetal., 2011)。
细胞色素P450单加氧酶(cytochrome P450 monooxygenases, CYPs)是一类含有血红素结构的超基因家族的末端氧化酶。一般来说,CYPs有5个保守的结构域,包括螺旋C(WxxxR)、螺旋I(GxE/DTT/S)、螺旋K(ExxR)、PERF区(PxxFxPE/DRE)和血红素结合区(PFxxGxxxCxG)(Rupasingheetal., 2006; Aietal., 2011; Feyereisen, 2012)。CYPs几乎存在于所有的生物体中,包括一些病毒(Griffithsetal., 2016; Omura and Gotoh, 2017),在单加氧酶系统中作为末端氧化酶,可以催化一分子氧原子转移到底物上,同时将另一分子氧原子还原成水(Feyereisen, 2012),能够催化至少60多种化学反应,参与多种内源性化合物(如激素、信息素和脂类等)的合成代谢和外源性化合物(药物、农药、天然产物等)的代谢解毒(Scott and Wen, 2001; Feyereisen, 2012; Nelson, 2018; Blomquistetal., 2021; Luetal., 2021),包括在作物害虫和病媒害虫中解毒杀虫剂导致其产生抗性(Dermauwetal., 2020; Vontasetal., 2020)。先前研究发现,细胞色素P450基因在昆虫不同发育阶段的表达具有特异性(Chungetal., 2009; Feyereisen, 2012),细胞色素P450基因经常参与肠道和马氏管对外源性物质的响应(Snyderetal., 1995; Chenetal., 2019; Li SYetal., 2021; Li Xetal., 2021),它们能够降解内源和外源化合物,保护细胞免受氧化和杀虫剂的损伤(Hakimetal., 2010)。但目前关于中华按蚊细胞色素P450基因在不同发育阶段、不同组织及吸血前后不同时期的表达情况还不清楚。
实验室前期研究鉴定出中华按蚊112个细胞色素P450基因,其中有110个基因是有完整开放阅读框的功能基因,这112个基因都包含有细胞色素P450结构域,被分为4个主要家族(线粒体、CYP2、CYP3和CYP4家族),18个家族和50个亚家族(Yanetal., 2018)。67个基因组成9个基因簇,同一簇内、同一基因家族内的基因具有相似的基因结构(Yanetal., 2018)。大多数细胞色素P450氨基酸序列包含5个完整且保守的基序:C螺旋、I螺旋、K螺旋、PERF和血红素结合区,但CYP329A1,CYP6P6和CYP9L2分别缺乏C螺旋、K螺旋和PERF基序(Yanetal., 2018)。
本研究以中华按蚊细胞色素P450超家族基因为研究对象,通过转录组测序和表达量分析其在中华按蚊不同发育阶段、成蚊不同组织以及吸血前后不同时期雌成蚊中的表达模式,初步筛选可能在中华按蚊生长发育和生理生化机制中发挥作用的细胞色素P450基因,这对于进一步探讨其表达调控和在杀虫剂代谢机制方面的研究奠定了前期基础。
1 材料与方法
1.1 供试蚊虫
中华按蚊WX-LS采自江苏无锡(31°59′N, 120°29′E),在室内27 ℃、相对湿度75%±5%、昼夜交替12 h条件下饲养,每天给幼虫换两次清水和鱼苗食物,待其化蛹后,将蛹放入纱网封口的大纸筒中待其羽化,用10%葡萄糖溶液饲养成虫;羽化3 d后,雌蚊吸食小白鼠的血液促使卵巢发育产卵,繁育后代。根据国家标准的蚊虫抗药性检测方法,实验室WX-LS为溴氰菊酯敏感品系(赵彤言等, 2012)。
1.2 转录组测序
收集WX-LS不同发育阶段(卵、1-4龄幼虫、雄蛹、雌蛹、雄成蚊和雌成蚊)、成蚊组织(触角、唾液腺、中肠、马氏管、精巢、卵巢、表皮和脂肪体)以及吸血前(对照)和吸血后1, 3, 6, 12, 24和48 h时雌成蚊,每个样品3个生物学重复,储存在RNAlater (Qiagen)中,由北京华大基因研究中心采用Illumina HiSeqTM2000进行转录组测序(GenBank登录号: SRR851144),重庆师范大学昆虫与分子生物学研究所组装和注释(Chenetal., 2014; Zhangetal., 2021)。由于测序量和基因长度会影响原始读段数在样本间差异基因的比较,为了保证后续分析的准确性,通过校正测序深度和基因长度,归一化后得到基因的FPKM(fragments per kilobase of transcript per million fragments mapped)值进行后续分析。测序获得的读段使用TopHat映射到中华按蚊基因组上,并使用Cufflink根据FPKM值来确定基因表达量。
1.3 中华按蚊细胞色素P450基因的表达量分析
基于1.2节测序得到的中华按蚊转录组数据,分析细胞色素P450基因在不同发育阶段、成蚊不同组织和吸血后雌成蚊中的表达量。首先,将基因表达量取每样本3个生物学重复FPKM值的平均值,将平均值换算成Log2(均值+1),换算后的log2(FPKM+1)作为衡量细胞色素P450基因表达量的数据;采用层次聚类算法分析中华按蚊在不同发育阶段、成蚊不同组织和雌成蚊吸血后的基因表达量(Lietal., 2017),将结果在TBtools软件中用heatmap进行数据可视化(Chenetal., 2020)。
2 结果
2.1 细胞色素P450家族基因在不同发育阶段的表达模式
根据中华按蚊转录组数据,整个细胞色素P450家族基因聚类成两个分支,其中一个分支大部分基因在幼虫期高表达,CYP4H18,CYP4G16,CYP6AA1,CYP6AG1,CYP6AG2,CYP6AH1,CYP6Y1,CYP6Y2,CYP6Z3,CYP9J4,CYP9J3,CYP9J7,CYP9M1,CYP12F3和CYP12F4在整个幼虫和成蚊期均表达量较高,其中CYP4G16和CYP6Y2在中华按蚊所有发育阶段均高表达;另一个分支的基因在大多数供试样本中表达量较低(图1)。在幼虫、蛹和成蚊期,分别有40, 26和35个基因表达量较高,其中CYP6AG1,CYP6AG2,CYP6AH1,CYP6Z3,CYP6Y2,CYP6P4,CYP9J3和CYP9J4在整个幼虫期高表达,CYP4G16,CYP4G17,CYP4J5,CYP6Y2,CYP49A1,CYP301A1,CYP303A1,CYP304B1和CYP325E1在蛹期表达量很高,CYP4G16,CYP4J5,CYP6AA1,CYP6AG1,CYP6AG2,CYP6AH1,CYP6Y1,CYP6Y2,CYP6Z3,CYP9M1,CYP9J3,CYP9J4,CYP12F1,CYP12F3和CYP12F4在成蚊期表达量很高。1-4龄幼虫中细胞色素P450家族基因的表达模式相似,雌蛹和雄蛹中细胞色素P450家族基因的表达模式相似,雌雄成蚊中细胞色素P450家族基因的表达模式相似(图1),各发育阶段之间细胞色素P450家族基因的表达模式是有差别的,可以看出细胞色素P450基因在不同发育阶段是具有特异性的。

图1 中华按蚊细胞色素P450基因在实验室溴氰菊酯敏感品系(WX-LS)不同发育阶段的表达谱
2.2 细胞色素P450家族基因在成蚊不同组织中的表达模式
结果表明,基因组织表达谱聚类为两个分支,其中一个分支25个基因表达水平较高,特别在表皮、脂肪体和精巢中表达较高(图2),其中CYP4G16,CYP6AG2,CYP6AH1,CYP6Y1,CYP9J3和CYP9J4在所有组织中均表达较高。另外一个分支基因表达量相对较低,其中CYP6M4在中肠和马氏管中表达量最高,CYP6Z1在马氏管和触角中高表达。CYP6Z3,CYP6M3,CYP6Z1,CYP9K1,CYP9J6和CYP9J7均在马氏管中高表达;CYP4H24,CYP6AG1,CYP6AG2和CYP6Y2均在中肠中高表达;CYP6AA1,CYP6AH1,CYP6M4,CYP9J3,CYP9J4和CYP12F3在中肠和马氏管中高表达;CYP4G16,CYP4G17,CYP4J5,CYP6Y1和CYP6Y2在表皮、脂肪体以及精巢中高表达;CYP6M2,CYP6P3V1,CYP6P3V2,CYP6P5,CYP9J5,CYP325F2,CYP325F3,CYP325G1,CYP325H1,CYP325J1和CYP325K1在触角中表现出高表达,而在其他组织中低表达。根据图2显示,细胞色素P450基因在表皮和脂肪体表达模式相似,其他组织之间表达模式有差别,表达模式具有组织特异性。
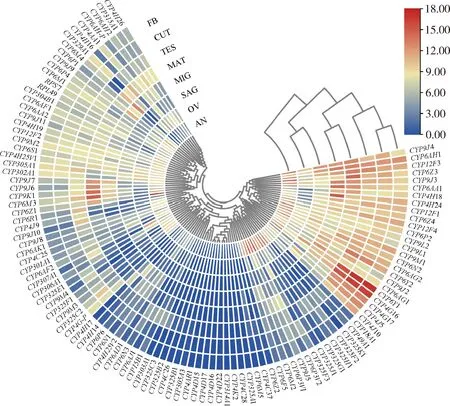
图2 中华按蚊细胞色素P450基因在实验室溴氰菊酯敏感品系(WX-LS)成蚊不同组织中的表达谱
2.3 细胞色素P450家族基因在雌成蚊吸血后的表达模式
结果显示,细胞色素P450基因表达谱聚类为两个分支,其中一个分支的基因在吸血后1, 3, 6, 12, 24和48 h时表达量较高,大多数基因在吸血后1, 3, 6, 12, 24和48 h时表达量与吸血前的对照近似,CYP4G16,CYP6AA1,CYP6AG2,CYP6AH1,CYP6Y1,CYP6Y2,CYP9K1,CYP12F3和CYP304B1在中华按蚊吸血后1, 3, 6, 12, 24和48 h时均高表达;CYP304B1和CYP329A1在吸血后表达量与对照比有所提高。另一个分支的基因在吸血后1, 3, 6, 12, 24和48 h时表达量较低,CYP4C26在中华按蚊吸血后12和24 h时表达量与对照比有所提高,但在吸血后其他时点的表达量与对照比均较低(图3);CYP6AH2和CYP9M2在吸血后6, 12, 24 h时表达量与对照比有所提高,CYP6S1在吸血后12, 24, 48 h时表达量较高;CYP307A1在吸血后6, 12 h时表达量较高,CYP6M2,CYP6P5,CYP306A1在吸血后48 h时表达量较高,整体来看,吸血前后不同时间的表达模式相似。

图3 中华按蚊细胞色素P450基因在实验室溴氰菊酯敏感品系(WX-LS)吸血雌成蚊中的表达谱
3 讨论
中华按蚊细胞色素P450家族基因的表达模式分析表明其具有发育阶段特异性和组织特异性。先前研究发现,细胞色素P450基因在昆虫不同发育阶段的表达具有特异性,这可能与不同基因行使的功能不同有关(Chungetal., 2009; Feyereisen, 2012)。中华按蚊CYP4G16,CYP6Y2,CYP301A1和CYP304B1在卵期表达量较高(图1),表明这些基因可能在其胚胎发育过程中起作用。在幼虫、蛹和成虫期,分别有40, 26和35个基因具有较高表达量。中华按蚊CYP6AG1,CYP6AG2,CYP6AH1,CYP6Z3,CYP6Y2,CYP6P4,CYP9J3和CYP9J4在整个幼虫期高表达,这表明这些基因可能与中华按蚊的生长发育过程有关。现有研究发现,棉铃虫Helicoverpaarmigera的CYP6B2在幼虫期的表达量显著高于在其他发育阶段的(Ranasingheetal., 1997);小菜蛾Plutellaxylostella的诸多细胞色素P450基因,如CYP340W1v2等在幼虫期的表达量较高(Yuetal., 2015)。幼虫期是主要的进食时期,由于食源性有毒化合物可能会被吸收,因此幼虫中各种细胞色素P450基因的大量表达可能参与了对这些化学物质的解毒(Yuetal., 2015)。中华按蚊CYP4G16,CYP4G17,CYP4J5,CYP6Y2,CYP49A1,CYP301A1,CYP303A1,CYP304B1和CYP325E1在蛹期表达量很高,表明这些细胞色素P450基因可能参与了复杂的羽化过程。有研究表明,小菜蛾的CYP338C1等在卵和蛹期的表达量显著高于在其他发育阶段的(Yuetal., 2015)。中华按蚊CYP4G16,CYP4J5,CYP6AA1,CYP6AG1,CYP6AG2,CYP6AH1,CYP6Y1,CYP6Y2,CYP6Z3,CYP9M1,CYP9J3,CYP9J4,CYP12F1,CYP12F3和CYP12F4在成虫期表达量很高,冈比亚按蚊A.gambiaeCYP6D1在成虫期的表达量也显著高于其他发育阶段的(Nikouetal., 2003);华山松大小蠹DendroctonusarmandiCYP4G56仅在成虫期高表达,在其他发育阶段表达量则很低(Daietal., 2014)。这些基因在不同发育阶段表达情况不同,暗示这些细胞色素CYP450基因可能在发育过程中发挥作用,特别是在特定的生命阶段(Laoetal., 2015)。
中肠是抵御食物中存在的有毒异生物的第一道防线(Scott, 2008),因此在肠道中高度表达的细胞色素P450基因可能参与了毒素代谢。有研究表明,细胞色素P450基因经常参与肠道对外源性物质的反应(Li SYetal., 2021; Li Xetal., 2021),它们的过量表达可以增强害虫对杀虫剂的解毒作用(Jingetal., 2020)。中华按蚊细胞色素P450家族基因在成蚊不同组织的表达谱分析显示(图2),CYP4H24,CYP6AG1,CYP6AG2和CYP6Y2均在中肠中高表达。除中肠外,细胞色素P450基因也在主要的排泄器官马氏管中表达(Snyderetal., 1995; Chenetal., 2019)。本研究中,中华按蚊CYP6Z3,CYP6M3,CYP6Z1,CYP9K1,CYP9J6和CYP9J7均在马氏管中表达量较高(图2)。除了以上的细胞色素P450基因以外,中华按蚊CYP6AA1,CYP6AH1,CYP6M4,CYP9J3,CYP9J4和CYP12F3在中肠和马氏管中均高表达。昆虫的中肠是主要的消化道和最大的代谢组织,马氏管是主要的排泄器官,它们都具有降解内源和外源化合物的作用,可以保护细胞免受氧化和杀虫剂的损伤(Hakimetal., 2010),表明中华按蚊的这些细胞色素P450基因在解毒过程中发挥了重要作用。昆虫的唾液腺产生富含酶的液体,在消化过程中发挥作用(Cantón and Bonning, 2020)。本研究中,中华按蚊CYP6AH1,CYP6Y1,CYP9J4和CYP12F3在唾液腺中表达量较高。在长红锥蝽Rhodniusprolixus中,RproCYP4M1在唾液腺中高度表达(Paimetal., 2022);黄粉虫Tenebriomolitor中TmCYP345C4,TmCYP307A1,TmCYP4BN60和其他几个基因在唾液腺中高度或特异性表达(Wangetal., 2022)。表明这些基因可能在消化和解毒方面发挥作用。由于细胞色素P450基因在生殖组织中的大量存在,它们被认为与昆虫的繁殖有关(Wen and Scot, 2001)。在中华按蚊的卵巢中CYP9J3,CYP9J4和CYP307A1等表达量较高,精巢中CYP4G16,CYP6Y1和CYP6Y2等高表达,暗示这些基因可能与其繁殖方面有关。
吸血后不同时期的表达谱显示中华按蚊CYP304B1和CYP329A1在吸血后几个时间点表达量较吸血前增加(图3),表明这些基因可能与血液的消化和吸收有关。CYP4G16,CYP6AA1,CYP6AG2,CYP6AH1,CYP6Y1,CYP6Y2,CYP9K1,CYP12F3和CYP304B1在中华按蚊吸血后各个时间点均高表达,可能是因为整虫取样测序,不能清楚地了解到细胞色素P450基因在吸血后不同组织的具体表达情况。
- 昆虫学报的其它文章
- 狄斯瓦螨VdesNPC2b蛋白的基因克隆、原核表达及其与寄主幼虫信息素结合机制研究
- 亚洲玉米螟对球孢白僵菌分生孢子和芽生孢子-玉米共生体的取食选择和嗅觉反应
- 紫外线辐照被寄生的黑腹果蝇蛹对果蝇锤角细蜂生长发育的影响
- Response of heat inducible heat shock protein 90 gene of Aphis gossypii (Hemiptera: Aphididae) to gossypol and flupyradifurone stresses and mutual effect on transcription factor HSF
- 蜜蜂衰老与寿命调控研究进展
- 红火蚁告警信息素2-乙基-3,6-二甲基吡嗪在天然橡胶塞和PVC管载体中的释放规律及田间验证

