血清Eotaxin、PAF与急性大出血输血相关性急性肺损伤患者预后的关系分析*
王凌雪,蔡 娜
陕西省西安市长安医院输血科,陕西西安 710199
输血相关性急性肺损伤(TRALI)是一种因输血而引起的严重并发症,目前对该病的发病机制主要考虑与患者自身状况、输血因素及机体内的效应细胞等因素有关[1]。由于TRALI是输血引发的一类有较大危害性及致命性的并发症,对患者的预后具有严重影响,故科学、精准地评价TRALI患者的潜在死亡风险对临床诊治及优化患者的预后均具有较大价值[2]。TRALI的临床表现主要为急性肺损伤,与机体的炎症有较大关联,因此监测与此种症状密切相关的血清学指标有助于更好地评价患者的病情及预后[3]。嗜酸性粒细胞趋化因子(Eotaxin)及血小板活化因子(PAF)均是与机体炎症反应密切相关的重要生物学因子,能够较好地反映出机体内的炎症损伤状况[4-5]。鉴于此,本研究通过分析血清Eotaxin及PAF与TRALI患者预后的关系,为评估TRALI的临床症状提供指导,现报道如下。
1 资料与方法
1.1一般资料 回顾性选取本院2019年1月至2022年10月收治的144例TRALI患者(急性大出血患者输血后发生)作为观察组,另选取同期未发生TRALI的急性大出血患者140例作为对照组。观察组中男85例,女59例;年龄41~69岁,平均(52.88±2.31)岁;大出血诱因:外伤83例,手术41例,出血性疾病20例;基础疾病:高血压45例,糖尿病42例;既往有输血史47例,有过敏史42例。对照组中男87例,女53例;年龄42~68岁,平均(52.79±2.27)岁;大出血诱因:外伤75例,手术40例,出血性疾病25例;基础疾病:高血压41例,糖尿病43例;既往有输血史45例,有过敏史39例。纳入标准:(1)患者均满足大出血的临床诊断标准[6],在1 d内失血≥1个血容量(健康成年人体质量的7%),3 h失去50%血容量,20 min内失血量为1.5 mL/(kg·min),且总量超过150 mL/min;(2)TRALI患者满足2004年加拿大会议中的TRALI诊断共识[7];(3)满足输血指征及操作规范;(4)患者的肝、肾等脏器功能正常,且无凝血障碍类疾病;(5)患者在输血前的肺功能正常,胸部X线片显示正常。排除标准:(1)患者在输血前存在肺部感染或其他感染性疾病;(2)存在肺挫伤或脓毒症;(3)存在肺动脉高压;(4)存在急性胰腺炎;(5)存在血液系统的恶性肿瘤。所有患者或其家属对本研究知情并签署知情同意书。本研究已经本院医学伦理委员会审批通过。
1.2方法
1.2.1输血治疗 为患者常规开放其外周静脉通路,将乳酸钠林格氏液晶体及6%低分子右旋糖酐胶体以2∶1比例混合,滴注速率为10 mL/(kg·h),在补充液体时需维持血压正常,按患者的失血状况及血气分析结果,实施浓缩红细胞和血浆的申领。按照患者的心肺功能和器官缺血及代谢情况决定浓缩红细胞的输注治疗。
1.2.2血清Eotaxin及PAF的检测 在观察组确诊TRALI时采集其4 mL血液标本,在对照组输血结束后的6 h内采集其4 mL血液标本,3 000 r/min离心10 min,半径为10 cm,并将血清分离。通过酶联免疫吸附试验(ELISA)检测血清Eotaxin及PAF水平,试剂盒分别购自上海西唐生物科技有限公司、上海烜雅生物科技有限公司,严格按说明书的步骤进行操作。
1.2.3预后情况及分组方法 住院期间统计观察组患者10 d内的死亡情况,根据是否存活分为存活组和死亡组。
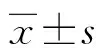
2 结 果
2.1观察组与对照组血清Eotaxin及PAF水平比较 观察组血清Eotaxin及PAF水平均高于对照组(P<0.05)。见表1。
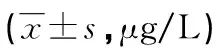
表1 观察组与对照组血清Eotaxin及PAF水平比较
2.2不同预后患者血清Eotaxin及PAF水平比较 观察组中存活134例,纳入存活组;死亡10例,纳入死亡组。死亡组血清Eotaxin及PAF水平均高于存活组(P<0.05)。见表2。
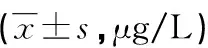
表2 不同预后分组血清Eotaxin及PAF水平比较
2.3不同预后TRALI患者一般资料比较 存活组和死亡组患者在不同输血次数、不同发血至输血间隔、既往有输血史及过敏史中的比例差异均有统计学意义(P<0.05),而在不同性别、血制品类型、年龄、基础疾病、输血量中的比例差异均无统计学意义(P>0.05)。见表3。

表3 患者死亡风险的单因素分析[n(%)或
2.4TRALI患者死亡影响因素的多因素Logistic回归分析 以TRALI患者10 d预后(存活=0,死亡=1)为因变量,以表2及表3中差异有统计学意义的Eotaxin(原值输入)、PAF(原值输入)、输血次数(≤2次=0,>2次=1)、发血至输血间隔(<0.5 h=0,≥0.5 h=1)、既往输血史(无=0,有=1)、过敏史(无=0,有=1)为自变量,进行多因素Logistic回归分析。结果显示:输血次数>2次、发血至输血间隔≥0.5 h、既往有输血史、有过敏史、Eotaxin水平升高及PAF水平升高均是TRALI患者死亡的危险因素(P<0.05)。见表4。
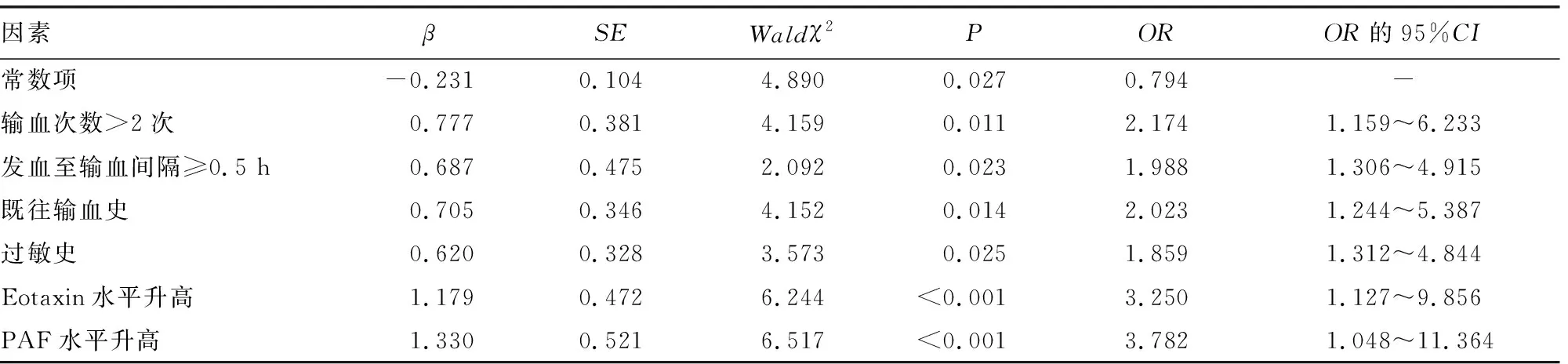
表4 TRALI患者死亡影响因素的多因素Logistic回归分析
2.5血清Eotaxin及PAF水平对TRALI患者死亡风险的预测价值分析 以死亡组为阳性标本、以存活组为阴性标本,探讨血清Eotaxin及PAF水平对TRALI患者死亡风险的预测价值。ROC曲线分析显示,血清Eotaxin、PAF单项检测对TRALI患者死亡风险具有一定预测价值,其AUC分别为0.814(95%CI:0.652~0.958)、0.793(95%CI:0.635~0.941)。基于前述Logistic回归结果,进一步建立血清Eotaxin及PAF联合应用的回归预测模型,以模型值Ln(P/1-P)=1.179×XEotaxin水平+1.330×XPAF水平为联合检测的虚拟概率量指标进行ROC曲线分析。结果显示:血清Eotaxin及PAF联合检测的AUC为0.893(95%CI:0.846~0.916),联合检测的预测效能高于单项检测。见表5和图1。
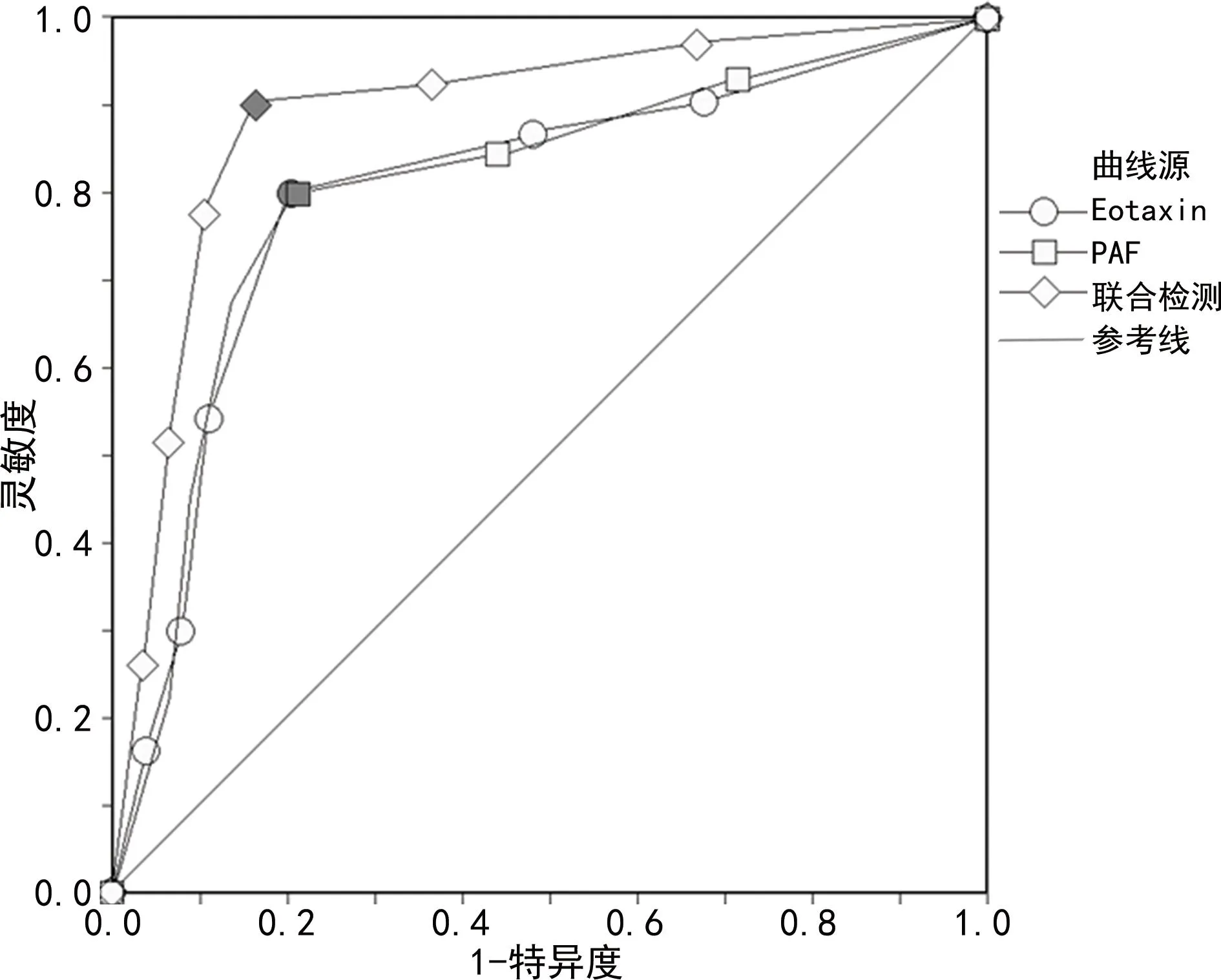
图1 血清Eotaxin及PAF水平预测TRALI患者死亡的ROC曲线
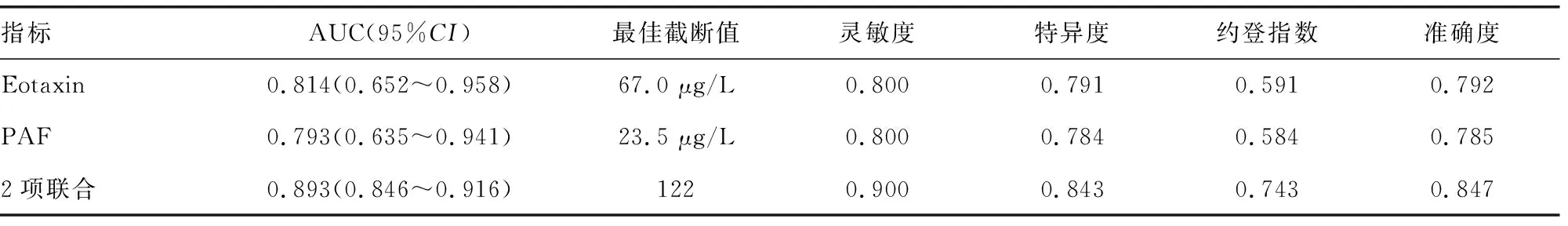
表5 血清Eotaxin及PAF水平对死亡风险的预测价值分析
3 讨 论
TRALI是一种低氧血症及急性的非心源性肺水肿综合征,被认为是因输血而引起死亡的重要诱因,但其详细的病理学机制至今仍未完全明晰,因此对TRALI的临床诊治通常存在着较大的挑战[8]。寻找新型的血清学监测指标,对于预测此类患者的临床预后具有十分重要的意义[9]。
本研究通过比较发现,观察组的血清Eotaxin及PAF水平均高于对照组(P<0.05),且死亡组的血清Eotaxin及PAF水平均高于存活组(P<0.05)。分析其原因主要与这两项指标可能参与TRALI患者的临床发病及病情进展等因素有关。血清Eotaxin属于一类较强的嗜酸性粒细胞(Eos)选择型化学趋化剂,其对于Eos存在较好的趋化效果,但与其他可对Eos产生类似作用的趋化因子比较发现,Eotaxin对于Eos的迁移往往存在更高的趋化性,且能较好地诱导有关Eos产生炎症介质,进而致使局部炎症反应明显加重,并影响患者的临床预后[10]。PAF作为一类磷脂介质,具有内源性和广泛性的重要生物学活性,且能够导致核因子κB逐渐活化,并使得中性粒细胞不断地聚集于患者的肺组织中,最终导致肺组织损伤,而预后越差的患者此种损伤程度也越剧烈[11]。有动物实验表明,利用PAF抑制剂调控机体的PAF水平,能够较好地阻止急性肺损伤的病情发展,同时降低PAF的活化,最终发挥较好的抗炎效果[12]。同时本研究结果显示Eotaxin及PAF水平升高均是TRALI患者死亡的危险因素。Eotaxin作为C-C型化学趋化因子,可使白三烯等物质加速形成,进而强化了Eos的毒素生成,并可加重炎症反应,从而导致患者病情加重而出现死亡等不良预后[13]。PAF能够使得TRALI患者的毛细血管床相关平滑肌收缩,特别是毛细血管的后静脉,并使毛细血管中液体及大分子物质因压力的作用而朝血管外不断渗出,逐渐进展造成右心负荷过重以及前负荷下降,最终引起心力衰竭而导致预后不良[14]。
本研究还显示:输血次数>2次、发血至输血间隔≥0.5 h、既往有输血史、有过敏史亦是TRALI患者死亡的危险因素,提示上述因素均与TRALI患者的死亡存在紧密联系。患者在首次接受输血的刺激后在其体内形成了相应的抗体,若再次进行输血,则可能致使白细胞破裂的同时释放出过敏原,进而诱发较为严重的不良反应,影响其生存预后[15]。同时,由于血液制品在常温下放置时间超过0.5 h即可能致使细胞发生失调现象,从而使得患者在输血过程中产生不良反应的风险明显增大[16-17]。ROC曲线分析结果显示血清Eotaxin及PAF联合检测对TRALI患者死亡风险的预测价值最高,其中单独检测Eotaxin评估TRALI患者死亡风险的AUC为0.814(95%CI:0.652~0.958),而单独检测PAF水平评估TRALI患者死亡风险的AUC为0.793(95%CI:0.635~0.941),二者联合检测评估TRALI患者死亡风险的AUC达到0.893(95%CI:0.846~0.916)。这也证实了监测血清Eotaxin及PAF水平有助于更好地研判TRALI患者的死亡风险。血清Eotaxin及PAF均参与了TRALI患者的病情进展过程,对二者进行监测能够科学而客观地反映出TRALI患者的病情状况及预后情况,从而更好地评价其预后。
综上所述,血清Eotaxin及PAF与TRALI患者的预后紧密关联,对二者进行监测有助于更好地评估TRALI患者的预后,值得关注。

