超支化修饰亲水型阴离子色谱柱的制备与应用
蒙素仟,刘 博*,刘伟俊,刘 瑞,桑柳波,赖华杰*
(1.中科检测技术服务(广州)股份有限公司,广东 广州 510650;2.中科检测技术服务(重庆)有限公司,重庆400700;3.中国科学院广州化学研究所,广东 广州 510650)
自1975年Small等[1]提出使用电导检测离子化合物的离子色谱方法后,离子色谱技术得到了快速的商业化发展,已成为环境检测、食品分析、医学制药、生物科学等行业十分有效的分析工具[2-7]。色谱柱是离子色谱仪的心脏,而聚合物因具有pH耐受范围广等特点成为色谱柱的主要基质之一,但其疏水性使之在色谱分离过程中表现出峰展宽、拖尾、强保留等不良性能。因此,聚合物基离子色谱柱分离性能的改进主要聚焦于功能基团的修饰和新基质材料的开发[8-12]。
离子色谱固定相功能基团的修饰方法主要包括乳胶聚附、衍生化法、树状超支化法、涂覆修饰等[13-16]。其中,超支化法修饰的固定相内外表面可交联成三维重复单元,在结构上高度对称并具有可修饰的末端基团。所形成的三维空间结构可有效屏蔽聚合物基质的疏水性,改善目标离子的峰形并改变其保留行为,备受色谱工作者的关注[10,13,16-19]。Chen等[10]使用聚甲基丙烯酸缩水甘油酯-二乙烯基苯微球接枝聚乙烯胺,采用环氧-胺的聚合方法制备离子色谱固定相。Zhang等[20]以聚甲基丙烯酸缩水甘油酯-二乙烯基苯微球为基质微球,采用连续接枝和巯基修饰法制备聚电解质接枝阴离子型固定相。Zhou 等[21]以硅胶为基质微球,采用环氧-多巴胺连续接枝方式制备混合模式固定相。超支化修饰的离子色谱柱可应用于复杂样品检测,但有关该类色谱柱对目标物保留机理的研究甚少。而目标物的保留行为是色谱在分离过程中识别离子、分子物理化学性质的体现[22]。功能基团是影响目标物保留的因素之一,其选择性主要受自身结构、大小、分布的影响。因此,研究超支化修饰离子色谱固定相的功能基团对目标物的保留行为具有重要意义。
树状超支化修饰的功能基团末端具有活性,可实现分子大小、形状、结构的设计和控制,因此,可用于超支化修饰的固定相的保留行为研究[23-24]。本文以聚苯乙烯-二乙烯基苯(PS-DVB)作为基质微球,通过磺化处理引入磺酸基团;接着采用树状超支化修饰方式,加入四乙烯五胺(TEPA)和1,4-丁二醇二缩水甘油醚(BDDGE),待胺基与环氧键支化反应生成羟基基团后以甲胺(MA)封端。磺化和超支化修饰引入的大量羟基基团,可有效增加和固定相的亲水性,进而可改变固定相对离子的选择性。采用所制备的色谱柱对自来水、地表水、工业废水等实际样品进行检测,考察其分离性能。
1 实验部分
1.1 仪器、试剂与材料
XH-100B微波反应仪、XH-2008DE超声反应仪(北京祥鹄科技发展有限公司);GLK-1000/2000压柱机、色谱空柱(无锡加莱克色谱科技有限公司);CIC-D120 离子色谱仪(青岛盛瀚色谱技术有限公司),配自动进样器、柱温箱和电导检测器;L100BD-HK830 高倍光学显微镜(深圳市奥斯微光学仪器有限公司);Sigma 300扫描电子显微镜(德国卡尔·蔡司股份公司);TENSOR 27傅里叶变换-红外光谱仪(FTIR,德国布鲁克分析仪器公司);Scientific K-Alpha X 射线光电能谱(美国赛默飞世尔科技有限公司);ASAP 2460全自动比表面积及孔径测定仪(美国麦克仪器公司)。
十二烷基硫酸钠(SDS)、二乙烯基苯(55%,DVB)、MA(30%水溶液)购自上海阿拉丁生化科技股份有限公司;聚乙烯吡咯烷酮(K30、K90,PVP)、偶氮二异丁腈(重结晶,AIBN)、过氧化苯甲酰(BPO)、邻苯二甲酸二丁酯(DBP)、苯乙烯(ST)、BDDGE 和TEPA 购自上海麦克林生化科技有限公司;氢氧化钠、碳酸钠(优级纯)、碳酸氢钠和氢氧化钾(优级纯)购自国药集团化学试剂有限公司;甲苯、丙酮(均为色谱纯)购自上海安谱实验科技股份有限公司;无水乙醇购自广东光华科技股份有限公司;浓硫酸(98%,优级纯)购自广州化学试剂厂。以上试剂纯度除特别说明外均为分析纯。
1.2 色谱固定相的制备
固定相的制备主要分基质微球的制备和在微球表面进行树状超支化修饰两个步骤。色谱柱工艺流程图如图1所示。
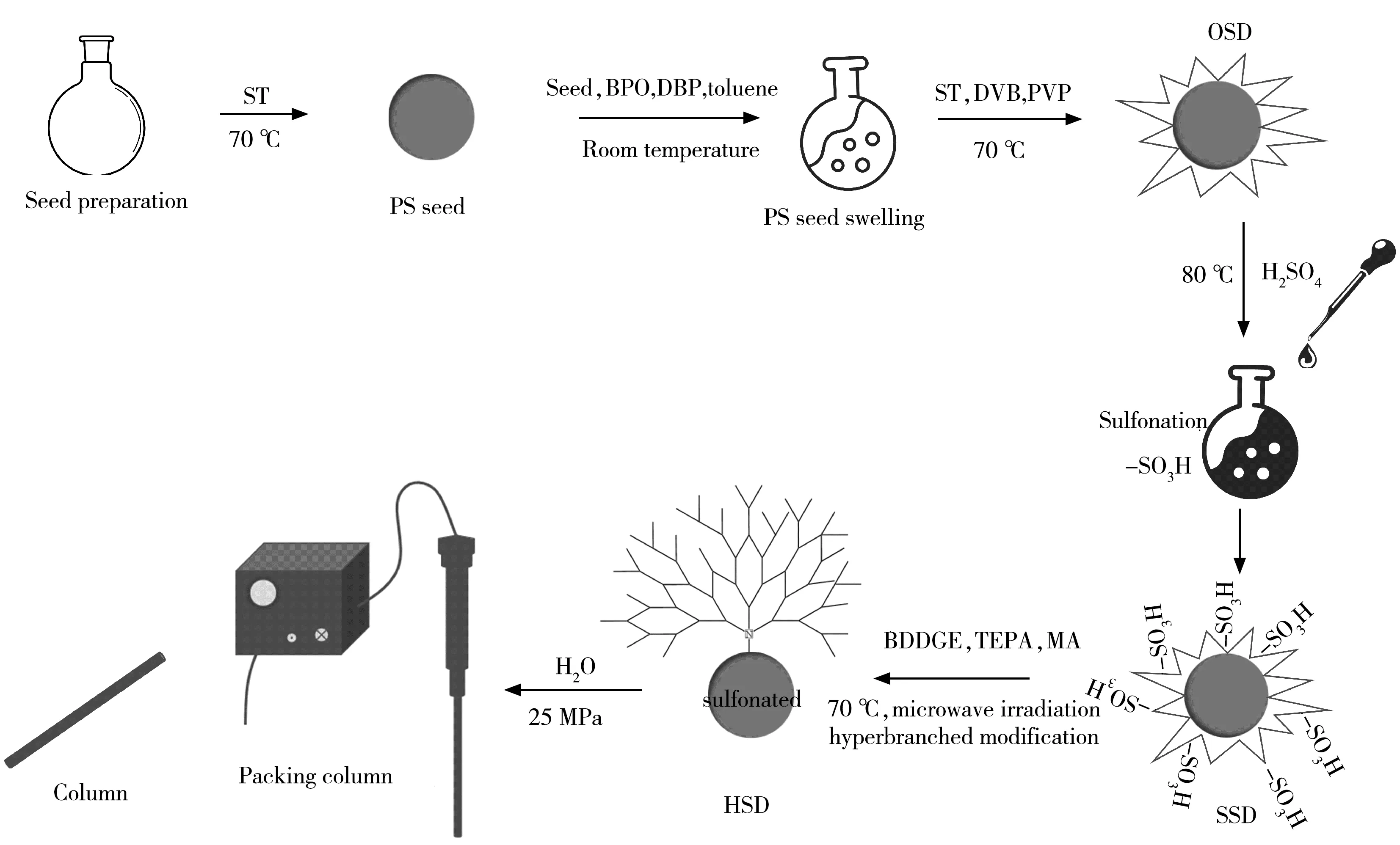
图1 阴离子色谱柱制备工艺流程图Fig.1 Process scheme for preparation of anion chromatography column
1.2.1 PS-DVB微球的制备聚苯乙烯(PS)微球参考Huang等[14]的方法制备。
PS-DVB 微球的主要制备步骤如下:在100 mL H2O 中依次加入1.50 g SDS、0.24 g BPO、1.40 mL DBP、13.30 mL 甲苯,超声分散,使液滴直径均小于0.50 µm。将上述乳液转移至三口烧瓶中,加入3.96 g PS 微球,30 ℃下活化10 h。随后加入13.30 mL ST、13.30 mL DVB,以及35.0 mL 质量分数为4.28%的PVP 水溶液,继续溶胀10 h。通入N2,升温,70 ℃下反应4 h。待反应结束后,将产物超声、离心、洗涤、烘干,得到PS-DVB微球(OSD),待用。
1.2.2 固定相的制备将OSD微球与浓硫酸反应得到磺化微球(SSD)。随后,采用超支化法制备阴离子固定相,具体步骤为:①称取5.00 g SSD 置于三口瓶中,分别加入15.0 mL 浓度为0.35 mol/L 的BDDGE 和TEPA;②将三口烧瓶放入微波反应仪内,70 ℃下反应30 min;③将产物转移至离心管,用H2O 离心洗涤,再转移至烧瓶中;④加入10 mL 0.58 mol/L 的BDDGE,在70 ℃下反应15 min 后,重复步骤③;⑤加入10 mL 0.35 mol/L 的TEPA,70 ℃下反应15 min,重复步骤③;⑥重复一次步骤④~步骤⑤;⑦重复一次步骤④;⑧加入10 mL 浓度为1.53 mol/L 的MA 溶液,70 ℃反应15 min,以H2O-乙醇离心洗涤2~3次,即可获得阴离子固定相(HSD)。
1.3 离子色谱柱的装填
色谱柱规格为250 mm×4.6 mm。称取5.0 g 上述制备的HSD 固定相,在25 mL H2O 中超声分散30 min,转移至匀浆罐中,以H2O 为顶流液,通过N2加压(25 MPa)使流出液超过500 mL,随后卸压拆柱,即获得离子色谱柱。
1.4 离子色谱仪工作条件
离子色谱仪的柱温范围为35~45 ℃,流速为0.7~1.2 mL/min,流动相分别为不同浓度的Na2CO3和Na2CO3-NaHCO3,等度洗脱,进样体积为25 µL,检测器为电导检测器。
2 结果与讨论
2.1 固定相形貌分析
图2分别为PS、OSD、SSD以及HSD微球的SEM图。由图2A可知,PS为表面光滑的无孔微球,大小一致,粒径约2 µm。由图2B 可知,经交联反应后,OSD 表面粗糙,内附图显示其表面粗糙度均匀。从图2中可以看出,磺化反应(SSD,图2C)和超支化反应(HSD,图2D)对微球的整体形貌无显著影响,其粒径约5 µm。

图2 PS(A)、OSD(B)、SSD(C)、HSD(D)微球的SEM图Fig.2 SEMs of PS(A),OSD(B),SSD(C) and HSD(D) microspheres
使用BET 分析微球的比表面积、孔径大小、孔体积等相关参数。由图3A 可知,OSD、SSD 以及HSD 三者的吸附脱附等温线回滞,磺化、超支化反应后,N2的吸附体积变小,微球的比表面积降低。BJH 模型计算结果(图3B)显示,HSD 与OSD、SSD 的孔径相差较大,大孔的数量增加,表明超支化修饰后,大孔结构的微球数量增多,材料的比表面积降低[25]。具体结果如表1所示。

表1 OSD、SSD、HSD的比表面积、孔体积和孔径Table 1 Specific surface area,pore volume and pore diameter of OSD,SSD and HSD
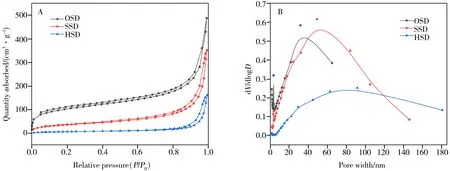
图3 OSD、SSD、HSD的吸附脱附等温线(A)和孔径大小分布图(B)Fig.3 The adsorption and desorption curves(A) and pore size distribution(B)of OSD,SSD and HSD
2.2 固定相结构分析
图4 为OSD、SSD、HSD 的FTIR 图。由图可知,位于1 182、1 035 cm-1处的峰分别为S=O 的不对称伸缩振动和对称伸缩振动[26-27],1 190 cm-1处的特征吸收峰为C—N 的伸缩振动,680 cm-1处为N—H的面外弯曲振动,3 450 cm-1处为—OH和N—H的伸缩振动[28]。上述吸收振动峰分别对应—SO3-、N—H键和—OH 基团,表明磺化反应使基质苯环开环,与—SO3-发生取代反应,在微球表面形成薄负电层,超支化反应将胺基引入到基质微球中,因此固定相表面具有磺酸和叔胺、季胺结构。
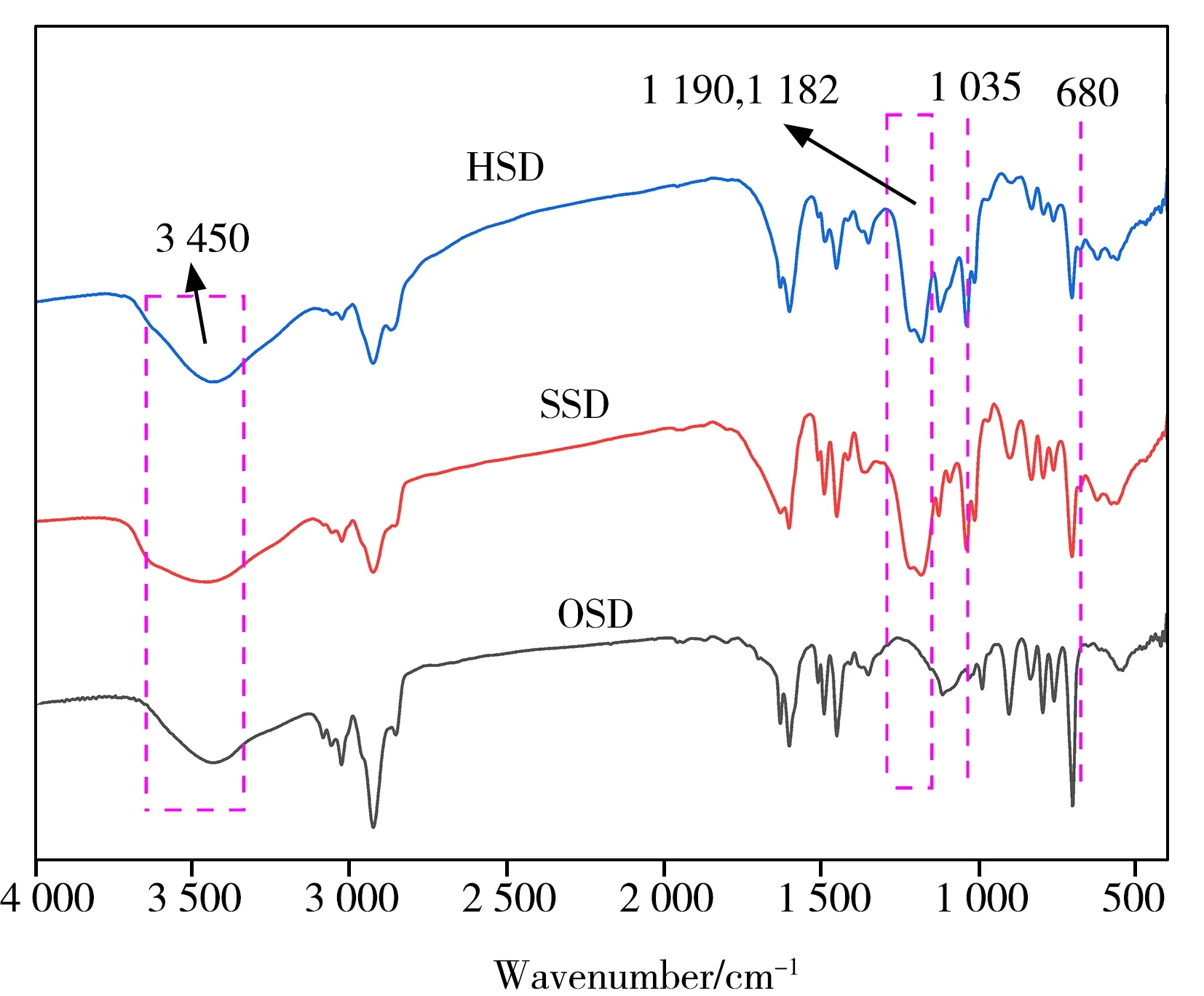
图4 OSD、SSD、HSD的红外光谱图Fig.4 FTIR spectra of OSD,SSD and HSD
用XPS 分析微球表面N、S 等元素的含量,结果如表2 所示。由表可知,磺化反应后,微球表面C 元素的含量降低,超支化反应后,C 元素进一步下降。而磺化反应后S 元素含量明显增加,说明磺酸基团有效引入到微球表面,这与FTIR 结论一致;而超支化反应后,N 元素明显增加,S 元素占比虽有所降低,但仍有部分S 元素保留,说明微球表面既有磺化反应引入的磺酸基团又有超支化反应引入的叔胺、季胺等胺基基团,与FTIR分析结果一致。
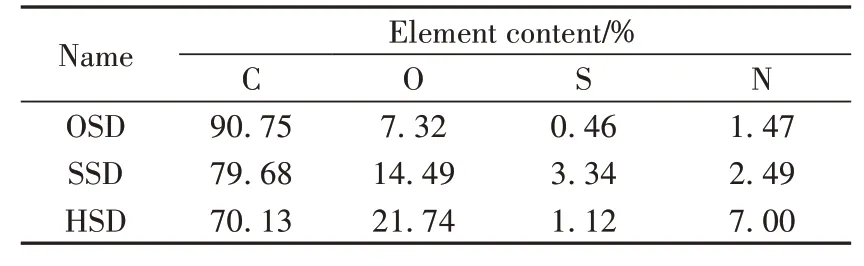
表2 OSD、SSD、HSD表面的元素分析结果Table 2 Elemental analysis results for OSD,SSD and HSD
2.3 色谱柱分离性能分析
将HSD 固定相装填成色谱柱,以常见的7 种阴离子(F-、Cl-、Br-、NO2-、NO3-、SO42-、HPO42-)和5 种酸根离子为目标物,考察离子色谱固定相的分离效果和色谱保留行为。
图5A 为HSD 色谱柱分离7 种阴离子(0.2~10.0 mg/L)的色谱图,由图可知,HSD 柱可在20 min 内完成7种目标物的分离。其中,SO42-、HPO42-出峰较快(分别为11.2 min 和9.07 min),NO3-的保留时间为18.1 min。推测该现象产生的原因是超支化修饰改善了HSD 色谱柱固定相的疏水性,同时叔胺长链的空间位阻与离子交换[29-30]也起到了一定的作用。
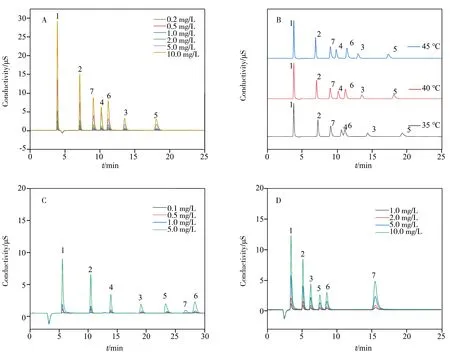
图5 7种阴离子在HSD柱(A~B)、商业色谱柱a(C)和商业色谱柱b(D)上的分离色谱图Fig.5 Ion chromatograms of 7 anions separated at HSD column(A-B),commercial column a(C) and commercial column b(D)
如图5B 所示,温度≥40 ℃时,HSD 色谱柱可完全分离7 种阴离子。这是因为环境温度升高,分子的布朗运动加剧,目标物与固定相的结合更快,色谱峰的出峰时间缩短,但保留能力即出峰顺序未发生变化。
图5C 和图5D 分别为商品色谱柱在推荐条件(3.6 mmol/L Na2CO3淋洗液,30 ℃柱温,流速分别为0.8 mL/min 和1.2 mL/min)下分离上述7种阴离子的色谱图。在相同的实验条件下,HSD 色谱柱由于采用磺化、超支化修饰,能够完全分离目标物,达到与商品柱一样的分离效果,且成本远低于商品柱。
淋洗液的浓度和种类也会影响目标物在色谱柱上的保留行为。图6A 为不同浓度Na2CO3淋洗液下HSD色谱柱分离7种阴离子的色谱图。由图可知,当淋洗液浓度改变时,二价目标物(SO42-、HPO42-)的保留时间均早于一些一价离子(Br-、NO3-)。由图6B 可知,当淋洗液加入NaHCO3溶液时,除F-、Cl-外,其他阴离子的保留时间均发生变化。结果显示,淋洗液种类会影响离子的保留时间,但不影响其出峰顺序。
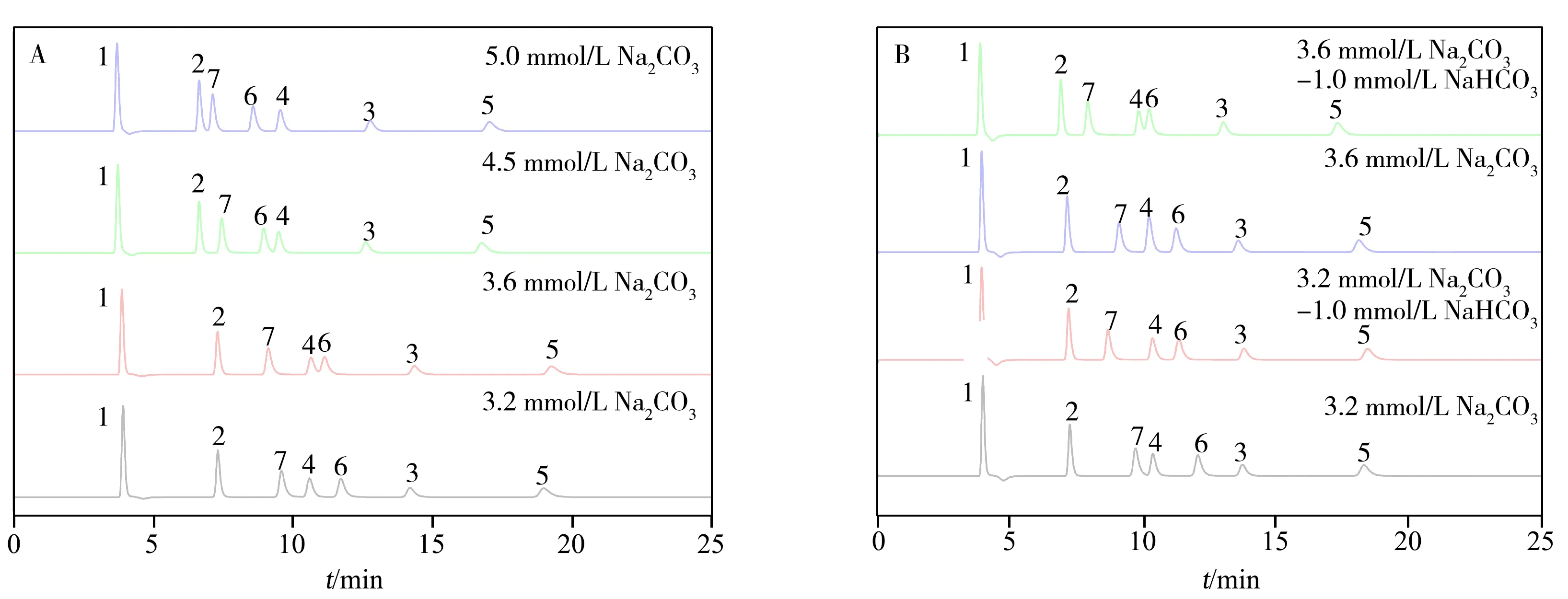
图6 HSD柱在不同淋洗液质量浓度下分离7种阴离子(10.0 mg/L)的色谱图Fig.6 Chromatograms of 7 anions(10.0 mg/L) in different types of eluents using HSD column 1.0 mL/min,40 ℃;peaks:1.F-,2.Cl-,3.Br-,4.NO2-,5.NO3-,6.SO42-,7.HPO42-
2.4 实际样品测定
为进一步验证离子色谱柱的稳定性及实用性,将HSD 色谱柱用于实际样品中阴离子的检测。地表水、自来水和工业废水均于2023 年6月采自广东省,样品采集后1~5 ℃避光冷藏,24 h 内上机检测。配制7 种阴离子的标准溶液(0.05~50.0 mg/L),并绘制标准曲线,见表3。结果显示7 种阴离子线性关系良好,相关系数(r2)均不低于0.995。以信噪比S/N=3 计算检出限(LOD),S/N=10 计算定量下限(LOQ),得到各目标物的LOD和LOQ分别为0.003~0.160 mg/L和0.010~0.530 mg/L。
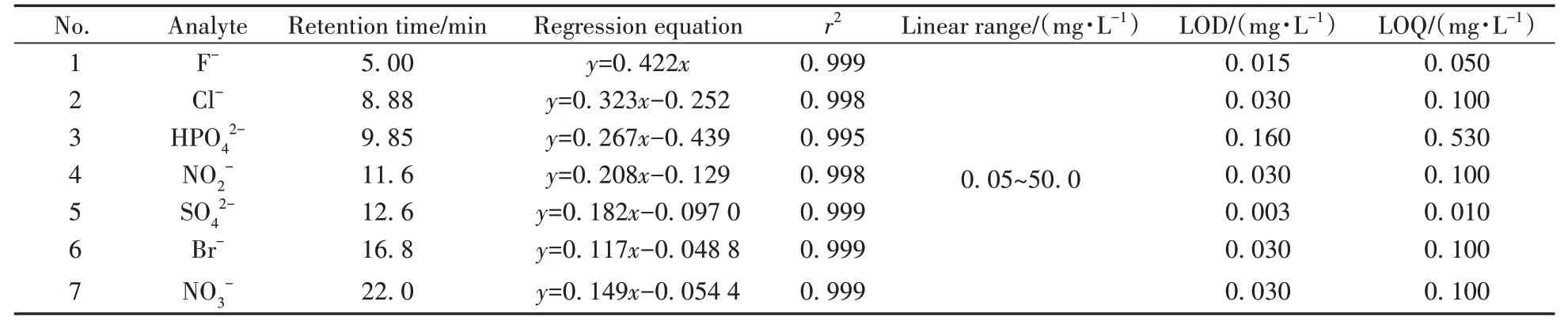
表3 7种阴离子的保留时间、线性关系和在地表水、自来水和工业废水中的检出限和定量下限Table 3 Retention times,linear relationships of 7 anions and their detection limits and quantitation limits in surface water,tap water and wastewater
每个样品平行测定3 次,得到地表水中F-、Cl-、SO42-、NO3-的质量浓度分别为0.18、4.35、15.39、4.38 mg/L,其他离子未检出;自来水中F-、Cl-、SO42-、NO3-的质量浓度分别为0.12、9.68、15.20、8.10 mg/L;工业废水中F-、Cl-、SO42-、Br-的质量浓度分别为0.32、323.83、149.88、1.79 mg/L。离子色谱柱对自来水、地表水、工业废水样品中阴离子检测的相对标准偏差(RSD,n=3)为0.17%~3.7%。
2.5 HSD色谱柱的理论塔板数
以7 种常见阴离子(F-、Cl-、HPO42-、NO2-、SO42-、Br-、NO3-)和5 种常见酸根离子(CH3COO-、ClO2-、BrO3-、ClO3-、C2O42-)为目标物,考察HSD色谱柱同时分离常见阴离子和酸根离子的效果,色谱图如图7所示。在40 ℃、1.0 mL/min、3.6 mmol/L Na2CO3淋洗液条件下,HSD 色谱柱可在20 min 内完全分离上述12 种离子,相关色谱参数及理论塔板数见表4。由表可知,12 种离子色谱峰的拖尾因子、分离度良好,能够满足日常检测需求。
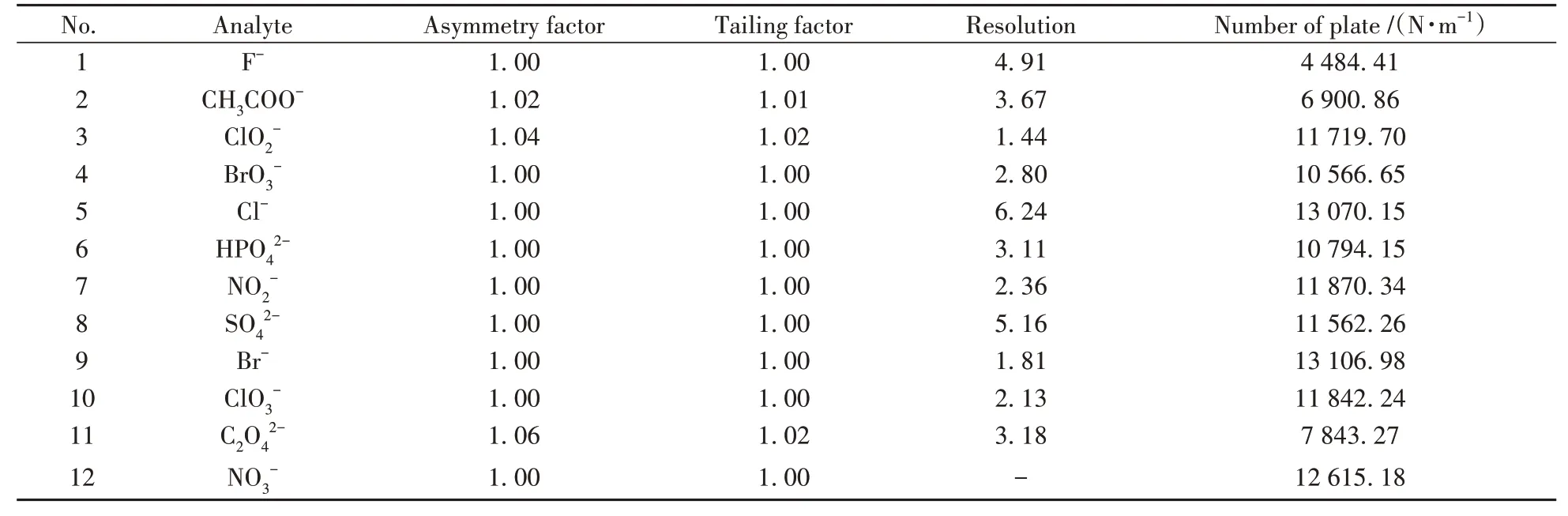
表4 12种离子的不对称因子、拖尾因子、分离度、理论塔板数Table 4 Asymmetry factor,tailing factor,resolution and number of theoretical plate of 12 anions
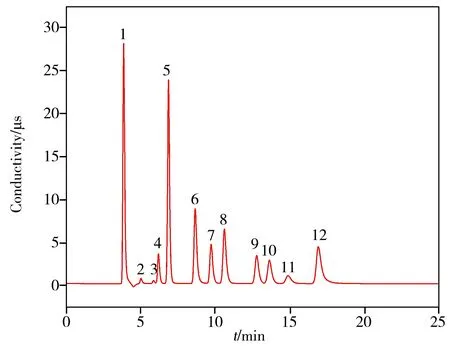
图7 HSD柱分离12种离子(5.0 mg/L)的色谱图Fig.7 Chromatogram of 12 anions(5.0 mg/L) separated using HSD column
3 结 论
本文以OSD为基质微球,通过磺化反应引入磺酸基团,再通过超支化修饰引入叔胺和季胺功能基团,制备出亲水型离子色谱固定相。通过SEM、BET、FTIR、XPS 等方法表征阴离子固定相的形貌和结构,并填充成色谱柱考察了其分离性能。结果显示,磺化和超支化修饰方式可引入大量羟基基团,有效增加固定相的亲水性,改变固定相对离子的选择性,使二价离子(SO42-、HPO42-)的保留低于一些一价离子(Br-、NO3-)。在3.6 mmol/L Na2CO3淋洗液条件下,制备的色谱柱可在20 min内实现12种离子的完全分离。将制备的HSD色谱柱用于实际样品检测,目标离子的RSD均低于4.0%,表现出良好的应用前景。

